二维斑点追踪超声心动图评价不同左心室舒张功能状态下的左心房收缩功能
尹光宇YIN Guangyu
任卫东1REN Weidong
二维斑点追踪超声心动图评价不同左心室舒张功能状态下的左心房收缩功能
尹光宇1,2YIN Guangyu
任卫东1REN Weidong
目的探讨由斑点追踪超声心动图成像技术衍生的应变及应变率评价不同左心室舒张功能状态下左心房收缩功能的变化。资料与方法根据左心室舒张功能状态,将111例研究对象分为正常组(47例)、舒张功能轻度减低组(35例)、假性正常化组(18例)及限制性充盈状态组(11例)。应用斑点追踪超声心动图成像得到左心房12个节段(2个切面)的纵向应变及应变率曲线。通过取左心房12个节段的房缩期峰值纵向应变及应变率绝对值的平均值,得到左心房整体房缩期峰值纵向应变(GPALSA)和左心房整体房缩期峰值纵向应变率(GPALSRA)。比较各组GPALSA和GPALSRA的差异。结果舒张功能轻度减低组GPALSA值高于正常组(P<0.05),而从假性正常化组到限制性充盈组GPALSA值较正常组逐渐减小(P<0.05);舒张功能轻度减低组GPALSRA值与正常组比较差异无统计学意义(P>0.05),从假性正常化组到限制性充盈组GPALSRA值逐渐减小(P<0.05)。结论随左心室舒张功能减低程度逐渐加重,左心房收缩功能呈轻度增强而后减弱的趋势。
超声心动描记术,多普勒,彩色;斑点追踪成像;心舒期;心房功能,左
心脏是血液循环的原动力,舒张抽吸血液功能和收缩射血功能一样重要,两者联系密切。多数因心力衰竭导致的水肿等症状均与舒张功能障碍密切相关[1]。左心室舒张功能通常分为正常、左心室舒张功能轻度减低、假性正常化充盈、限制性充盈4种状态[2]。左心房和左心室在结构和功能上相互联系、相互影响。在血流动力学方面,左心室的舒张功能与左心房的功能联系最为紧密。在血液从肺静脉进入左心房,再进入左心室的过程中,左心房先后起到存储、通道和助力泵的作用[3]。左心房功能是左心室充盈的决定因素之一[4],故左心房的大小和功能会受到左心室充盈压和左心室舒张功能状态的影响。左心房功能和容积变化既可以很好地评价左心室舒张功能,同时也能早期预示某些疾病的病理生理发展和变化[5],其在预测心血管事件的危险性、病死率和预后方面有重要价值[6]。二维斑点追踪超声心动图成像技术(speckle tracking echocardiography, STE)是一项新的、可靠的、无角度依赖性的技术,是基于标准的二维灰阶超声图像,实时跟踪心肌内回声斑点的空间运动[7]。既往研究应用二维STE通过左心房整体纵向应变或应变率来估测左心房功能[8,9]。本研究拟通过由STE衍生的应变及应变率来评估不同左心室舒张功能状态下左心房的收缩功能。
1 资料与方法
1.1 研究对象 纳入2010-12~2011-08共111例研究对象,包括47例志愿者和64例患者,其中男54例,女57例;年龄24~79岁,平均(53.9±12.6)岁;高血压病23例,冠心病21例,扩张型心肌病9例,肥厚型心肌病3例(临床第一诊断),其余8例在进行超声心动图检查时暂未确诊或发现与心脏结构及功能直接相关的疾病(表1)。所有研究对象在中国医科大学附属盛京医院行超声心动图检查。排除标准:①各种心律不齐及传导异常者,包括心房纤颤、植入人工起搏器者;②二尖瓣狭窄者;③中度及以上二尖瓣或主动脉瓣反流者;④室间隔运动异常:包括各种原因导致的右心室容量或压力负荷过重者;⑤各种原因引起的心房壁僵硬,包括缩窄性心包炎等;⑥图像质量不佳,不适合做后期处理者;⑦根据二尖瓣瓣口血流频谱、二尖瓣环组织多普勒及二维超声心动图的综合评估,不能确切认定左心室舒张功能状态者。

表1 研究对象的基本资料及患病组成情况
1.2 仪器与方法
1.2.1 二维超声心动图 采用Philips iE33超声仪,受检者取左侧卧位,连接胸前三导联心电图,用S5-1探头扫查,包括二维超声心动图、脉冲多普勒、组织多普勒、彩色多普勒血流显像,探头频率1~5 MHz。于标准心尖四腔心切面、心尖二腔心切面,清晰显示完整的左心房。通过调整扫描宽度、深度或者采取局部放大模式,使动态图像的帧频>65帧/s。嘱患者平静呼气末屏气数秒后,存储动态图像。在心尖四腔心切面开放的二尖瓣瓣尖中间取样,获得脉冲多普勒的频谱,记录舒张早期峰值速度(peak velocities of mitral infows in early diastole, E)、房缩期峰值速度(peak velocities of mitral infows in atrial systole, A)及舒张早期E峰减速时间(deceleration time of the E-wave velocity, DT)。在心尖四腔心切面采用组织多普勒的模式,记录舒张早期二尖瓣环室间隔侧峰值速度(early diastolic mitral annular peak velocities of septal side, e's)及舒张早期二尖瓣环外侧壁侧峰值速度(early diastolic mitral annular peak velocities of lateral side, e'l)。计算舒张早期二尖瓣环室间隔侧和外侧壁侧峰值速度的平均值(mitral annular average peak velocities in early diastole, em)、E/A以及E/e's和E/e'l的平均值(average E/e' of two side of mitral annulus, Av.E/e')。
1.2.2 分组标准 参照二尖瓣瓣口血流频谱、二尖瓣环组织多普勒及二维超声心动图综合评估结果确定左心室舒张功能状态[2],根据美国超声心动图协会和欧洲超声心动图协会于2009年发布的左心室舒张功能评估指南[10]进行分组:①正常组(47例):E/A>1,em>8 cm/s,160 ms
1.3 图像分析 采用QLab 8.1进行图像分析:选用CMQ中的Free strain功能,在心尖二腔心切面或四腔心切面,沿左心房壁选取7个追踪点(包括二尖瓣环的2个点,不包括肺静脉入口、卵圆窝处),尽量使相邻两点间的距离相等。软件追踪计算形成相邻两点间的6条应变曲线和应变率曲线(图1~4),导出数据计算每个节段应变及应变率的平均值,形成左心房的平均应变及应变率曲线。测量心尖二腔心及四腔心两个切面的左心房房缩期平均峰值应变及应变率,计算两个切面连续3个周期的平均值,得到左心房整体房缩期峰值纵向应变(global peak left atrial longitudinal strain of atrial contraction, GPALSA)及左心房整体房缩期峰值纵向应变率(global peak left atrial longitudinal strain rate of atrial contraction, GPALSRA)。随机抽取20例研究对象的图像信息,2个月后分别由同一名观察者和另外一名观察者对其进行图像分析及GPALSA、GPALSRA测值,以评估GPALSA及GPALSRA测值的可重复性。
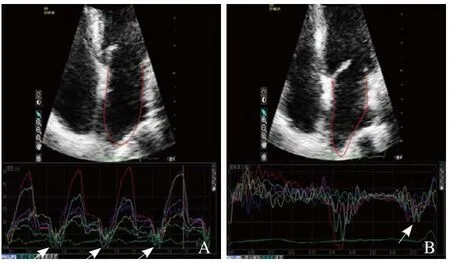
图1 应变和应变率曲线。A为正常人连续4个周期左心房心尖四腔心切面6个节段的纵向应变曲线,箭示房缩期6个节段纵向峰值应变所形成的波谷群;B为正常人左心房心尖四腔心切面6个节段连续3个周期平均应变率曲线,箭示房缩期6个节段纵向峰值应变率所形成的波谷群
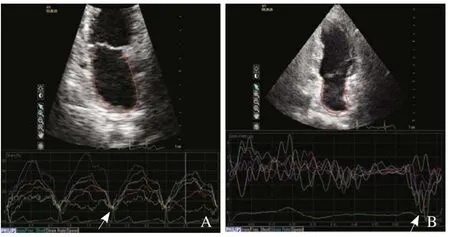
图2 应变和应变率曲线。A为左心室舒张功能轻度减低患者连续4个周期左心房心尖二腔心切面6个节段的纵向应变曲线,箭示房缩期6个节段纵向峰值应变所形成的波谷群;B为左心室舒张功能轻度减低患者左心房心尖二腔心切面6个节段连续3个周期平均应变率曲线,箭示房缩期6个节段纵向峰值应变率所形成的波谷群

图3 应变和应变率曲线。A为左心室舒张功能中度减低(假性正常化)患者连续3个周期左心房心尖二腔心切面6个节段的纵向应变曲线,箭示房缩期6个节段纵向峰值应变所形成的波谷群;B为左心室舒张功能中度减低(假性正常化)患者左心房心尖二腔心切面6个节段连续3个周期平均应变率曲线,箭示房缩期6个节段纵向峰值应变率所形成的波谷群

图4 应变和应变率曲线。A为左心室舒张功能重度减低(限制性充盈)患者连续4个周期左心房心尖二腔心切面6个节段的纵向应变曲线,箭示房缩期6个节段纵向峰值应变所形成的波谷群;B为左心室舒张功能重度减低(限制性充盈)患者左心房心尖二腔心切面6个节段连续3个周期平均应变率曲线,箭示房缩期6个节段纵向峰值应变率所形成的波谷群
1.4 统计学方法 采用SPSS 17.0软件,计量资料多组间比较采用单因素方差分析,两两比较采用Scheffe's检验,P<0.05表示差异有统计学意义。观察者内部及观察者间GPALSA、GPALSRA测值的可重复性采用Bland-Altman法进行检验。
2 结果
2.1 4组超声心动图测量参数比较 4组受检者超声心动图测量变量见表2。各组间GPALSA值差异均有统计学意义(P<0.05),轻度减低组GPALSA值高于正常组,而从假性正常化组到限制性充盈组GPALSA值较正常组逐渐减小;正常组和轻度减低组GPALSRA值差异无统计学意义(P>0.05),其余各组间GPALSRA值差异均有统计学意义(P<0.05),从假性正常化组到限制性充盈组GPALSRA值较正常组及舒张功能轻度减低组逐渐减小;假性正常化组与轻度减低组及限制性充盈组间心率差异均有统计学意义(P<0.05),限制性充盈组与其他3组间差异均有统计学意义(P<0.05),正常组与轻度减低组及假性正常化组间差异无统计学意义(P>0.05)。

表2 4组受检者超声心动图测量参数比较
2.2 一致性检验 Bland-Altman分析显示,观察者内及观察者间的GPALSA值及GPALSRA值可重复性较好。观察者内及观察者间GPALSA值的平均差异±2倍标准差分别为(0.31±4.55)%、(0.80±6.69)%(图5);观察者内及观察者间GPALSRA值的平均差异±2倍标准差分别为(0.04±0.48)s-1和(-0.11±0.66)s-1(图6)。

图5 观察者内(A)及观察者间(B)的GPALSA测量一致性
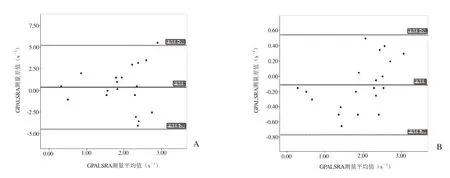
图6 观察者内(A)及观察者间(B)的GPALSRA测量一致性
3 讨论
本研究发现GPALSA值随着舒张功能逐渐减低呈先略升高,然后逐渐减低的变化趋势;而GPALSRA在前两组的值比较稳定,从假性正常化组开始随着舒张功能的减低而逐渐减小;正常组及轻度减低组心率比较无明显差异,假性正常化组心率较舒张功能轻度减低组减慢,而限制性充盈组相对于其他3组则明显加快。
在心室收缩期,心肌纤维的收缩从心脏纵轴角度,心底部向下移动,这种移动促使血液经肺静脉进入左心房,形成左心房的充盈。在心室舒张期,左心房通过被动及主动的方式促使左心室充盈的完成。由于在心室舒张期,通过由心室舒张压力下降形成的左心室与左心房压差而开放的二尖瓣,左心房和左心室连通,血流顺压差方向由左心房流入左心室,因此左心室的舒张功能状态会对左心房的排空产生决定性的影响[4]。左心房的收缩功能,即左心房的助力泵功能是在左心室舒张末期,左心房心肌收缩时主动泵血到左心室,增加左心室舒张晚期左心室的充盈。左心室的舒张功能下降超过一定的程度,即会伴有左心室充盈压力升高,而左心室充盈压力是在左心房腔内形成的,直接作用于左心房,故左心室充盈压力升高伴有左心房内压力升高。持续升高或者长期维持较高的左心房内压力,在致使左心房容积增大的同时,心肌由于受到过度牵拉,也会出现结构、电生理和功能的变化[11],这种变化导致左心房心肌的收缩能力逐渐下降。左心房的应变和应变率体现了左心房容积的变化方式,GPALSA和GPALSRA产生于左心室舒张期的心房收缩期,体现了左心房的助力泵功能及左心房心肌的收缩能力。
本研究结果符合关于左心房的Frank-Starling定律[12]。在左心室舒张功能轻度减低时,GPALSA略有升高,而GPALSRA与正常组比较无明显差异,表明左心室在舒张功能减低的初期,左心室充盈压力轻度升高,左心房容积略增大的条件下,左心房心肌前负荷略增加使得左心房心肌纤维受牵拉至接近或者达到、甚至略超过最适合初长度,左心房的助力泵功能相对正常组略增强,这也体现了左心房泵功能在左心室舒张功能轻度减低时有所增强的循环代偿机制。左心室舒张功能中度减低(假性正常化)时,左心室充盈压力增高,左心房容积增大,左心房心肌在长期左心房内压力升高的作用下,受牵拉过度,开始出现变性、纤维化等形态学及病理生理的变化[13],GPALSA及GPALSRA均减低,体现在左心室舒张功能中度减低时左心房心肌收缩能力减低,左心房的收缩功能逐渐失去了对左心室舒张功能减低的代偿能力。左心室舒张功能重度减低(限制性充盈),通常意味着左心室收缩、舒张功能都下降到了最严重的程度,肺静脉淤血,左心室充盈压力进一步升高,左心房、左心室容积均增大,左心室心肌主动舒张能力严重下降,二尖瓣开放后左心室舒张早期左心房、左心室压力差维持时间及左心室充盈时间减短,DT变短,在这个阶段的患者很多出现房性心律失常[13];在未出现房性心律失常的舒张功能重度减低者中,GPALSA和GPALSRA进一步减低,左心房心肌收缩能力及左心房的助力泵功能很微弱。
本研究发现,心率在不同左心室舒张功能减低状态下有一定的差异。假性正常化组心率较轻度减低组及限制性充盈组慢,尽管心率多在正常范围内,可能在左心室舒张功能减低、左心室充盈压力升高的病理生理过程中,心率或其代偿机制起到一定的作用。
总之,左心房的收缩功能受左心室舒张功能的影响,随着左心室舒张功能减低程度逐渐加重呈轻度增强而后减弱的趋势。本研究进一步验证了左心房与左心室在功能上的密切关系以及左心房大小和功能的变化在心力衰竭发生及发展过程中的意义,目前尚需要更多的研究探讨心房的结构、功能以及病理生理变化。
本研究应用二维切面的应变及应变率来评估三维空间的心房心肌纵向形变,但由于时间所限,而且左心房舒张功能障碍中晚期且不伴有心律失常或(和)中度以上瓣膜反流的患者相对较少,所以假性正常化组及限制性充盈组的样本含量较小,有待进行一步增加样本完善研究。
[1] Vogel MW, Slusser JP, Hodge DO, et al. The natural history of preclinical diastolic dysfunction: a population-based study. Circ Heart Fail, 2012, 5(2): 144-151.
[2] Little WC, Oh JK. Echocardiographic evaluation of diastolic function can be used to guide clinical care. Circulation, 2009, 120(9): 802-809.
[3] Appleton CP, Kovács SJ. The role of left atrial function in diastolic heart failure. Circ Cardiovasc Imaging, 2009, 2(1): 6-9.
[4] Karayannis G, Kitsios G, Kotidis H, et al. Left atrial remodelling contributes to the progression of asymptomatic left ventricular systolic dysfunction to chronic symptomatic heart failure. Heart Fail Rev, 2008, 13(1): 91-98.
[5] 吴昆, 杜维桓, 郑春华, 等. 实时全容积三维超声心动图评价肥厚型心肌病左房容积和功能. 中国医学影像学杂志, 2012, 20(11): 838-841.
[6] Kurt M, Wang J, Torre-Amione G, et al. Left atrial function indiastolic heart failure. Circ Cardiovasc Imaging, 2009, 2(1): 10-15.
[7] Cameli M, Caputo M, Mondillo S, et al. Feasibility and reference values of left atrial longitudinal strain imaging by two-dimensional speckle tracking. Cardiovasc Ultrasound, 2009, 7: 6.
[8] Saraiva RM, Demirkol S, Buakhamsri A, et al. Left atrial strain measured by two-dimensional speckle tracking represents a new tool to evaluate left atrial function. J Am Soc Echocardiogr, 2010, 23(2): 172-180.
[9] Kim DG, Lee KJ, Lee S, et al. Feasibility of two-dimensional global longitudinal strain and strain rate imaging for the assessment of left atrial function: a study in subjects with a low probability of cardiovascular disease and normal exercise capacity. Echocardiography, 2009, 26(10): 1179-1187.
[10] Nagueh SF, Appleton CP, Gillebert TC, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography. Eur J Echocardiogr, 2009, 22(2): 107-133.
[11] Rossi A, Temporelli PL, Quintana M, et al. Independent relationship of left atrial size and mortality in patients with heart failure: an individual patient meta-analysis of longitudinal data (MeRGE Heart Failure). Eur J Heart Fail, 2009, 11(10): 929-936.
[12] Anwar AM, Geleijnse ML, Soliman OI, et al. Left atrial Frank-Starling law assessed by real-time, three-dimensional echocardiographic left atrial volume changes. Heart, 2007, 93(11): 1393-1397.
[13] Rosenberg MA, Manning WJ. Diastolic dysfunction and risk of atrial fbrillation: a mechanistic appraisal. Circulation, 2012, 126(19): 2353-2362.
(本文编辑 张春辉)
Left Atrial Systolic Function in Different Left Ventricular Diastolic Function Patterns with Two-dimensional Speckle Tracking Echocardiography
PurposeTo explore changes of left atrial (LA) systolic function in different left ventricular (LV) diastolic functional conditions by using strain and strain rate derived from two-dimensional speckle tracking echocardiography (STE).Material and MethodsAccording to the LV diastolic function pattern, 111 subjects were divided into normal filling group, impaired relaxation group, pseudo-normal filling group and restrictive filling group. The curves of longitudinal strain and strain rate in 12 segments of LA were obtained by STE. Global peak left atrial longitudinal strain of atrial contraction (GPALSA) and global peak left atrial longitudinal strain rate of atrial contraction (GPALSRA) were obtained by averaging all LA segmental corresponding longitudinal strain values derived from STE in 2-chamber and 4-chamber views. Then comparisons of GPALSA and GPALSRA among four groups were made.ResultsCompared with that in the normal group, GPALSA in impaired relaxation group was higher (P<0.05), and it gradually decreased from pseudo-normal flling group to restrictive flling group (P<0.05). GPALSRA showed no difference between impaired relaxation group and normal group (P>0.05) and it gradually decreased from pseudo-normal flling group to restrictive flling group (P<0.05).ConclusionLA systolic function mildly rises at beginning then declines as diastolic function gets worse.
Echocardiography, Doppler, color; Speckle tracking imaging; Diastole; Atrial function, left
1.中国医科大学附属盛京医院超声科 辽宁沈阳 110004
2.辽宁中医药大学附属医院超声心电中心辽宁沈阳 110032
任卫东
Department of Ultrasonography, Shengjing Hospital of China Medical University,
Shenyang 110004, China
Address Correspondence to: REN Weidong
E-mail: renweidong01@126.com
R541;R445.1
2014-02-02
修回日期:2014-07-16
中国医学影像学杂志
2014年 第22卷 第8期:585-590
Chinese Journal of Medical Imaging
2014 Volume 22(8): 585-590
10.3969/j.issn.1005-5185.2014.08.008

