小鼠脊髓损伤后周细胞促进脊髓血管新生
荆瀛黎,武清斌,苑晓晨,李炳蔚,刘明明,张晓艳,刘淑英,李宏伟,修瑞娟
(中国医学科学院北京协和医学院卫生部微循环重点实验室微循环研究所,北京100005)
脊髓损伤(spinal cord injury,SCI)可导致血管破裂和血管内皮细胞丢失。血管损伤可继发性引起缺氧、缺血和炎性反应等病理反应。研究表明脊髓损伤后的血管新生有利于患者运动功能的恢复;血管密度增加与运动功能的提高密切相关[1-2]。
周细胞定位在微血管表面,对血管新生、血管重塑及稳定性等均有重要作用[3]。脊髓微血管周细胞覆盖率较外周组织更高,提示脊髓周细胞可能具有更为重要的功能[3-4]。近年来,已有学者关注周细胞在中枢神经系统疾病病理变化中的作用,如脑缺血时周细胞大量丢失[5],提示周细胞缺失可能与脑、脊髓等中枢神经系统微血管功能异常有关[6]。本研究拟探讨周细胞在脊髓损伤后脊髓微血管新生中的作用。
1 材料与方法
1.1 材料
1.1.1 主要试剂:FITC-番茄凝集素(lycopersicon esculentum agglutinin lectin,LEA)(Sigma 公司);兔单克隆PDGFRβ 抗体、兔多克隆CD13 抗体和山羊单克隆CD31 抗体(Abcam 公司);FITC-标记的山羊抗兔抗体和TRITC-标记的兔抗山羊抗体(Santa Cruz 公司)。
1.1.2 实验动物:SPF 级雄性C57BL/6(18 ~22 g)小鼠36 只[中国医学科学院医学实验动物研究所,许可证号SCXK(京)2009-0007]。本实验方案已获得中国医学科学院微循环研究所实验动物伦理委员会批准。
1.2 方法
1.2.1 脊髓损伤小鼠模型的建立及分组:将36 只小鼠随机分为椎板切除术组(sham 组),损伤后2、7和14 d 组(S2、S7 和S14 组),9 只/组。俯卧位固定并麻醉小鼠,参照文献[7-8]中方法对T10 脊髓行椎板切除术,制备脊髓损伤模型,以鼠尾出现无规则痉挛性摆动为造模成功标志。
1.2.2 血管内注射凝聚素(FITC-LEA)检测灌注血管:麻醉,仰卧位固定小鼠,右侧颈外静脉插管,注射100 μg/100 μL FITC-LEA,体内循环30 min 后,灌流取材。
1.2.3 图像分析:冰冻切片的免疫荧光检测血管面积,冰冻切片的免疫组化检测血管密度。计算LEA/CD31 标记的微血管(直径<100 μm)面积,LEA/CD31 标记的微血管面积与照片中整个视野的面积比值即为灌注血管的百分数。覆盖在微血管上PDGFRβ/CD13 阳性细胞面积与CD31 标记微血管面积的比值即为周细胞的覆盖率。
1.2.4 成管能力的测定:将脊髓微血管内皮细胞和/或脊髓微血管周细胞接种于包被好的96 孔板中。8 h 后分别观察正常和缺氧条件下(95% N2和5% CO2)的成管情况,以成管总长度来衡量成管能力,实验重复3 次。
1.3 统计学分析
采用SPSS 17.0 对数据进行统计学分析。计数数据用均值±标准差(±s)表示,符合正态分布的用t 检验或单因素方差分析,非正态分布资料用秩和检验。
2 结果
2.1 小鼠SCI 后灌注血管的变化
假手术组脊髓组织的白质和灰质中可见明显的灌注血管,尤其是高度血管化的灰质,S2 组灌注血管数明显降低,S14 组灌注血管有所回升(图1A)。3 组的灌注微血管面积显著低于假手术组(P<0.001,P<0.01)。与S2 组相比,S14 组灌注血管面积明显回升(P<0.05)(图1B)。
2.2 小鼠SCI 后微血管的变化
图2A 显示,与假手术组比,S2 组CD31-免疫阳性内皮细胞明显降低,反映了血管数显著下降,S7、S14 组血管数逐渐增加。3 组的微血管面积显著低于假手术组(P<0.001,P<0.05)。与S2 组相比,S7、S14 组微血管面积显著回升(P<0.05,P<0.01)(图2B)。
2.3 小鼠SCI 后微血管密度的变化
图3A 显示,与假手术组相比,S2 组微血管密度明显降低,而S7 与S14 组血管密度均有不同程度的增加。S2 和S7 组的微血管密度显著低于假手术组(P<0.01,P<0.05)。S14 组微血管密度回升并接近正常。与S2 组相比,S7、S14 组微血管密度显著回升(P<0.05,P<0.01)(图3B)。
2.4 小鼠SCI 后周细胞覆盖率的变化
与假手术组相比,S2 和S7 组周细胞覆盖率显著降低,S14 组周细胞在微血管的定位不清,无法统计(图4A,B)。S2 和S7 组的周细胞覆盖率显著低于假手术组(P<0.001)。与S2 组相比,S7 组周细胞覆盖率显著下降(P<0.05),S14 周细胞在微血管上的定位不清,无法进行统计(图4C,D)。
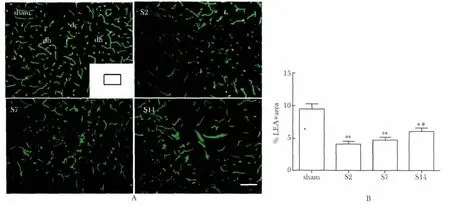
图1 小鼠SCI 后LEA 标记微血管的变化情况Fig 1 The alteration of LEA-labeled micro-vessels after SCI in mice

图2 小鼠SCI 后CD31 标记微血管的变化情况Fig 2 The alteration of CD31-labeled micro-vessels after SCI in mice

图3 小鼠SCI 后微血管密度的变化情况Fig 3 The alteration of micro-vessel density after SCI in mice

图4 小鼠SCI 后PDGFRβ 阳性或CD13 阳性周细胞覆盖率的变化Fig 4 The alteration of PDGFRβ-positive or CD13-positive pericyte coverage after SCI in mice

图5 周细胞促进缺氧条件下内皮成管Fig 5 Pericytes promote endothelial tubular formation under anoxia
2.5 周细胞促进缺氧条件下内皮成管
缺氧环境可显著抑制内皮细胞成管,内皮细胞和周细胞共培养可逆转缺氧对内皮细胞成管的破坏(图5A)。不同比例(1∶1 或1∶10)周细胞的加入均可显著增加缺氧条件下内皮细胞的成管长度(P<0.01)(图5B)。
3 讨论
脊髓损伤早期,大量内皮细胞丢失,机体通过血管新生进行内源性损伤修复。内源性损伤修复未提供充足的血液供应,使损伤部位持续处于缺氧、缺血状态,导致脊髓组织细胞进一步死亡。本研究表明脊髓损伤后血管面积和血管密度进行性增加,可能与上述内源性损伤修复有关。
周细胞覆盖率的降低伴随血管密度的下降,血管直径增加、迂曲、灌注降低等不正常特征可能为脊髓损伤早期脊髓微循环的病理改变。周细胞在缺氧条件下能促进内皮的成管,提示脊髓损伤后血管新生水平的不足可能与周细胞覆盖率的降低有关。周细胞覆盖率可能决定了脊髓损伤时脊髓微血管的灌注水平。有研究表明,成年小鼠血管壁上周细胞募集的降低会引起微血管灌注不足和血脑屏障障碍[9]。本研究结果同样发现,脊髓损伤小鼠周细胞覆盖率的降低与新生血管较低灌注水平有关,提示周细胞覆盖率对脊髓损伤后新生微血管的灌注水平具有重要意义,提高脊髓周细胞覆盖率可能有助于脊髓损伤修复的进行。
综上,本研究发现内皮细胞成管功能及脊髓损伤后内源性损伤修复可能与脊髓周细胞密切相关。因此,周细胞可作为脊髓损伤修复的治疗新靶点之一,脊髓微循环及脊髓周细胞在脊髓损伤修复中的机制仍有待于进一步研究。
[1]Glaser J,Gonzalez R,Sadr E,et al.Neutralization of the chemokine CXCL10 reduces apoptosis and increases axon sprouting after spinal cord injury[J].J Neurosci Res,2006,84:724-734.
[2]颜建辉,黄丽娟,杨柳,等.N-cadherin 对大鼠脊髓损伤后移植神经干细胞存活、增殖与迁移的影响[J].基础医学与临床,2014,34:372-375.
[3]Daneman R,Zhou L,Kebede AA,et al.Pericytes are required for blood-brain barrier integrity during embryogenesis[J].Nature,2010,468:562-566.
[4]Armulik A,Genove G,Mae M,et al.Pericytes regulate the blood-brain barrier[J].Nature,2010,468:557-561.
[5]Fernandez-Klett F,Potas JR,Hilpert D,et al.Early loss of pericytes and perivascular stromal cell-induced scar formation after stroke[J].J Cereb Blood Flow Metab,2013,33:428-439.
[6]Geraldes P,Hiraoka-Yamamoto J,Matsumoto M,et al.Activation of PKC-delta and SHP-1 by hyperglycemia causes vascular cell apoptosis and diabetic retinopathy[J].Nat Med,2009,15:1298-1306.
[7]Reis FM,Esteves AM,Tufik S,et al.Plasma iron levels appraised 15 days after spinal cord injury in a limb movement animal model[J].Spinal Cord,2011,49:361-364.
[8]吴超,余上斌.临床相关的脊髓损伤动物模型新进展[J].基础医学与临床,2012,32:969-970.
[9]Bell RD,Winkler EA,Sagare AP,et al.Pericytes control key neurovascular functions and neuronal phenotype in the adult brain and during brain aging[J].Neuron,2010,68:409-427.

