RUNX3与消化系肿瘤的研究进展
武雪亮,王立坤,薛 军*,贾光辉,屈 明,赵秀芳
(河北北方学院附属第一医院1.血管腺体外科;2.超声医学科;3.病理科,河北张家口075000)
1 RUNX3 基因及蛋白的结构和功能
RUNX3 基因定位于染色体1P36.1,有6 个外显子和1 290 bp 的开放阅读框,全长67 kb,mRNA有两种变异剪切体,COS 区上游含有P1、P2 两个启动子,负责RUNX3 的转录调节,且主要由P2 操纵。由于P2 启动子位于外显子2 之前,GC 含量高(cytosine-phosphate-guanine,CpG)岛,而CpG 岛具有GC 启动子的特征,因而更易发生甲基化[1-2]。
RUNX3 蛋白是由α 和β 亚单位构成的包含415 个氨基酸残基的异二聚体,分子质量约为44 ku。α 亚单位含有一个128 氨基酸组成的Runt domain(RD)保守域,位于氨基的末端。RD 内含有一个S 形免疫球蛋白折叠,介导RD 与目标基因DNA 的结合以及核心结合因子、蛋白之间的相互作用。β 亚单位由134 个氨基酸残基组成,能增强RD 与目标DNA 的结合力,维持其正常调控功能。RUNX3 蛋白的羧基端富含丝氨酸和脯氨酸,通过结合靶DNA 来调控RUNX3 的转录。
2 RUNX3 基因调控机制
研究证实,RUNX3 主要通过调控TGF-β 和Wnt信号传导通路来抑制肿瘤细胞的形成(图1)[3-5]。TGF-β 能够诱导细胞凋亡,是多种细胞生长的抑制因子。RUNX3 是TGF-β 信号传导的通路下游的一个重要的转录因子,其所含的RD 区域负责结合靶DNA。TGF-β 激活后与TGF-β 受体Ⅰ和Ⅱ(TpRⅠ和TpRⅡ)相结合,产生异四聚体复合物(TpRC),触发细胞内信号通路。TGF-β 信号传导主要是通过激活Smad 蛋白来实现的,TGF-β 信号传导通路的配体、受体和胞内信号传导分子Smad 蛋白组成一个抑制肿瘤信号的通路[6]。Smad 复合物须在RUNX蛋白(包括RUNX3 蛋白)的指导下,才能从细胞质内转入特定的靶位点,与RUNX 蛋白共同转录激活靶基因,从而对细胞分化、细胞周期调控、凋亡和恶性转化起作用。RUNX3 蛋白是P21 基因下游调控因子,RUNX3 和Smad3 协同表达时P21 启动子被激活,P21 能够增强肿瘤细胞中促凋亡基因Biml 的转录和周期依赖激酶抑制因子P21WAFI 的表达,使细胞停滞于G1期,细胞增殖受抑制[7-8]。当恢复RUNX3 的表达时,bcl-2 的表达出现了下调,并且P27、caspase3 和caspase9 的表达出现上调,正是通过这样的途径,RUNX3 再次恢复对细胞增殖和凋亡的调控,促进细胞凋亡。
Wnt 信号通路是调控机体胚胎及器官发育的重要信号通路之一,在细胞增殖、分化、极化、黏附和运动等生理过程中发挥重要作用[9];许多肿瘤的发病涉及经典Wnt 通路的异常持续性激活。RUNX3可以与Wnt 信号通路的关键效应器TCF4 和β-catenin 形成复合物,抑制TCF4-β-catenin 与靶DNA 的结合,从而减弱目标基因的转录。
最新研究发现Wnt 信号通路是诱导上皮-间质转化(epithelial-mesenchymal transition,EMT)产生的关键信号传导通路。RUNX3 通过直接调控封闭蛋白-1 的转录参与EMT 的调控,保护失巢凋亡,从而抑制肿瘤的侵袭和转移,但其具体机制仍需进一步研究确定。此外,RUNX3 可以通过调节对VEGF 等参与血管生成的相关基因以及CRK-11、TIMP-1 等分子的表达抑制胃肠道肿瘤细胞侵袭转移的能力[10]。
3 RUNX3 与食管癌
应用RT-PCR、免疫组化、MSP 等方法检测60例食管鳞癌患者中的RUNX3 的表达情况,显示在RUNX3 阴性组,RUNX3 的表达水平对患者预后的存活率有着明显的影响,淋巴管的广泛侵袭和淋巴结的转移数目显著高于阳性组[11]。用MSP 的方法分析在70 例食管鳞癌、20 例食管良性病变以及10例健康志愿者血清标本中RUNX3 基因启动子区域甲基化情况,发现70 例食管鳞癌中RUNX3 基因启动子区域异常甲基化的有36 例,检出率为51.4%;20 例食管良性病变中有2 例为不完全甲基化,检出率为10%;而10 例健康志愿者检出率为0。并且RUNX3 基因启动子甲基化与患者临床病理分期和淋巴结转移密切相关。可见,RUNX3 基因启动子甲基化在食管鳞癌患者中有较高的检出率,有望成为食管鳞癌早期诊断与预后监测的重要标记物[12]。
4 RUNX3 与胃癌
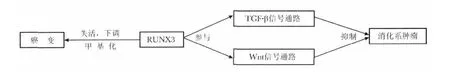
图1 RUNX3 对消化系肿瘤的主要调控机制Fig 1 Regulation mechanism of RUNX3 in digestive system carcinoma
RUNX3 最早是在胃癌的标本检测中发现的,其缺失或失活可导致胃肠黏膜上皮的过度增生和凋亡减少,以致胃黏膜上皮细胞增生和分化异常,导致癌变。去除了RUNX3 基因的小鼠胃黏膜上皮因RUNX3 蛋白的缺失使得胃黏膜上皮增殖过度旺盛而凋亡不足而呈增生状态,导致了胃黏膜的异常增生发展为胃癌,且在该研究中发现胃癌细胞系在裸鼠的致癌性与RUNX3 的表达水平呈负相关。应用免疫组化对不同病理分期不同分化程度的胃癌组织及正常黏膜组织中RUNX3 蛋白检测发现,胃癌中RUNX3 蛋白表达的阳性率显著低于正常胃黏膜细胞的阳性表达,同时还发现在分化程度差、浸润深度深、淋巴结转移的胃癌中的阳性表达率明显低于中高分化程度、浸润深度浅、无淋巴结转移的胃癌组织中的表达[13];幽门螺杆菌引发的原癌基因c-Src 的激活与RUNX3 基因表达的下调有关系,并且和RUNX3 酪氨酸磷酸化相关,RUNX3 表达缺失是幽门螺杆菌感染引发胃癌的病理机制的基础事件[14]。在检测的胃癌细胞系、胃癌组织及正常胃黏膜组织RUNX3 甲基化率中,70.0%(7/10)胃癌细胞系、45.2%(42/93)胃癌组织和7.5%(7/93)正常胃黏膜组织存在甲基化。可见由于RUNX3 甲基化后,RUNX3 表达下调或缺失引起TGF-β 信号传导通路紊乱,导致癌变,其中RUNX3 启动子区域CpG岛的甲基化是导致其在胃癌中失活的主要机制[15]。
5 RUNX3 与肝癌、胆管癌
应用MSP 技术同时对5 种肝癌细胞系以及52例肝细胞癌患者肿瘤组织及其癌旁组织RUNX3 基因启动子区域甲基化状态进行检测,结果发现在肝细胞癌组织中,RUNX3 基因启动子区域甲基化率占42.3%(22/52),而在相对应的正常结直肠组织中,RUNX3 基因启动子区域未发现高甲基化现象;在5种肝癌细胞系中,有3 种细胞RUNX3 基因启动子区域存在甲基化异常[16];对人胆道肿瘤细胞系Mz-ChA-2 传导RUNX3 的克隆实验中发现RUNX3 恢复并提高了TGF-β 依赖的G1 抑制[17]。用Northern免疫印迹和RT-PCR 技术分析显示:在70%的胆管癌细胞系中不存在RUNX3 基因的表达,而在正常胆管细胞中却可以检测到RUNX3 mRNA 的表达,进一步研究发现在这些癌细胞中存在RUNX3 基因启动子区域的高甲基化,在90%的胆管癌中存在RUNX3基因的等位缺失[18],说明RUNX3 基因参与了肝癌、胆管癌的发生、发展与演变过程,并有可能与两种病变的浸润与转移也有关系。
6 RUNX3 与胰腺癌
通过对12 个胰腺肿瘤细胞系行Northern blot和RT-PCR 分析,发现9 个(75%)都表现出RUNX3表达缺失。在RUNX3 表达缺失的肿瘤细胞系中检测出启动子CpG 岛的甲基化,且无RUNX3 mRNA的表达,提示RUNX3 失活在胰腺癌中,启动子区域甲基化是基因失活的重要机制[18]。
7 RUNX3 与结直肠腺瘤、结直肠癌
研究60 例结直肠癌、60 例结直肠腺瘤、30 例正常组织中RUNX3 蛋白的表达情况,结果显示RUNX3 蛋白在结直肠癌中表达阳性率,远低于在结直肠腺瘤及正常组织中的表达,且RUNX3 蛋白的表达与其病理特征密切相关[19]。采用RT-PCR 和MSP 技术检测了32 种结直肠癌细胞系和87 例癌组织中RUNX3 基因的突变、杂合性缺失和启动子甲基化状态,发现有16 种癌细胞系存在RUNX3 基因表达缺失或下调,其中75%(12/16)存在启动子的高甲基化,在87 例癌组织中有16 例(18.4%)检测到RUNX3 基因的甲基化,而在相应的正常组织均未发现RUNX3 基因的甲基化[20],说明启动子区域的高甲基化是导致RUNX3 基因在结直肠肿瘤细胞中表达下调的主要原因。并且有研究发现[21-22]对结肠癌细胞、肝癌细胞系给予去甲基化药物AzA(5-aza-2'-deoxycytidine)处理后,肿瘤细胞系RUNX3 基因因去甲基化而激活,重新转录mRNA,RUNX3 蛋白表达增加,重新调控细胞的增殖,抑制肿瘤细胞的生长,肿瘤凋亡率提高,这些研究结果在一定程度上支持了表观基因学的论点。
8 RUNX3 基因与其他消化系统肿瘤的研究
目前,RUNX3 基因在小肠癌、胃间质瘤、淋巴瘤等其他少见消化系肿瘤中的表达情况尚未在文献中报道。
9 问题与展望
值得肯定的是,RUNX3 基因能够与Smads 相互作用,进而调控TGF-β 信号通路介导的生长抑制作用,也可以与TCF4 和β-catenin 形成复合物,抑制Wnt 信号传导通路的致癌作用。但尚有许多问题还需进一步研究,例如在Wnt 信号传导通路中,RUNX3 如何与其他因子相互作用来抑制癌细胞的产生,去甲基化药物的使用是否可以使沉默的RUNX3 基因重新获得表达从而抑制肿瘤细胞的发展,随着遗传学、表观基因学及各种先进实验方法的不断发展和改善,必将有助于对RUNX3 基因的抑癌机制进行更深入的研究,从而为临床预防、诊疗恶性肿瘤提供更科学的依据。
[1]Huang B,Qu Z,Ong CW,et al.RUNX3 acts as a tumor suppressor in breast cancer by targeting estrogen receptor α[J].Oncogene,2012,31:527-534.
[2]Zhang Z,CHEN G,Cheng Y,et al.Prognostic significance of RUNX3 expression in human melanoma[J].Cancer,2011,117:2719-2727.
[3]Liu LC,Tsao TC,Hsu SR,et al.EGCG Inhitits transforming growth factor-β-mediated epithelial-to-mesenchymal transition via the inhibition of Smad2 and Erk1/2 signaling pathways in nonsmal cell lung cancer cells[J].J Agric Good Chem,2012,60:9863-9873.
[4]Calone I,Souchelnytskyi S.Inhibition of TGF-β signailing and its implications in anticancer treatments[J].Exp Oncol,2012,34:9-16.
[5]Takashima P.Hartenstein V.Genetic control of intestinal stem cell specification and development:a comparative view[J].Stem Cell Rev,2012,8:597-608.
[6]Soong R,Shah N,Peh BK,et al.The expression of RUNX3 in colorectal cancer is associated with disease stage and patient outcome[J].Br J Cancer,2009,100:676-679.
[7]Shio S,Kodama Y,Ida H,et al.Loss of RUNX3 expression by histone deacetylation is associated with biliary tract carcinogenesis[J].Cancer Sci,2011,102:776-783.
[8]Nakanishi Y,Shiraha H,Nishina S,et al.Loss of runt-related transcription factor expression leads hepatocellular carcinoma cells to escape apoptosis[J].BMC Cancer,2011,11:3-10.
[9]曲琦,黄洪晖.经典Wnt 信号通路在恶性淋巴瘤中的研究进展[J].肿瘤,2012,32:940-944.
[10]Peng ZH,Wei DY,Wang LW,et al.RUNX3 inhibits the expression of vascular endothelial growth factor and reduces the angiogenesis,growth,and metastasis of human gastric cancer[J].Clin Cancer Res, 2006,12:6386-6394.
[11]Tonomoto Y,Tachibana M,Dhar DK,et al.Differential expression of RUNX genes in human esophageal squamous cell carcinoma:downregulation of RUNX3 worsens patient progonisis[J].Oncology,2007,73:346-351.
[12]郑芸,张有为,陈有邦.食管鳞癌患者血清RUNX3 基因甲基化检测及临床意义[J].癌症进展,2010,8:290-294.
[13]朱兴国,孟翔凌,王成宏,等.P16 蛋白、RUNX3 蛋白在胃癌组织中的表达及其临床意义[J].安徽医科大学学报,2010,45:93-97.
[14]Cinghu S,Goh YM,Oh BC,et al.Phosphorylation of the gastric tumor suppressor RUNX3 following H.pylori infection results in its localization to the cytoplasm[J].J Cell physiol,2012,227:1071-1080.
[15]Imarnura Y,Hibi K,Koike M,et al.RUNX3 promoter region is specifically methylated in poorly-differentiated colorectal cancer[J].Anticancer Res,2005,25:2627-2630.
[16]张海元,刘娟,解庭波,等.肝细胞癌中RUNX3 基因启动子区甲基化研究[J].华中科技大学学报:医学版,2009,38:23-26.
[17]Hasegawa K,Yazumi S,Wada M,et al.Restoration of RUNX3 enhances transforming growth factor-β-dependent p21 expression in a biliar-y tract cancer cell line[J].Cancer Sci,2007,98:838-843.
[18]Wada M,Yazumi S,Takaishi S,et al.Frequent loss of RUNX3 gene expression in human bile duct and panereatic cancer cell lines[J].Oncogene,2004,23:2401-2407.
[19]贾光辉,薛军,武雪亮.RUNX3、Survivin 在结直肠腺癌、腺瘤、正常黏膜中表达的临床意义[J].安徽医科大学学报,2013,48:1228-1231.
[20]Sugiura H,lshiguro H,Kuwabara Y,et al.Deereased expression of RUNX3 is eorrelated with tumor progression and poor prognosis in patients with esophageal squamous cell carcinoma[J].Oncol Rep,2008,19:713-719.
[21]Deng T,Zhang Y.5-Aza-2'-deoxyeytidine reactivates expression of RUNX3 by deletion of DNA methyltransferases leading to caspase independent apoptosis in colorectal cancer Lovo cells[J].Biomed Pharmacother,2009,63:492-500.
[22]张雪妍,蒲春霞,张煦.5-氮杂-2-脱氧胞苷诱导肝癌细胞HepG2 RUNX3 基因表达及增强药物敏感性[J].基础医学与临床,2012,30:421-423.

