改良的人乳腺癌细胞三维培养模型及药敏性考察
殷润婷,张伟,奚涛
(1.南通大学医学院药理系,江苏 南通226001;2.中国药科大学生命科学与技术学院,江苏 南京210009)
·药学研究· PHARMACEUTICAL RESEARCH
改良的人乳腺癌细胞三维培养模型及药敏性考察
殷润婷1,2,张伟1*,奚涛2**
(1.南通大学医学院药理系,江苏 南通226001;2.中国药科大学生命科学与技术学院,江苏 南京210009)

目的:建立适用于高通量药物筛选的人乳腺癌MCF-7细胞三维培养模型,考察其药敏性。方法:在传统的liquidoverlay法和直接混合法基础上,建立新型锚定法,制备MCF-7细胞的三维培养系统;以二维培养和直接混合法制备的三维培养系统作对照,通过倒置显微镜观察其中细胞形态学特征,绘制细胞生长曲线,使用顺铂并采用MTT法进行药敏试验。结果:采用新型锚定法成功制备MCF-7细胞的三维培养系统,不同于二维培养系统,其中MCF-7细胞形成典型的直径为160μm 左右的葡萄样多细胞球;与直接混合法制备的三维培养系统相比,其中MCF-7细胞生长速度明显更快(P<0.05);与二维培养系统相比,其中MCF-7细胞对顺铂的敏感性显著降低,即顺铂对MCF-7细胞的增殖抑制率明显降低(P<0.01)。结论:该新型锚定法制备的乳腺癌细胞三维培养系统更接近体内肿瘤生长环境,其中肿瘤细胞能模拟体内实体瘤的耐药特征,故其更适用于抗癌药物的活性筛选。
人乳腺癌细胞;三维培养;锚定法;药敏性
乳腺癌是女性发病率居首位的恶性肿瘤,在我国,女性乳腺癌发病率和死亡率也呈逐年递增之势,严重威胁着妇女的健康,且由于癌细胞在治疗过程中易产生耐药性,导致乳腺癌预后较差[1]。于是,药物研究者一直在致力于研发能克服肿瘤耐药并预防肿瘤转移和复发的更为有效的抗乳腺癌药物。抗肿瘤药物的研发往往需要投入大量的经费和资源,据美国国立卫生研究院(NIH)统计,2000年在美国成功开发一个新药需要投入约8.02亿美元[2]。可是,有许多候选药物由于在动物或人体体内试验中所表现出的药效远不及体外模型实验,导致在研发中途夭折,造成大量人力和物力的浪费。因此,亟待开发能很好模拟人体体内环境且简便、重复性好的体外模型,用于抗癌药物的研究与开发。
二维(2D)单层细胞培养是常用的体外模型,但其并不能模拟出肿瘤细胞在体内所处的三维(3D)环境,且易导致细胞失去体内环境下所具有的特征[3]。为了改进2D培养方法,研究人员对单层培养细胞进行多层覆盖,但这种“三明治”式的培养方法与体内的3D环境还是存在很大差距,如体内肿瘤细胞所呈现的多细胞球体(MCS)形态能相互联系、氧气的组织渗透受限导致缺氧环境以及肿瘤易于产生耐药性,而这些都是多层细胞培养方式无法模拟的。所以,需要开发一种更接近实体瘤3D结构的培养方式即3D细胞培养系统,作为药物研究的平台[4]。采用不同的3D支架进行细胞培养,形成的MCS能模拟体内实体瘤的生长环境,如养分和气体浓度在培养物中呈梯度变化,而存在的缺氧环境能诱导细胞分化,并刺激其增殖[3-5]。且3D培养的肿瘤细胞能模拟体内实体瘤的耐药特征。本文基于Liquidoverlay法及直接混合法建立改良的新型锚定法,制备人乳腺癌细胞MCF-7的3D培养系统,考察其中细胞的形态学和生长曲线,并对其药敏性进行初步研究,为抗癌药物活性筛选平台的建立提供实验依据。
1 材料
SPF级SD大鼠,由中国科学院上海实验动物中心上海斯莱克实验动物有限公司提供,动物合格证号:SCXK(沪)2007-0005;人乳腺癌MCF-7细胞株,由ATCC细胞库提供,本实验室保藏。胰蛋白酶(上海生工公司);DMEM 高糖型培养基,胎牛血清(FCS),均为美国Gibico公司产品;噻唑兰(MTT),Ⅰ型胶原酶,均为美国Sigma公司产品;顺铂(DDP),由东南大学药物研究中心提供。96孔培养板(美国BD公司);倒置显微镜(德国Leica公司)。
2 方法
2.1 胶原溶液的制备
参照文献[6],将体质量为200~250g的SD大鼠尾部剪下,浸入70mL·L-1乙醇溶液中,20min后,在无菌条件下抽出尾腱,并将其剪碎,置入0.5mL·L-1醋酸溶液中(每条鼠尾腱所用溶液约150mL),在4℃条件下不时搅拌,48h后,10000r·min-1离心1.5h,上清液用100g·L-1氯化钠溶液盐析,最后将沉淀的胶原蛋白溶于4℃的1mmoL·L-1盐酸溶液中,即得胶原溶液。采用Lowry法测得该胶原溶液质量浓度为5g·L-1,此可溶性鼠尾腱胶原的主要成分为Ⅰ型胶原。
2.2 三维细胞培养系统的制备
用1.25g·L-1胰蛋白酶溶液消化指数生长期的MCF-7细胞,并调整细胞浓度为2×105·L-1,制得细胞悬液。4℃条件下,按体积比1∶1∶5∶2∶1,将10倍常规浓度的磷酸缓冲液(PBS)、FCS、2倍常规浓度的DMEM培养液、胶原溶液和双蒸水快速混匀,再滴加氢氧化钠溶液调pH为7,制成胶原培养液。采用对liquidoverlay法[7]及直接混合法进行改良后而建立的新型锚定法制备3D细胞培养系统:将胶原培养液移入96孔培养板内,每孔50μL,于室温放置15min,使之形成半凝固的锚定层,然后将胶原培养液和细胞悬液按体积比1∶1混合,加入有锚定层的孔中,室温孵育15min,再于37℃培养箱内孵育30min,使之完全凝固,得到细胞培养层,最后每孔加入100μL含10%FCS的DMEM完全培养基,形成覆盖层,隔天换液1次,即可。参照文献[8],采用直接混合法制备3D细胞培养系统:将胶原培养液和细胞悬液按体积比1∶1混合,置37℃培养箱内孵育30min,待凝固后,每孔加入100μL含10%FCS的DMEM 完全培养基覆盖,隔天换液1次,即可。
2.3 考察指标
在3D细胞培养系统建成后的0、2、4、6、8d时,分别考察如下指标:①细胞形态学,在倒置显微镜下观察胶原凝胶块中MCF-7细胞形态学的改变;②细胞生长曲线,将各时间点的胶原凝胶块用4g·L-1Ⅰ型胶原酶溶液消化,制成细胞悬液,并置于血球计数板上,在倒置显微镜下进行细胞计数,各培养系统于每个时间点设置5个复孔进行细胞计数,试验独立重复3次,绘制细胞生长曲线。同时,各指标均以2D细胞培养系统作对照。
2.4 药敏试验
在各细胞培养系统中,当细胞进入对数生长期后,加入系列浓度的DDP,72h后,采用MTT法进行检测:将5g·L-1MTT溶液加入DDP处理后的孔板中,置37℃培养箱中孵育4h,用酶标仪在490nm处测定其吸收值(OD值),计算细胞增殖抑制率(PI),各培养系统的每个浓度药物组设置5个复孔进行测定,试验独立重复3次,绘制PI曲线。PI=[1-(ODtest/ODcontrol)] ×100%,其中,ODtest和ODcontrol分别为给药组和未给药的阴性对照组OD值。
2.5 统计学分析
试验所测数据均以珋x±s表示,采用独立样本t检验。
3 结果
3.1 各培养系统中细胞形态学比较
倒置显微镜下观察显示,两种3D培养系统中细胞在形态学上无差异,只是细胞数量上有差异,其中新型锚定法制备的3D培养系统中细胞在生长过程中相互聚集并迅速增殖,形成细胞数目不等的葡萄样多细胞聚集体,即MCS,符合MCF-7细胞经3D培养后的典型生长特征[9],其间,MCS体积逐渐增大,其中细胞数目逐渐增多,于培养第6d时,大多数MCS直径达到160μm左右;而2D培养系统中的细胞呈典型的多边形扁平样形态(见图1)。

图1 倒置显微镜下3D和2D培养系统中MCF-7细胞形态学特征(×400)Figure 1 Morphological charateristics of MCF-7 cells in 2D and 3D culture systems under inverted microscope
3.2 各培养系统中细胞生长曲线比较
细胞生长曲线显示,到第8d时,与直接混合法制备的3D培养系统相比,新型锚定法制备的3D培养系统和2D培养系统中细胞计数明显更多(P<0.05和P<0.01),细胞增殖速率显著加快(见图2)。表明,与直接混合法相比,新型锚定法制备的3D培养系统更适合细胞生长。
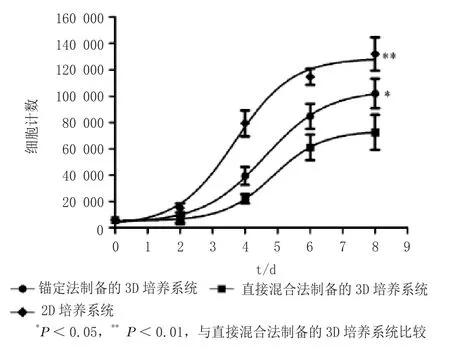
图2 各培养系统中MCF-7细胞生长曲线Figure 2 Growth curves of MCF-7 cells in different culture systems
3.3 各培养系统中细胞药敏性差异
MTT实验显示,与2D培养系统相比,新型锚定法制备的3D培养系统中细胞对各浓度DDP的敏感性均显著降低,尤其对高浓度DDP(P<0.01);且DDP对3D和2D培养系统中细胞的PI值均随浓度增大而明显提高,即各培养系统中细胞对DDP的敏感性具浓度依赖性(见图3)。
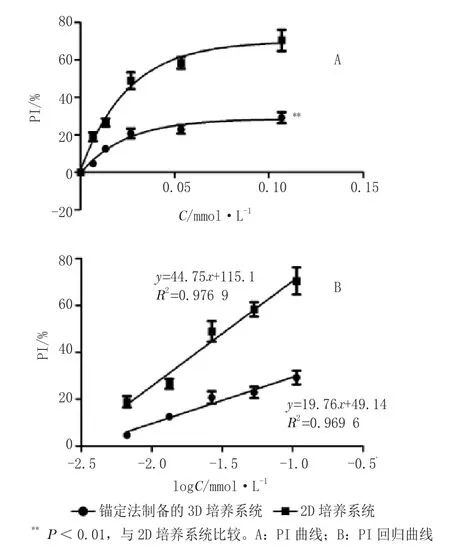
图3 DDP对各培养系统中MCF-7细胞的PI曲线和回归曲线Figure 3 PI curves and regression curves of MCF-7 cells in different culture by DDP
4 讨论
细胞的体外3D培养系统弥补了2D培养系统难以模拟的细胞间以及细胞与基质间的相互作用,能更真实地模拟体内肿瘤瘤体的结构形态及细胞分化功能,使其对药物治疗的反应更接近体内的真实情况[10-11],目前已成为肿瘤研究以及药物开发的有力工具,尤其在体内肿瘤耐药性研究方面显示出独特优势[12]。此外,体外3D细胞培养模型可控性较好,与体内模型相比,能节省试验成本,且其试验结果的平行性和重现性较好,因此在抗癌药物药效评价方法研究方面具有巨大的应用潜力。
3D培养支架材料的选择是成功进行细胞3D培养的关键步骤之一。第1代的3D培养系统运用了人工合成的生物高分子微纤维支架,材料包括聚乳酸羟基乙酸-壳多糖等,但这些材料的降解产物对细胞的生长与代谢都有不同程度的影响,从而影响试验结果的真实性。目前,用于3D培养支架的新型人工合成材料仍在研发中。于是,人们考虑到使用更接近体内细胞外基质(ECM)的材料,如ECM的主要成分胶原蛋白作为细胞培养支架,尤其是商业化的基质胶产品Matrigel和鼠尾Ⅰ型胶原的应用最为广泛[13]。抗肿瘤药物的研发往往需要进行高通量筛选,而Matrigel价格昂贵,所以经济且制备简单的Ⅰ型胶原成为目前3D培养支架的首选材料。Ⅰ型胶原蛋白溶液可使用醋酸或稀盐酸溶液来制备,但研究发现,用醋酸溶液制备的胶原溶液在中和过程中会产生醋酸钠盐,而该盐对细胞增殖有很大影响[14],因此,本文采用稀盐酸制备胶原蛋白溶液。
常见的胶原3D细胞培养系统制备方法大多是采用直接混合法,即将胶原培养液与细胞悬液直接混合而形成细胞培养凝胶,可是细胞在胶原凝固过程中会产生自然沉降,从而影响其在胶原中的均匀分布;而且,长时间的孵育会使胶原在细胞培养过程中发生脱水收缩,甚至会从培养支持物上脱离,对细胞产生机械应力,影响细胞生长[15]。此外,Raub等[16]在对胶原蛋白凝固条件进行研究时发现,胶原蛋白凝胶溶液的pH值、孵育温度及盐离子浓度均会对胶原蛋白单体聚合成胶原纤维产生很大影响。而Sung等[17]则发现,在胶原凝胶凝固过程中,进行低温预处理,可使胶原纤维排列更加有序,且形成的纤维更厚,有利于细胞生长。基于以上研究结果,本文通过优化的胶原凝胶化条件,并对liquidoverlay法和直接混合法进行改良,建立了制备胶原3D细胞培养系统的方法— —新型锚定法。MCF-7细胞生长曲线的测定结果表明,与直接混合法相比,该方法制备胶原3D培养系统能够降低细胞在凝胶中沉降而带来的影响,更适合细胞的生长,可提高细胞的生长密度,形成的MCS也比较均一。况且,与liquidoverlay法相比,该方法省略了细胞聚集步骤,更加简便,适用于抗癌药物的高通量筛选。
已有研究表明,3D培养的肿瘤细胞株所具有的耐药特征与体内实体瘤相近,均表现为对多种化疗药物不敏感,但当3D培养的肿瘤细胞被消化分散后,其对药物的敏感性明显提高。如,Graham等[18]研究发现,3D培养的小鼠乳腺癌细胞EMT6具有耐药性,而经2D培养后其耐药性完全消失。本试验选择人乳腺癌细胞MCF-7进行研究,采用MTT法检测2D及3D培养MCF-7细胞的药物敏感性。以往人们在考察3D培养的细胞生长情况时采用的染色细胞计数方法大多存在操作繁琐、耗时长、操作过程中易造成细胞死亡、且平行孔之间实验结果的误差较大等弊端,目前在利用3D培养细胞进行的药物高通量筛选实验中常用直接染色法进行细胞计数,如CCK-8和Amarblue染色法[5]等。笔者在预实验中发现,MTT能很好地扩散进凝胶,复孔间平行性较好,且在药敏试验中阴性对照检测的OD值在0.8左右,也说明细胞染色情况较好;此外,PI值是对比阴性对照组而得到的计算结果,MTT渗透率的影响可相互抵消。因此,本文在药敏试验中,尝试采用更为经济和简便的MTT法进行细胞计数;而且,在之前检测细胞生长曲线时发现更换培养基可促进肿瘤细胞的增殖,但在MTT实验中为了减少操作误差,没有更换培养基,可是2D细胞培养孔在不更换培养基的情况下,其细胞培养只能维持72h,超过72h则会由于培养基养分耗竭、细胞代谢产物增加等因素导致细胞死亡,造成实验误差,而在培养24和48h时,由细胞生长曲线可知3D培养细胞还未进入指数生长期,细胞数量变化小,此时OD值并不能真实反映药物的作用效果,于是选择在加入DDP后培养72h时检测细胞对DDP的敏感性。药敏试验结果表明,与2D培养系统相比,MCF-7细胞在3D培养条件下对DDP的敏感性显著降低。这是由于,与2D培养系统相比,在3D培养系统中,胶原蛋白凝胶能模拟体内ECM环境,降低药物扩散速度,而形成的多细胞球可增强细胞间相互作用,且该系统能模拟实体瘤独特的微环境,如高渗缺氧等,从而致使其中细胞表现出对DDP的耐药性。这与乳腺癌的临床上显示的耐药特征较为接近,表明本文所建立的体外3D细胞培养模型用于模拟体内乳腺癌是成功的,可用于抗肿瘤药物活性的评价。不过,本文中发现的3D培养系统中乳腺癌细胞对DDP产生明显耐药性的相关机制尚有待进一步研究。
[参 考 文 献]
[1]Gonzalez-Angulo A, Morales-Vasquez F, Hortobagyi G. Overview of resistance to systemic therapy in patients with breast cancer[M]// Yu D, Hung M C. Breast cancer chemosensitivity. New York:Springer, 2007:1-22.
[2]DiMasi J A, Hansen RW, Grabowski H G. The price of innovation:new estimates of drug development costs[J].J Health Econ, 2003, 22(2):151-185.
[3]Hirschhaeuser F, Menne H, Dittfeld C, et al.Multicellulartumor spheroids:an underestimated tool is catching up again[J].J Biotechnol, 2010, 148(1):3-15.
[4]Shin C S, Kwak B, Han B, et al.Development of an in vitro 3D tumor model to study therapeutic efficiency of an anticancer drug[J].Mol Pharm, 2013, 10(6):2167-2175.
[5]Yip D, Cho C H. A multicellular 3D heterospheroid model of liver tumor and stromal cells in collagen gel for anticancer drug testing[J]. Biochem Biophys Res Commun, 2013, 433(3):327-332.
[6]Rajan N, Habermehl J, CotéM F, et al. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications[J]. Nat Protoc, 2007, 1(6):2753-2758.
[7]Kunz-Schughart L A, Heyder P, Schroeder J, et al.A heterologous 3-D coculture model of breast tumor cells and fibroblasts to study tumorassociated fibroblast differentiation[J]. Exp Cell Res, 2001, 266(1):74-86.
[8]潘勇, 艾玉峰, 张琳西, 等.兔血管平滑肌细胞三维培养模型的建立[J].第四军医大学学报, 2001, 22(4):309-312.
[9]Becker J L, Blanchard D K.Characterization of primary breast carcinomas grown in three-dimensional cultures[J]. J Surg Res,2007, 142(2):256-262.
[10]Yamada K M, Cukierman E.Modeling tissue morphogenesis and cancer in 3D[J]. Cell, 2007, 130(4):601-610.
[11]Owen S C, Shoichet M S.Design of three-dimensional biomimetic scaffolds[J]. J Biomed Mater Res A, 2010, 94(4):1321-1331.
[12]Friedrich J, Seidel C, Ebner R, et al. Spheroid-based drug screen:considerations and practical approach[J]. Nat Protoc, 2009, 4(3):309-324.
[13]Alavi A, Stupack D G. Cell survival in a three-dimensional matrix[M]// David A C. Methods in enzymology.Salt Lake City: Academic Press, 2007:85-101.
[14]Mio T, Adachi Y, Romberger D J, et al.Regulation of fibroblast proliferation in three-dimensional collagen gelmatrix[J]. In Vitro Cell Dev Biol Anim, 1996, 32(7):427-433.
[15]Rhee S, Grinnell F. Fibroblast mechanics in 3D collagen matrices[J]. Adv Drug Del Rev, 2007, 59(13):1299-1305.
[16]Raub C B, Suresh V, Krasieva T, et al. Noninvasive assessment of collagen gel microstructure and mechanics using multiphoton microscopy[J]. Biophys J, 2007, 92(6):2212-2222.
[17]Sung K E, Su G, Pehlke C, et al. Control of 3-dimensional collagen matrix polymerization for reproducible human mammary fibroblast cell culture in microfluidic devices[J]. Biomaterials, 2009, 30(27):4833-4841.
[18]Graham C H, Kobayashi H, Stankiewicz K S, et al. Rapid acquisition of multicellular drug resistance after a single exposure of mammary tumor cells to antitumor alkylating agents[J]. J Natl Cancer Inst, 1994, 86(13):975-982.
YIN Runting1,2, ZHANG Wei1, XI Tao2
(1.Department of Pharmacology, School of Medicine, Nantong University, Nantong 226001, China; 2.School of Life Science and Technology, China Pharmaceutical University, Nanjing 210009, China)
Objective:To establish a three-dimensional (3D) culture model of human breast cancer cell line MCF-7 for high throughout screening of anticancer agents and to investigate its drug sensitivity. Methods:Based on the conventional liquid overlay method and mixing method, the improved anchor method was established for the preparation of a new 3D culture system of MCF-7 cell line. Using a 2D culture system and a 3D culture system prepared by mixing method as control, the morphological characteristics of MCF-7 cells in the new 3D culture system were observed under inverted microscope, the cell growth curve was plotted and the drug sensitivity test was conducted with DDP by MTT method. Results:The new 3D culture system of MCF-7 cell line was successfully established by the improved anchor method. The typical grape-like multicellular spheroids (~160μm) were observed in the new 3D system rather than in the 2D culture system. The cell growth rate in the new 3D culture system was significantly faster than that in the conventional 3D culture system prepared by mixing method (P<0.05). The cell proliferation inhibition ratio by DDP in the new 3D system was significantly lowered compared with that in the 2D culture system (P<0.01). Conclusion:The new 3D cell culture system of human breast cancer prepared by the improved anchor method is close to in vivo tumor growth environment, in which the tumor cells could mimic the drug-resistant characteristics of in vivo solid tumor. Therefore the new 3D cell culture system is more practicable for the activity screening of anticancer candidates than the conventional ones.
human breast cancer cell; three dimensional culture; anchor method; drug sensitivity
R73-351
A
1001-5094(2014)01-0046-05
接受日期:2013-04-13
项目资助:江苏省自然科学青年基金项目(No.BK20130395);*
张伟,教授;
研究方向:心血管、肿瘤及神经药理学;
Tel:0513-85051728;E-mail:zhang_wei605@163.com
奚涛,教授;
研究方向:肿瘤药理学;
Tel:025-83271022;E-mail:xi_tao18@163.com
An Improved Three-dimensional Cell Culture Model of Human Breast Cancer as Well as Drug Sensitivity Investigation

