聚焦多发性骨髓瘤
汤森路透
·全球药讯· GLOBAL PHARMACEUTICAL INFORMATION
聚焦多发性骨髓瘤
汤森路透

编者按:随着信息化时代乃至“大数据”时代的悄然来临,数据信息对于制药行业的重要性已愈发凸显。世界领先专业智能信息提供商汤森路透面向全球制药行业提供了智能信息解决方案,包括新药发现与研发、仿制药/原料药选项与立项、市场准入、专利预警、竞争对手监测及药品销售等制药企业在生产经营的各个阶段所需的各种信息。
为了及时跟踪全球药学领域发展动态,畅通信息传递渠道,《药学进展》与汤森路透公司签署了翻译转载版权备忘录,每期将独家刊载汤森路透享有著作权的医药信息。文章信息来源之一汤森路透CortellisTM竞争情报(Thomson Reuters CortellisTMfor Competitive Intelligence)是一种直观的情报工具,可以访问药物研发管线、交易、专利、公司内容及行业最近新闻的庞大数据库资源。借助这一资源,便可绘制所关注适应证、作用机制及公司竞争格局的全貌,为药物研发一线人员提供所需的精确信息,从而加快决策制定。本期刊登“焦点”中的“聚焦多发性骨髓瘤”。
虽然免疫抑制剂和蛋白酶体抑制剂的应用使多发性骨髓瘤治疗领域在过去10年取得了显著进展,但该疾病仍是预后差且5年存活率最低的癌症之一。多发性骨髓瘤目前仍不可治愈,甚至连有效地维持缓解都极为困难。复杂的临床表现、多样的治疗选择以及长期、大规模比较研究数据的缺乏导致这一疾病的治疗变得更加复杂。新一代治疗药物在疗效和耐受性方面均有显著提高,并且已通过加快审批通道进入市场,用于曾接受过多次既往治疗的患者,治疗复发性/难治性多发性骨髓瘤,但目前还未获得其完整的存活率数据。在基因组学领域,已开始对患者进行更加个体化的预后和治疗,然而这一领域还仅仅处于起步阶段。随着多发性骨髓瘤发生机制的进一步阐明以及竞争前研究合作的进一步加强,希望能够在这一治疗需求远远未被满足的领域快速研发出新一代靶向治疗药物。
多发性骨髓瘤;沙利度胺;来那度胺;硼替佐米;一线治疗
第一部分:新药研发
1 背景介绍
多发性骨髓瘤是全世界发病率排名第2的血液肿瘤。预计美国在2013年会出现约2.2万新病例和超过1万例死亡,这一发病率与欧洲基本相等。由于衰老(>65岁)是多发性骨髓瘤的风险因素之一,预计该疾病的发病率会随着寿命的延长而上升。
多发性骨髓瘤由骨髓内多个位点的浆细胞克隆性增殖引起,最终导致骨髓衰竭和骨破坏。该疾病的特征为骨损伤和(或)骨质疏松,在80%的新确诊患者中能观察到这些症状,并且还伴有骨破坏引起的血钙水平升高。不断积累的恶性细胞取代了骨髓中的正常功能性浆细胞,导致贫血、白细胞减少症和血小板减少症。骨髓瘤细胞分泌大量缺乏免疫功能的完整的单克隆免疫球蛋白(M蛋白)或其片段。M蛋白可在多个器官中积累,而在肾脏中的堆积对于机体最为不利,会在约40%的患者中引起肾衰竭。
根据是否存在症状和疾病进展快慢,多发性骨髓瘤可大致分为3种亚型。其中,隐匿性无症状多发性骨髓瘤约占确诊病例的15%~20%,其特征在于血清M蛋白水平大于30 g·L-1和(或)骨髓浆细胞大于或等于10%,并且不存在诸如贫血、肾衰竭、高钙血症和骨损伤的症状。无痛性无症状多发性骨髓瘤的特点也包括无明显症状,且血清或尿M蛋白值稳定,但是存在骨髓浆细胞增多和轻度贫血或少量的溶骨性损伤。最后一类是症状性多发性骨髓瘤,其特征为血清或尿中存在M蛋白,骨浆细胞增多超过30%并且存在贫血、肾衰竭、高钙血症和(或)溶骨性骨损伤。基于β2-微球蛋白和白蛋白的血清水平,国际分期系统将患有活动性、症状性多发性骨髓瘤的患者分为低、中和高危3期。
在过去,多发性骨髓瘤的中位生存期仅有7个月。随着化疗药物(例如20世纪60年代的美法仑以及之后的高剂量化疗)和自体干细胞移植的出现,更新的治疗手段使患者的中位生存期延长至2~3年。虽然这对于患者而言是毋庸置疑的进步,但很遗憾该疾病的5年存活率在过去30年仅提高了9%,即从1975年的25%提高至2003年的34%。过去10年在治疗方面所获得的显著进步再次延长了患者的生存期,例如免疫调节剂沙利度胺(商品名:Thalomid)和来那度胺(商品名:Revlimid)以及蛋白酶体抑制剂硼替佐米(商品名:万珂)的上市进一步延长了患者的中位生存期,目前已达到7~8年。这3种药物从实验室到临床的研究开发都非常迅速,是转化型癌症研究的最好例证。特别是万珂,该药是癌症治疗领域中研发和审批最快的药物之一,它从第一例人体研究到获得美国FDA批准只用了4年半的时间。尽管在治疗中已取得了这些有价值的进步,但多发性骨髓瘤仍然是5年存活率最低的癌症之一,该数值仅为38%。
2 一线治疗
2.1 符合移植条件的患者:治疗决策和商业契机
对于症状性多发性骨髓瘤而言,可将患者分为2类:符合移植条件的患者和不符合移植条件的患者。符合移植条件的患者一般年龄低于65岁并且没有并发症。在新诊断的符合移植条件的患者中,高剂量化疗后进行自体干细胞移植是目前的标准治疗方案。该治疗过程的若干阶段都需要进行药物治疗学研究,特别是在诱导和维持治疗期。过去,使用长春新碱、多柔比星和地塞米松进行诱导化疗被认为是标准治疗,但是这一组合很快就被更有效的治疗方案取代,即万珂、来那度胺或沙利度胺与地塞米松合并用药,并且已在这些新药的使用中观察到更好的治疗效果。万珂、来那度胺或沙利度胺目前还未获得批准用于维持治疗。
进行移植后,肿瘤科医师就必须决定是采取保守的“观望”治疗策略直到疾病复发,还是对患者进行进一步的治疗以维持移植的疗效。目前,绝大多数患者都会复发,因此也建议进行维持治疗以延长疗效和生存期。目前最大的问题是如何在不显著降低生活质量的前提下达到疗效。
传统的维持治疗药物包括皮质类固醇强的松和地塞米松,但由于长期用药与较高的死亡率相关并且缺乏对总生存期有利的数据,因此这些药物的使用一直存在争议。虽然已在一些研究中证明沙利度胺能够延长无进展生存期,但是其对总生存期的影响还不能确定,并且该药物还具有明显的毒性,例如外周神经病、便秘和嗜睡。
虽然与沙利度胺的化学结构相似,但来那度胺耐受性更好,这将是其用于维持治疗的一大优势。IFM-2005-02和CALBG100104研究均支持将来那度胺用于维持治疗,这2项研究分别证明了来那度胺可延长无进展生存期和至疾病进展时间。尽管不存在类似沙利度胺的神经毒性,来那度胺也具有一些明显的毒性,例如中性白细胞减少症、血栓栓塞以及增加罹患第2种原发性恶性肿瘤的风险,这些都会使治疗时间受到限制。
万珂也有可能用于移植后维持治疗,尽管与口服药物沙利度胺和来那度胺相比,万珂的静脉给药增加了该治疗的不利因素。对目前获得批准的用途(不包括维持治疗)而言,万珂皮下给药已获得批准,这为患者带来了更大的便利并且显著降低了外周神经病变的发生率。虽然皮下给药在患者便利性方面是一大进步,但是仍然需要医护人员将该药物复溶后给药,因此与口服药物相比仍然处于劣势。在维持治疗中极有可能需要长期给药,因此给药便利性是患者依从性的关键因素。
移植后的维持治疗往往需要持续数年,其中蕴藏巨大的商机。但是金融分析人士对这一市场份额所代表的机遇到底有多大存有争议。据估计,由于治疗花费和医保方面的问题以及医生对其他治疗方法的倾斜,仅有25%符合条件的患者会进行移植。更新、更有效的药物组合也导致自体干细胞移植的使用率整体降低。这些新药物组合的使用也使移植作为符合移植条件的患者的标准治疗方案受到质疑。由于毒性方面的原因,用于缓释给药的微丸胶囊也难以在移植后的维持治疗中有用武之地。
2.2 不符合移植条件的患者:一线治疗选择的复杂性
至少70%新诊断的多发性骨髓瘤患者由于高龄或健康问题不符合移植条件,因此,这种条件下使用的一线药物是多发性骨髓瘤治疗领域的最大商机。除了更大的潜在患者群,治疗时间远远长于移植前和复发期治疗。但是由于存在以多种组合使用的多种药物并且缺乏随机头对头试验的Ⅲ期数据,难以选出最佳的一线治疗方案。
治疗方案的选择通常取决于药物的可获得性以及医生的治疗偏好。在更新的药物上市之前,美法仑和强的松联合用药是被广泛认可的黄金治疗标准。之后将沙利度胺、来那度胺或万珂加入这一组合观察到了更好的疗效,所以这些药物也被列入一线药物的行列。沙利度胺和万珂分别于2006年和2008年首次作为一线药物获得批准,但是来那度胺作为一线药物的使用目前还未获得任何国家的批准。
2.3 不符合移植条件下使用的一线药物的市场动态
尽管将沙利度胺加入化疗治疗方案改变了对不符合移植条件的患者的治疗模式,但是GIMEMA和NMSG研究小组的研究显示该药物在延长总生存期方面难以得到一致性结果。此外,沙利度胺还具有一些明显的毒性,例如导致外周神经病变和静脉血栓栓塞。在VISTA和MM-015研究分别为万珂和来那度胺作为一线药物提供有利的数据支持之后,沙利度胺在美国的使用逐渐减少。事实上,尽管来那度胺在这一患者群中的使用目前仍属于药品说明书之外的用法,但其在不符合移植条件的患者所使用的一线药物中已经超过了沙利度胺。由于具有更好的耐受性,那些需要更温和的治疗方案的患者倾向于选择来那度胺,例如同时有神经病变的患者或高龄患者。
如果组间头对头ECOG E1A06试验能够得到有利的数据,预计来那度胺将进一步取代沙利度胺。该试验预计于2014年10月完成,其实验数据在人们的热切期盼之中。Celgene公司也正在进行旨在比较来那度胺和沙利度胺治疗方案的头对头FIRST试验,如果成功的话,其结果可能会进一步加强来那度胺在一线治疗药物中的主导地位。预计2015年8月能够获得主要研究数据。
但是沙利度胺在欧洲仍然是具有竞争力的药物,因为欧洲一些国家的患者还无法通过临床试验之外的途径获得来那度胺或万珂。而来那度胺更为昂贵的价格也会限制其在医保报销驱动的欧洲市场上作为一线药物使用。另外,MM-015试验数据不能证明来那度胺与美法仑-强的松组合相比能够显著延长总生存期,这也会阻碍来那度胺进入医保范畴。Celgene公司此前已在欧洲提交了来那度胺用于新确诊患者的申请,但是人用药委员会要求其提供更完整的数据验证该药物的益处与风险,之后 Celgene于2012年6月撤回了申请。该公司计划在2013年年底再次提交申请。大约有10%的多发性骨髓瘤患者不能耐受来那度胺和万珂,他们还会继续使用沙利度胺。来那度胺只有被证明在延长总生存期方面存在明确优势才能作为一线药物进入欧洲市场。
伴有肾功能损害、深静脉血栓风险以及疾病进展迅速或者具有细胞遗传学风险因素的患者倾向使用包括万珂在内的治疗方案。尽管目前仍然缺乏随机头对头研究的数据,但对多项研究的汇总分析表明万珂-美法仑-强的松组合与沙利度胺-美法仑-强的松组合相比具有更高的总缓解率和完全缓解率。经包括万珂的方案治疗后复发的患者在挽救治疗中仍然能够从包括万珂的治疗方案中获益,这一发现进一步为万珂作为一线药物使用提供了依据。沙利度胺、来那度胺和万珂在过去和未来几年的销售趋势见图1。

图1 沙利度胺、来那度胺和万珂的销量Figure 1 Thalomid,Revlimid and Velcade sales
3 挽救治疗
3.1 挽救治疗用药竞争愈演愈烈
在多发性骨髓瘤用药的研发领域中,与复发性/难治性多发性骨髓瘤相关的药物研究最为活跃。美国分别在2012年7月和2013年2月批准了Kyprolis(carfilzomib)和Pomalyst(pomalidomide),这2种新药以前所未有的速度接连获得批准恰恰证明了这一点。多发性骨髓瘤研究基金会称:“Kyprolis和Pomalyst在7个月的时间内通过加速审批在癌症治疗领域是前所未有的”。除了远未满足的临床需求之外,复发性/难治性多发性骨髓瘤的治疗也存在巨大商机,一方面是因为缺乏治愈性药物,另一方面是由于现有药物难以获得长期疗效而导致大部分患者复发。每一次后续治疗的缓解期越来越短,来那度胺和万珂难治患者的存活率通常很低。
复发后挽救治疗的选择首先取决于疾病复发的时间点。如果疾病复发在主要疗程结束6个月之后出现,可能需要进行新一轮的一线药物治疗。如果复发在6个月内出现,患者通常需要接受基础化疗方案,使用作用于不同靶点的药物,例如经沙利度胺治疗的患者在复发后可使用万珂。
由于沙利度胺与来那度胺具有交叉耐药性,特别是由于来那度胺被广泛用作一线药物,沙利度胺作为二线药物使用的情况较少。因此,万珂有机会作为二线药物使用,并且这一用途已获得广泛认可。万珂与来那度胺或沙利度胺的组合也在复发患者中显示出疗效,对于侵袭性、复发性疾病患者,通常建议使用多种药物的组合治疗。
作为攻克复发性/难治性多发性骨髓瘤治疗难题的最新药物,Pomalyst和Kyprolis已受到广泛关注。这2种药品均已获得批准,作为三线药物用于经万珂和沙利度胺或来那度胺组合治疗后出现复发并且在最后一次治疗后60天内出现疾病恶化的患者。Ⅱ期临床观察到的缓解率为2个药物通过加速审批提供了依据,而对存活率的长期影响还有待进一步确定。表1列出了使用Kyprolis和Pomalyst进行治疗的主要考虑因素。

表1 Kyprolis和Pomalyst比较Table 1 Comparison of Kyprolis and Pomalyst
3.2 关于Kyprolis
Kyprolis是第2代不可逆性蛋白酶体抑制剂,其与第1代可逆性蛋白酶体抑制剂相比能够产生更持久的抑制作用。在经多次既往治疗后复发的患者中进行的Kyprolis单一疗法的单臂、Ⅱb期003-A1试验为该药物获得批准提供了依据,这些患者的既往治疗次数中位数为5,并且80%的患者是万珂和来那度胺难治的或者对这些药物不耐受。在上述试验中观察到总生存期的显著延长,总生存期中值达到15.6个月,而其他治疗对此类晚期疾病的总生存期通常为9个月,相比之下,Kyprolis非常具有优势。另外还在万珂和来那度胺难治的标危和高危患者中观察到相似的缓解率和缓解持续时间,这一点为Kyprolis在复发性/难治性多发性骨髓瘤中的广泛应用提供依据。Onyx公司正在进行Kyprolis单一疗法的Ⅲ期FOCUS试验和用于评价将Kyprolis加入来那度胺-地塞米松治疗方案的ASPIRE试验,2个试验均在复发性/难治性患者中进行,进而为在欧洲的注册提供试验依据,同时ASPIRE数据也将为该药物在美国获得全票通过提供试验依据。预计2013年后半年可获得FOCUS的中期数据,届时将获悉该药物的功效是否与Ⅱ期试验结果同样令人满意。
Kyprolis与万珂相比的主要优势在于其耐受性更好,与皮下给药的万珂相比,Kyprolis引起的外周神经病变的发生率也显著较低,而这恰恰是万珂最明显的毒性。与最新获得批准的竞争药物Pomalyst相比,Kyprolis引起的3/4级中性白血球减少症的发生率也较低(Kyprolis和Pomalyst分别为11%和43%)。在003-A1试验中,最常见的3/4级不良反应为血小板减少症(29%)和贫血(24%)。包括恶心在内的胃肠道相关症状也比较常见,但一般认为可通过支持性护理得以控制。还需要对患者进行呼吸困难监测,因为34%的患者都会出现这一问题。随机化对照试验的数据将有助于进一步评价该药物在更大患者群中的利益和风险。
Kyprolis正在二线和三线药物市场中逐渐取代万珂的位置。正在多个国家进行的头对头ENDEAVOUR试验在经不超过3种方案治疗后复发的患者中比较Kyprolis和万珂,二者均与低剂量地塞米松联合使用。但是ENDEAVOUR试验难以在2018年之前完成,所以Kyprolis取代万珂仍有待时日。ASPIRE试验的另一目的是在经不超过3种方案治疗的患者中评价将Kyprolis加入来那度胺-地塞米松组合的益处,从而为早期联合用药提供依据。
Onyx公司还正在新诊断的、不符合移植条件的患者中进行试验,为Kyprolis作为一线药物使用提供依据,预计Ⅲ期CLARION试验的病人招募工作马上就会开始。作为另一项头对头试验,有利的试验数据将为Kyprolis作为一线药物这一扩展用途提供依据,如果观察到该药物对生存期有利,还可能提供更多的利好信息。
万珂在美国的专利保护将于2017年到期,而来自仿制药的Paragraph Ⅳ专利挑战目前正处于诉讼阶段。Onyx必须在万珂仿制药进入市场之前尽快证明Kyprolis的优越性。但是,Kyprolis的一个潜在缺陷是其不太方便的给药方案,其要求在为期28天的治疗周期的前3周内,每周连续2天进行静脉输注。而万珂的皮下给药已经获得批准并且已证明每周给药可降低毒性,因此万珂与Kyprolis相比更大的给药便利性可能会减少市场份额的损失。医保问题也会阻碍Kyprolis进入一线药物的行列,因为医保付款人只有在无其他治疗方案可选择的情况下才会许可Kyprolis的医保支付。
尽管存在这些问题,但是Kyprolis具有更高的药效和更好的耐受性,预计会有大量需求。Onyx在2013年早期进行的统计表明Kyprolis具有很高的医生采用度,在上市后5个月内,在三线及以下级别药物的市场份额占到25%。汤森路透Cortellis竞争情报(Thomson Reuters Cortellis for Competitive Intelligence)的共识预测数据预测Kyprolis会迅速成为畅销药,其在2016年的销售额会超过10亿美元。分析人士预测Kyprolis在全球范围内的销售额峰值将达到20亿美元。
3.3 关于Pomalyst
Celgene旗下的第3代口服免疫抑制剂Pomalyst(沙利度胺类似物)于2013年2月通过FDA的加速审批进入市场,是用于复发性/难治性患者的最新药物。在美国进行的Ⅱ期试验(MM-002)中,招募的患者均接受过包括来那度胺和万珂在内的治疗,既往治疗次数的中值为6,其中63%的患者经来那度胺-万珂组合治疗无效。该试验还包括Kyprolis难治性患者。Pomalyst的缓解持续时间中值为8.3个月,总生存期为16.5个月,这些数值与Kyprolis相比具有很大优势并且几乎是那些用于经多次既往治疗患者的常规药物的2倍。Pomalyst的疗效远远超过上一代免疫抑制剂沙利度胺和来那度胺,所以可以使用更低的剂量(每日4 mg,来那度胺和沙利度胺分别为每日25和200 mg)。基于早期的数据,预计Pomalyst在难治性多发性骨髓瘤治疗领域将取代沙利度胺——约25%~30%的难治性患者经来那度胺和万珂治疗均无效。
虽然还未公布Kyprolis的Ⅲ期临床数据,但是Pomalyst在Ⅲ期NIMBUS (MM-003)试验中的有利数据已经在2012年12月提交至美国血液学学会年会。在接受过至少2次既往治疗的患者中,Pomalyst和低剂量地塞米松联合用药与高剂量地塞米松相比大大延长了患者的无进展生存期和总生存期。与Kyprolis不同的是,目前还未将Pomalyst作为一线药物进行评价。
虽然Pomalyst的口服制剂与Kyprolis相比在给药便利性方面具有更大的优势,但是Pomalyst药品说明书内容涉及的安全性问题又使其处于劣势。与上一代免疫抑制剂相似,Pomalyst的黑框警告中表明其具有致畸毒性并可能引起静脉血栓栓塞,并且由于其潜在的致畸作用,只能通过限定的渠道进行销售。在Ⅱ期临床中最常见的3/4级不良反应为剂量相关的中性白血球减少症,有超过一半的受试患者出现该不良反应并且36%接受最大许可剂量(4 mg)的患者需要支持性治疗。由于潜在的静脉栓塞和肺栓塞风险,也需要在患者中进行血栓预防。
Pomalyst在欧盟的申请目前正处于审查阶段,预计2013年年底会从欧洲药品管理局获得批准,届时很可能在欧洲市场上击败Kyprolis。与Kyprolis相似,Pomalyst的预测销售额会超过10亿美元,但是来自Cortellis竞争情报的共识预测数据预测其在2018年的销售额会领先(Kyprolis和Pomalyst分别为16.6和12.85亿美元)。预计销售额的比较见图2。

图2 Kyprolis和Pomalyst的预计销售额Figure 2 Consensus sales estimates for Kyprolis and Pomalyst
由于Kyprolis和Pomalyst的存活期相关数据还不完整并且还缺乏与标准治疗方案的对比数据,这些药物的最佳使用原则还需进一步阐明。此外,还有必要进行更大规模的随机对照试验以进一步确定适合不同患者的具体治疗方案。但是对于新药而言,证明对诸如总生存期这样的治疗终点具有明确的改善变得越来越复杂,因为这需要更长的试验周期以梳理出与第1代和第2代免疫抑制剂和蛋白酶体抑制剂相比任何额外的有益之处。目前正在进行的一些研究在多种治疗方案中评价这2种药物,这些方案包括在复发性/难治性患者中采用Pomalyst和Kyprolis组合治疗。由于Pomalyst和Kyprolis属于不同的药物类别,因此将这2种药物组合可进一步提高疗效,而之前将上一代药物来那度胺和万珂组合时已观察到更好的疗效。组合疗法在过去总是出现毒性增大这一问题,而这些新药与之前的药物相比具有更好的耐受性,大大有利于组合疗法的实施。
3.4 新一代蛋白酶体抑制剂
继万珂成功开发之后,Kyprolis奠定了蛋白酶体作为多发性骨髓瘤治疗靶点的价值,而新一代的蛋白酶体抑制剂目前已用于临床。Millennium制药公司正在开发ixazomib citrate,将之作为万珂的后继产品,这是目前研究最深入的产品并且有可能成为市场上首个口服蛋白酶体抑制剂,预计会在2015年提交新药申请。选择该化合物进行开发是因为其与万珂相比具有更高的生物利用度、更好的耐受性和更强的组织穿透性。目前正在复发患者中进行Ⅲ期临床试验,未来也计划在新确诊患者中进行试验。目前在复发性/难治性患者中进行的Ⅲ期TOURMALINEMM1试验的目的是为了研究如何进行这一全新的、完全口服的药物治疗方案。该方案由ixazomib citrate、来那度胺和地塞米松组成,患者用药较为方便,其中ixazomib citrate和地塞米松每周给药1次,来那度胺每日给药1次。这一组合疗法在Ⅱ期临床试验中对未经治疗的患者非常有效,总缓解率达到92%。如果作为每周2次给药的单一疗法用于复发性/难治性多发性骨髓瘤患者,可有效控制疾病长达11.3个月。
Onyx公司正在开发第3代蛋白酶体抑制剂oprozomib,其口服生物利用度与Kyprolis相当,目前正处于Ⅰ/Ⅱ期临床研究阶段。在患有血液肿瘤(包括多发性骨髓瘤)的患者中进行的Ⅰb期临床试验的中期数据初步表明该药物在少数可评价的患者群中具有抗肿瘤活性。与Kyprolis相似,最常见的3/4级不良反应为血小板减少症。还在临床试验中观察到该药物与万珂和entinostat(泛HDAC抑制剂)的协同作用并且当与来那度胺和地塞米松联合使用时具有附加活性,这些研究结果均为该药物与前一代蛋白酶体抑制剂和其他类别的药物的联合使用提供了依据。
第1代和第2代蛋白酶体抑制剂需要注射给药,频繁的静脉给药严重影响患者的生活质量,与此相比,口服给药大大方便了患者。Millennium和Onyx两家公司希望这些耐受性更好、给药更方便的药物能够复制万珂和Kyprolis的成功。
其他用于临床的新一代蛋白酶体抑制剂包括marizomib和delanzomib,但是静脉给药这一给药途径使它们与更先进的口服竞争药物相比处于劣势。
4 个体化药物的应用
4.1 细胞遗传学和患者分级
现已证明多发性骨髓瘤是一种特殊的异质性疾病,已鉴定出存在多种基因异常。这些基因异常可能同时存在,也可能进一步出现缺失突变和次级易位突变。虽然细胞遗传学分析还未常规性应用于疾病分级系统中,但是基因异常可以提供重要的预后信息。Mayo Clinic最近发布了更新的疾病分级和风险调节治疗指导原则(mSMART),其中建议在诊断时对所有患者进行细胞遗传学评价。美国国家综合癌症网络还推出了用于鉴定高危细胞遗传异常患者的预后评估系统。
基因异常分为两大类:超二倍性和染色体结构改变。通常超二倍性的预后好于结构改变。最常见的基因异常为奇数号染色体的三体型异常,例如第3、5、7、9、11、15、19和21号染色体。
在染色体结构改变中,染色体17p13缺失的预后最差,染色体13缺失还与较短的无事件生存期和总生存期相关。易位突变非常常见,特别是免疫球蛋白重链基因(IGH)上的14q32易位,估计出现在约40%的患者中。最重要的易位之一是t(4;14),它会导致癌基因MMSET过度表达,引起组蛋白修饰进而强化一些细胞功能,例如细胞存活、细胞周期进展和DNA修复。已确定这一易位出现在10%~15%的患者中,由于会导致更短的缓解期和更严重的复发,因此将其与预后差相关联。但是,研究发现t(4;14)易位患者对包括万珂在内的治疗方案具有更好的治疗反应,上述发现为这一患者亚群带来更好的治疗结果并将他们重新归类为中危患者组。
Mayo的2013 mSMART指导原则建议根据细胞遗传学特征将患者分为三级危险组,如表2所示。

表2 2013 mSMART指导原则下的患者分级(Mayo Clinic, 2013年4月)Table 2 Patient stratification according to the 2013 mSMART guidelines (Mayo Clinic,April 2013)
4.2 个体化药物时代的治疗决策
按照新确诊患者的细胞遗传学分类,mSMART指导原则根据疾病进展的可能性以及治疗反应对标危、中危和高危患者推荐不同的治疗方案。对于高危患者而言,应确保采取更积极和持续的治疗,建议无限期进行万珂-来那度胺-地塞米松治疗。研究已证明万珂对t(4;14)易位患者尤其有利,因此有充足的理由将蛋白酶体抑制剂作为一线药物用于这一类患者;mSMART指导原则建议将万珂与美法仑-强的松或环磷酰胺-地塞米松联合使用,之后可选择万珂进行无限期维持治疗。建议对标危患者使用毒性较低的治疗方案以最大限度地提高生活质量,可选用的治疗方案例如来那度胺-低剂量地塞米松或沙利度胺-美法仑-强的松。
证明某种药物或治疗方案在某些患者群中具有明确疗效对药品可及性具有重要意义,并且可能使常规情况下的非医保药物进入医保范畴。患者分级更细的治疗方法特别有利于万珂和新一代蛋白酶体抑制剂的应用,例如VISTA研究数据表明当采用包括万珂的治疗方案时,具有高危细胞遗传学特征的患者与标危患者具有相似的缓解率、无进展生存期和总生存期。
虽然也评价了来那度胺对t(4;14)易位患者的治疗益处,但是与万珂相比支持该药物使用的数据较弱,并且回顾性研究也得出不同的结论,还需进行前瞻性研究以进一步评价来那度胺是否对这一患者群具有另外的治疗益处。
4.3 迈向个体化治疗的第一步
已通过基因组测序发现了多发性骨髓瘤患者中的频发突变,这可能使第1批个体化治疗药物的开发成为可能。首次对多个基因组同时测序的研究结果已在2011年公布,这使人们对多发性骨髓瘤在基因组水平的理解达到前所未有的深度。该研究鉴定出10个具有较高突变频率的基因,其中6个基因在之前的研究中并未被发现与癌症相关。在所研究的38名患者中,42%的患者中存在与RNA加工和蛋白质内稳定相关的基因突变,这些可能成为合理药物设计的新靶点。对多发性骨髓瘤以及骨髓环境中相互作用的更深入的理解有助于发现新的作用靶点并开发出新的药物类别,其中一些类别总结于表3。

表3 目前处于研究阶段的用于多发性骨髓瘤的新药物类别Table 3 New drug classes currently being investigated in multiple myeloma
BRAF突变被认为是最重要的发现,成为用于多发性骨髓瘤的BRAF抑制剂的研究依据。而之前已有作用于BRAF下游的抑制剂,例如将丝裂原活化蛋白激酶/胞外信号调节蛋白激酶(MEK)作为靶点的那些药物。Zelboraf(vemurafenib)进入市场标志着BRAF抑制剂目前已成为新确立的药物类别,希望能够尽快研究BRAF抑制剂对多发性骨髓瘤的功效。事实上,罗氏公司已经有所行动,该公司正在进行Zelboraf的Ⅱ期临床试验,评价其对包括多发性骨髓瘤在内的多种BRAF V600突变阳性癌症的功效。
MEK抑制剂能够为具有高危易位突变例如t(14;16)和t(14;20)的患者带来治疗益处,这些易位突变会导致癌基因MAF过度表达,进而增强骨髓瘤细胞增殖和粘附。初步的体外研究已证明MEK抑制剂能够在t(14;16)和t(4;14)易位突变的骨髓瘤细胞系中诱导凋亡并且使增殖停止,当与万珂、来那度胺或地塞米松联合使用时可增强细胞毒性。正在进行初期临床试验以进一步评价MEK抑制剂治疗多发性骨髓瘤的能力。一种令人感兴趣的治疗理念是联合使用靶点不同的药物。例如,葛兰素史克公司正在进行一项Ⅰ/Ⅱ期试验,在蛋白酶体抑制剂治疗无效的患者中评价该公司旗下的MEK抑制剂trametinib DMSO和AKT抑制剂afuresertib的口服给药组合。该试验预计在2013年第3季度完成,将为新的靶点治疗药物组合提供理论依据。
除了根据细胞遗传学分类确定的亚型外,还在分子水平发现了更多的多发性骨髓瘤亚型。已通过基因表达图谱鉴定出7个不同的多发性骨髓瘤亚型;在这些亚型中,MMSET/FGFR3和MAF亚型与总存活率低相关。希望MMSET晶体结构的阐明有助于基于结构-功能关系进行药物设计并开发MMSET抑制剂,这将是该疾病治疗领域的第1个合理药物开发。
另一个令人鼓舞的成果是单克隆抗体的开发,希望发现可以成功用于多发性骨髓瘤治疗的单克隆抗体,就像之前开发的Rituxan(rituximab)能够显著提高B细胞性非霍奇金淋巴瘤(NHL)和慢性淋巴细胞性白血病(CLL)的存活率。已有数个具有不同作用机制的单克隆抗体进入后期临床开发,其中elotuzumab(抗CS-1抗体)、siltuximab(抗IL-6抗体)和tabalumab (抗BAFF抗体)正处于Ⅲ期临床试验阶段。Elotuzumab与来那度胺和万珂组合时显示出非常有利的活性,这有可能为将单克隆抗体与化疗组合的治疗模式提供依据,与用于NHL和CLL的包含Rituxan的治疗方案相似。
从临床迅速进入市场的Zelboraf和Xalkori(crizotinib)分别用于BRAF V600E突变阳性骨髓瘤和ALK阳性非小细胞肺癌,而上述单克隆抗体的开发使多发性骨髓瘤患者有希望以相似的方式从个体化治疗中受益。但是在2011年进行的研究中,仅4%的患者被鉴定出携带BRAF突变,这一较小的患者群有可能降低诸如BRAF抑制剂的个体化治疗药物在多发性骨髓瘤治疗领域的商业价值。为了更全面地评价多发性骨髓瘤的突变频率,需要进行更大规模的基因组测序,而这一研究目前已经启动。为了更快地推动个体化药物的开发,多发性骨髓瘤研究基金(MMRF)启动了个体化药物研究计划,这是由包括百时美施贵宝(Bristol-Myers Squibb)、Millennium 和Onyx在内的多家制药公司共同参与的竞争前合作联合会。MMRF和多发性骨髓瘤研究联合会创始人及CEO——Kathy Giusti称,“这一层次的创新需要大胆的、充满雄心壮志的并且高度合作的科学研究。”
个体化药物研究计划的奠基石为COMMpass研究,其目的在于通过分析约1 000名多发性骨髓瘤患者的遗传信息为个体化治疗决策提供引导并且为下一代靶点药物的设计提供信息。
但是,目前还没有基因表达谱的标准化测定方法,而且靶点药物的使用还需要在更大规模的临床试验中进行验证。并行开发治疗药物和诊断技术需要更高的成本和更多的资源,例如需要企业自身具有诊断技术或与拥有专门技术的公司合作,这些都会影响个体化药物研发的推进。在大临床环境下采用个体化治疗的最大困难之一是需要可以在所有科室统一使用的廉价、简便的诊断方法。诊断检测的医保问题也可能成为一大障碍,特别是医保付款人不会考虑诊断检测的价值而是根据治疗时间和花费来决定是否纳入医保。个体化药物的广泛采用将需要对研究人员、制药产业、政策制定者和医保付款人进行广泛的宣传。
5 结论1
沙利度胺、来那度胺和万珂对多发性骨髓瘤患者具有显著的治疗效果,但是如何最好地使用这些药物仍然存在疑问,并且还缺乏长期存活率的数据。这些药物的组合有可能提高疗效,特别是对于疾病进展迅速的患者,但是也会存在毒性增加的风险。新一代药物Kyprolis和Pomalyst目前已经上市用于复发性/难治性多发性骨髓瘤患者,人们非常感兴趣如何将这些新药用于现有治疗模式以及哪一种治疗方案最有效。随着在细胞遗传学水平和分子水平对多发性骨髓瘤的进一步了解,如果能够克服药品可及性方面的障碍,预计更加个体化的预后和治疗方法将在疾病控制中发挥更大的作用。
第二部分:市场运营
6 焦点并购案例
Cortellis竞争情报关于并购交易的报道表明,自1986年以来与多发性骨髓瘤治疗领域相关的并购数量已超过560宗。
这一部分将总结已上市的多个多发性骨髓瘤治疗药物的转让情况以及一些有前景的多发性骨髓瘤候选治疗药物,这些已在Cortellis竞争情报中有所提及。本部分也会提及其他值得关注的高额并购交易,增加读者对多发性骨髓瘤治疗药物市场的了解。
7 Ibrutinib:广泛合作
Celera旗下的ibrutinib预计在2017年达到27亿美元的销售额,与Cortellis竞争情报报道的其他多发性骨髓瘤药物相比,有大量与ibrutinib相关的协议。与该药物相关的合作企业有6家之多。
事实上,Pharmacyclics公司在2011年8月与美国国家癌症研究所(NCI)的癌症治疗和诊断部(DCTD)签订了为期5年的研发合作协议(CRADA)以支持ibrutinib的研发,DCTD计划赞助该药物用于某些血液肿瘤的Ⅰ期和Ⅱ期临床试验,其中包括多发性骨髓瘤和非霍奇金淋巴瘤。未披露相关的财务细节。
2006年4月,Pharmacyclics收购了Celera Genomics的一些免疫抑制剂,包括CRA-024781(选择性HDAC-8抑制剂)、凝血因子Ⅶa抑制剂和用于淋巴瘤和自身免疫疾病的B细胞相关酪氨酸激酶抑制剂。Celera获得200万美元现金,价值50~100万美元的Pharmacyclics公司股票,高达1.44亿美元的里程碑付款,外加特许权使用费。
Pharmacyclics通过Qualifying Therapeutic Discovery Project (QTDP)项目于2010年11月获得美国政府约72.5万美元的拨款,用于开发PCI-32765、PCI-24781和PCI-27483。
Pharmacyclics和杨森生物技术公司从2011年12月起展开全球范围内的合作,共享Pharmacyclics旗下PCI-32765的开发和商业化权利,将该药物用于癌症和其他适应证,但不包括炎症和免疫相关疾病。Pharmacyclics获得1.5亿美元预付款和高达8.25亿美元的里程碑付款。各公司主导针对某些适应证的开发,但是共享开发经费,Pharmacyclics和杨森分别占40%和60%。Pharmacyclics和杨森将制定销售计划并分别负责美国本土和其他国家的市场化运作。这两家公司平分全球范围内的利润和亏损。在这一最初协议达成后,杨森于2012年8月支付了两笔单独的里程碑付款(均为5 000万美元),用于SPARK和RESONATE临床试验中五分之一患者的招募。2012年10月,杨森支付了第3笔高达5 000万美元的里程碑付款,用于Ⅲ期临床试验(CLL3001)五分之一患者的招募。
杨森和Pharmacyclics在2013年2月一起与雅培公司达成合作协议,使用雅培旗下的荧光原位杂交技术开发分子伴随诊断,用于鉴别可能对ibrutinib具有治疗反应的高危慢性淋巴细胞性白血病患者(未披露财务细节)。杨森公司肿瘤药物部全球药物主管William N. Hait博士称,“与Pharmacyclics达成的协议是为B细胞恶性肿瘤患者提供新型口服药物的一大契机。”表4列出了与ibrutinib相关的协议。

表4 Ibrutinib相关协议Table 4 Summary of ibrutinib agreements
8 国内市场的竞争产品:Celgene旗下的沙利度胺、沙利度胺类似物和Millennium旗下的万珂
Celgene公司旗下的沙利度胺享有多项专利并且达成了多项服务协议。该药物在2012年的销售收入达到3.02亿美元,但是预计在2018年会减少至1.59亿美元。围绕该药物进行的合作进一步达成了与其类似物相关的协议。EntreMed在1995年12月与NCI就沙利度胺这一药物建立了合作关系,Celgene于1998年12月从EntreMed收购了该药物相关专利和技术的全球独占权以及FDA孤儿药资格认定,进而取代EntreMed与NCI合作。
2001年8月,EntreMed将沙利度胺销售的特许权使用费出售给Royalty Pharma。EntreMed从Royalty获得2 430万美元并且还会获得另外300万美元的销售里程碑付款,外加某些特许权使用费。
Celgene与洛克菲勒大学的分子生理学和免疫学实验室在α-肿瘤坏死因子调节领域达成合作协议(截至1996年7月),用于开发治疗免疫系统疾病的药物。未披露相关的财务细节。
2001年11月,Pharmion获得了涵盖沙利度胺和沙利度胺处方安全教育系统(System for Thalidomide Education and Prescribing Safety)的知识产权独占实施许可,以及临床前和临床数据。Celgene保留了该药物在北美、中国、日本、韩国的相关权益并因此获得在这些地区的特许权使用费。Celgene还以期权方式收购了Pharmion的股权,还以独家认购期权的方式购买了Penn T,其为Penn制药公司生产沙利度胺的分公司。如果行使该期权,可使Celgene获得沙利度胺全部销售收入的36%特许权使用费(包括已售产品的成本),并且由Celgene的全资子公司管理沙利度胺的生产。2004年12月,Celgene和Pharmion修订了它们的合作协议。2004年10月,Celgene收购了Penn T,该合作协议从2005年延长至2007年。Pharmion还获得了在中国香港、中国台湾和韩国的开发权和销售权,而Celgene享有的与2006年12月获得欧盟批准时绑定的终止权被取消。
2008年3月,Celgene收购了Pharmion,并获得与沙利度胺相关的所有权益。2004年5月,Lipomed成为Pharmion(现为Celgene)指定的沙利度胺 Pharmion 50 mg在瑞士和澳大利亚的独家代理,并且即将停止在欧洲销售自家旗下的沙利度胺制剂。双方经协商撤销了Pharmion之前向Lipomed主张的专利侵权诉讼。
在Pomalyst和来那度胺于2003年1月以约2 700万美元被转让后,EntreMed旗下的2个沙利度胺类似物也被纳入Celgene的产品线。EntreMed之后获得了现金付款以及可转换优先股和认证股形式的股权投资。此外,Celgene向EntreMed履行某些授权给付义务并持有1年期权,以在3个临床前产品中选出1个用于和EntreMed合作研发并获得授权。Celgene还会从Children′s Hospital获得其沙利度胺类似物专利组合在全球范围内的专属授权。同时,相关专家预测Pomalyst在2018年的销售额将达到12.8亿美元,而来那度胺在2017年的销售额为67亿美元。
Celgene与NCI于2000年6月签署了为期5年的CRADA协议,涉及Celgene旗下包括2个类似物在内的免疫抑制剂(IMiDs)的临床前和临床开发,以及包括CC-11006和CC-11050的SelCIDs研究计划。未披露与CRADA相关的财务细节。该公司与多发性骨髓瘤研究联盟(MMRC)于2008年8月达成合作意向,主要围绕Pomalyst在难治性多发性骨髓瘤患者中的临床试验。Celgene还邀请Innate Pharma参与评价将来那度胺与Innate旗下的IPH-2101组合使用的潜在临床协同作用,该评价于2009年11月在美国进行的Ⅱ期临床试验中进行,受试者为一线药物治疗失败的多发性骨髓瘤患者。
9 关于万珂
蛋白酶体抑制剂万珂(另一个面临来那度胺竞争的抗癌药物,预计2018年的销售额为5.79亿美元,而2011年为20亿美元)的临床开发是另一CRADA协议的核心内容,该协议由ProScript(之后改名为LeukoSite,现名Millennium)和NCI于1999年1月签署,未披露任何财务细节。
Ortho Biotech(现名杨森生物技术公司)和Millennium于2003年6月达成了在美国市场之外进行万珂用于多发性骨髓瘤的开发和商业化运作的协议,而Millennium保留在美国的所有商业化权利和相关收益。Millennium保留了未来在某些欧洲国家共同推广的期权。Millennium获得该药物用于多发性骨髓瘤以及其他实体瘤和(或)血癌在美国之外的特许权使用费,包括1 500万美元预付款和高达5.2亿美元的里程碑付款。这两家公司还联合制定了全球综合性研究项目,以进一步在美国、欧盟和日本开发万珂。2006年10月,该合作协议经修订包括了在美国境内为期2年的共同推广协议,计划于2007年第1季度启动。Millennium需要支付Ortho超过销售目标的佣金以及一部分销售成本。Millennium仍然负责在美国的市场化运作、生产和销售。两家公司在2003年达成的在美国之外的市场化协议将继续有效。
Alnylam制药公司总裁和COO,Millennium公司抗癌药物部前任总经理Barry Greene称,“我们相信Ortho Biotech是商业化运作和开发方面出色的合作伙伴,能够全面挖掘万珂的潜在价值并将这一全新的抗癌药物推向全世界有此需要的患者。”
2010年5月,杨森制药公司(隶属于强生公司)和Millennium公司达成了在日本进行共同市场营销的协议。同年,Pharmstandard和强生公司同意将二级包装本土化。两项协议的财务细节均未披露。表5列出了沙利度胺、沙利度胺类似物及万珂的相关协议。

表5 沙利度胺、沙利度胺类似物以及万珂的相关协议Table 5 Summary of Thalomid, Thalomid analogues and Velcade agreements
10 聚焦战略性药物的高额并购
在本文的战略性药物部分报道了多个并购交易额很高的战略性药物,其中之一是从Genmab公司转让至杨森生物技术公司旗下处于Ⅱ期临床的抗CD38人单克隆抗体(daratumumab)。杨森于2012年8月收购了该药物和另一个后备产品人CD38抗体的全球独占权,杨森向Genmab支付5 500万美元的预付款和高达10亿美元的里程碑付款,外加分次支付的两位数特许权使用费。作为强生的附属公司,Johnson & Johnson Development通过约8 000万美元(4.75亿丹麦克朗)的股权投资以每股88丹麦克朗的价格购入Genmab公司540万美元新股。
PDL BioPharma已在2008年12月底将旗下的几种处于研发阶段的新药转给其衍生公司Facet Biotech(现为Abbott Laboratories子公司),但是未披露财务细节。这些药物包括靶向CS-1/CD37的人单克隆抗体(elotuzumab)、daclizumab( 静 脉 和 皮 下 给 药)、volociximab、enavatuzumab和PDL-241。
PDL之前于2008年8月与百时美施贵宝公司签署了全球合作协议。根据该协议,PDL获得3 000万美元预付款,高达6.8亿美元的里程碑付款以及美国之外的特许权使用费,而美国境内的收益由两家公司均分。BMS的另一项期权将合作扩展至包括PDL旗下的免疫药物PDL-241,该公司向PDL支付另外一笔1 500万美元的现金股权付款以及总值达到4.3亿美元的里程碑付款。
2010年1月,在elotuzumab的Ⅰ/Ⅱ期临床试验的Ⅱ期单臂试验患者招募结束后,Facet从百时美施贵宝获得1500万美元的里程碑付款。
2010年9月,Ono制药公司从Onyx制药公司收购了oprozomib和Kyprolis两个药物(预计2018年的销售额达到16亿美元),为3.3亿美元并购交易的一部分。该并购交易还包括在日本对这些药物用于癌症治疗的开发和商业化运作的独占权。Onyx获得50亿日元(约5 400万美元)的预付款、约2.8亿美元的里程碑付款以及两位数特许权使用费。Onyx公司总裁和CEO——N. Anthony Coles称,“Ono专注于创新药物的研发,在科研领域享有极高的声誉,是我们在日本最理想的合作伙伴。”
表6总结了焦点战略性药物的高额并购情况。
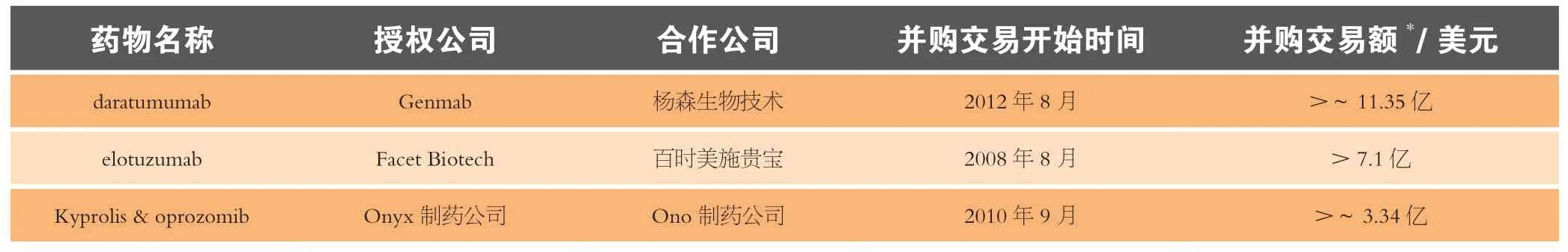
表6 聚焦战略性药物的高额并购Table 6 Summary of selected high value deals for strategic drugs of focus
11 多发性骨髓瘤治疗领域的其他高额并购交易
Cortellis竞争情报报道的多发性骨髓瘤治疗领域的高额并购交易之一是诺华公司2009年11月达成的关于口服药物INCB-18424的交易,该公司以13亿美元获得了该药物用于骨髓纤维化治疗在美国市场之外的开发权和商业化权。该交易中还包括Incyte旗下多发性骨髓瘤药物INCB-28060用于血癌类适应证在全球范围内的相关权益。Incyte获得1.5亿美元预付款,6 000万美元中期里程碑付款用于启动COMFORT-Ⅱ INCB-18424的Ⅲ期临床试验,以及高达约11亿美元的进一步里程碑付款和两位数的特许权使用费,而合作研究费用将由各家公司分担。诺华负责INCB-28060 Ⅰ期临床后的开发,Incyte持有对该药物进行共同开发和市场推广的期权。Incyte后续收到额外的1.05亿美元里程碑付款。
Incyte总裁和CEO——Paul A. Friedman表示,“诺华制药对INCB-18424在骨髓纤维化和其他癌症治疗领域的潜能有深入的了解,并且该公司之前已成功将许多抗癌新药快速市场化,这些正是我们选择诺华作为合作伙伴的原因。”
诺华还在2004年5月与MorphoSys达成了为期3年的合作联盟,这是骨髓瘤治疗领域的另一项高额并购。这两家公司计划利用MorphoSys旗下的HuCAL GOLD平台研发包括NOV-3在内的抗体,作用于诺华发现的靶点。诺华保留了将这一并购交易延长至5年的权利。诺华通过从MorphoSys购买不付息可转化债券向该合作伙伴投资900万欧元(约1 120万美元),可转化成490 133份MorphoSys公司的普通股,该债券从条件资本中发行。MorphoSys还在前3年获得超过3 000万美元的研发基金和技术转让费,以及后期的技术转让费和里程碑付款,外加特许权使用费。诺华获得将这一平台内在化的非独家认购期权,这需要向MorphoSys支付额外的费用。
该合作联盟在2007年12月得到进一步扩展,双方达成为期10年、价值超过10亿美元的合作协议,诺华将利用上述平台研发用于多种疾病的抗体。MorphoSys获得超过6亿美元的年费,额外的里程碑付款、研发基金以及收益分成和(或)特许权使用费,但是保留了某些项目的共同开发权以及在特定区域的商业化权。诺华获得将该合作延长2年或者在7年后终结的期权。
MorphoSys在2008年9月行使了与诺华合作参与抗体项目研发的期权,该项目由诺华提供资金支持。2009年3月发现了BHQ-880,推测MorphoSys会将该药物转让给诺华。
基于MorphoSys在其技术领域成功取得了预定的进展,诺华在2009年7月履行了之前达成的10年协议。该协议将于2017年终止,但诺华方面可能将其延长2年,取消了7年后终止合作的期权。根据后续报道披露,用于眼科疾病的LJM-716、用于骨骼肌肉疾病的BYM-338、以及VAY-736和 LJM-716均为这一协议的一部分。
诺华生物医学研究所总裁Mark Fishman博士称,“MorphoSys具有高度分化的技术,我们相信这些技术将显著强化和加速我们的抗体研究,这也是我们选择MorphoSys作为理想合作伙伴的原因。”
表7列出了多发性骨髓瘤治疗药物相关的高额合作协议。

表7 多发性骨髓瘤治疗药物相关的高额协议一览Table 7 Summary of high value agreements for multiple myeloma
2000年12月,Genentech参 与 共 同 开 发Seattle Genetics旗下的CD40抗体拮抗剂,由此发现了dacetuzumab对多发性骨髓瘤的潜在治疗价值。虽然Genentech在2002年10月终止了其中1个先导化合物SGN-14的开发,但是该公司于2007年1月转让了另一先导化合物SGN-40的全球独占权。Seattle获得6 000万美元预付款,超过8亿美元的里程碑付款以及不断提高的两位数特许权使用费。至2010年2月,Seattle在该协议期间获得2 000万美元,之后两家公司分道扬镳。Seattle接着于2011年8月终止了该药物和抗牛皮癣药物CD70抗体抑制剂vorsetuzumab的开发,将其资源整合至抗体-药物偶联物的研发。
Seattle Genetics总裁兼CEO——Clay B. Siegall博士称,“Genentech具有丰富的抗癌药物研发经验,也与其他公司进行过成功的战略性合作,这正是其成为我们理想的合作伙伴的原因,患者也有望从SGN-40受益。”
12 结论2
万珂和沙利度胺这两个药物都面临来自Celgene旗下的沙利度胺类似物来那度胺的竞争。Celgene和EntreMed之间的合作涉及沙利度胺和来那度胺,以及另外一种沙利度胺类似物Pomalyst。Celgene最早是在EntreMed退出后与NCI达成这一合作关系,作为该公司沙利度胺开发的一部分,但是未披露EntreMed这样做的原因。在达成协议时,EntreMed声明从Celgene获得的所有沙利度胺开发相关的特许权使用费将全部用于抗血管生成抗癌药endostatin的临床试验研发(从1999年开始)。2009年11月之后,未见报道与沙利度胺相关的任何研发进展。
之后,Celgene以2 700万美元转让了EntreMed旗下的来那度胺和Pomalyst,这两个药物在今后几年的总销售额预计可达到80亿美元。这一次的决策仍然是不明确的,但是它紧接着发生在两个公司撤销了对对方的关于Pomalyst的专利和应用的法律诉讼之后。而基金会将帮助EntreMed缓解其近期和中期的现金紧张局面。
市场对多发性骨髓瘤治疗药物的兴趣显而易见,杨森生物技术公司和百时美施贵宝公司在Ⅱ期候选药物daratumumab和Ⅲ期候选药物elotuzumab(预测之后几年的销售额会超过5亿美元)上的投资超过5亿美元,而在合作协议达成时前一个药物仅处于早期研发阶段,后一个药物处于Ⅱ期临床研究阶段。
诺华还斥资超过23亿美元重金投资了Incyte旗下处于研发早期的药物BHQ-880和INCB-18424,但是未见第2个药物用于多发性骨髓瘤的进一步研发报道。
一方面需要研发更多的多发性骨髓瘤治疗药物,另一方面发病率更高的癌症治疗领域已经充斥了大量药物,因此,制药企业进一步的投资和合作应将多发性骨髓瘤这一血液系统疾病置于更高的市场位置。
编者注:
本文来源于2013年第1季度数据,发布于2013年5月。
翻译:
中国药科大学 史志祥,陈菁
Spotlight on Multiple Myeloma
Thomson Reuters
Despite the therapeutic advances made over the last decade with the introduction of the immunomodulatory and proteasome inhibitor drug classes, multiple myeloma is still associated with a poor prognosis and has one of the lowest five-year survival rates in oncology. The disease remains incurable, and successfully maintaining remission is an uphill battle. Therapy is complicated by multiple settings and regimens, with a lack of long-term data from large-scale comparative trials to aid treatment choices. Next-generation drugs with improved efficacy and tolerability have now entered the market for heavily pre-treated patients following accelerated approval in the relapsed/refractory settings, but the survial data are currently immature. In the genomics era, steps are being taken towards a more personalized approach to prognosis and treatment; however, this field remains very much in its infancy. It is hoped that further elucidation of the molecular mechanisms of multiple myeloma and pre-competitive research collaborations will enable the rapid development of next-generation targeted therapies in this area of high unmet medical need.
multiple myeloma; thalidomide; lenalidomide; bortezomib; front-line therapy

R979.1
D
1001-5094(2014)01-0063-14

