不同海拔地区急性脑梗死患者血清基质金属蛋白酶-2 与超敏C 反应蛋白的变化
梅 利,吴世政,张淑坤
脑梗死是脑部血液供应障碍,脑组织缺血、缺氧,导致坏死,出现相应的神经功能缺损。MMP-2是一组可消化细胞外基质的重要酶类,参与ACI 的病理过程。hsCRP 水平与缺血性脑卒中的发病相关,脑梗死面积越大,神经功能障碍越重,其hsCRP水平升高更明显[1]。本文通过研究ACI 患者血清中MMP-2 和hsCRP 水平与不同海拔的相关性,早期识别和干预急性高原脑梗死。
1 资料与方法
1.1 资料 3 个地区ACI 患者分别为49、43、47 例,为3 个地区2012 年3 月~2013 年10 月住院患者,发病均在48 h 之内,男性分别29、23、23 例;女性分别20、20、24 例,年龄45~86 岁。均符合1995 年全国第四届脑血管病会议制定的脑卒中患者临床神经功能缺损程度评分标准(CNFDS)[2]。3个地区ACI 重型(31~45 分)分别为15、15、17 例;中型(16~30 分)14、17、16 例;轻型(0~15 分)17、14、17 例。根据头部CT 或MRI 病灶大小,梗死体积按Pullicino 公式(长×宽×层数÷2)计算,3 个地区ACI 大梗死(病灶体积>10 cm3)分别为15、15、16 例;中梗死(病灶体积4~10 cm3)分别为15、17、18 例;小梗死(病灶体积<4 cm3)分别为13、17、13例。根据患者发病48 h 内和发病1 m 时的CNFDS评分数将脑梗死患者近期预后分为4 级:(1)显著进步:发病1 m 时CNFDS 评分改善在50%~99%或完全恢复正常;(2)进步:发病1 m 时CNFDS 评分改善在16%~49%;(3)无变化:发病1 m 时CNFDS评分改善在15%以下或无恢复;(4)死亡:对照组50 例,男性分别25、28、27 例;女性分别25、22、23例;年龄42~79 岁,均来自志愿者和医院工作者,年龄、性别构成在各组之间没有统计学差异。排除标准:本次发病前已存在任何原因所致的神经功能缺损、生活不能自理,合并有血液病及严重的肝、肾功能衰竭、肿瘤、严重的全身感染或近期有外科手术和创伤史以及自身免疫性疾病、糖尿病、冠心病心肌梗死、房颤,周围血管闭塞性疾病等。
1.2 方法
1.2.1 检测项目 ACI 患者为3 个地区入院48 h 内、7 d、14 d,清晨6 时采集空腹肘静脉血2 ml两份,2 h 内分离血清,海西及广汉血清保存在-30℃低温冰箱,冰盒中运送我院,采用酶联免疫吸附法(ELISA)测定血清MMP-2 和hsCRP。MMP-2 及hsCRP 试剂盒均为德国罗氏公司所提供。对照组亦是3 个地区在体检1 d、7 d、14 d,早6 时空腹静脉血2 ml 两份,方法同上,具体操作均按试剂说明书。
1.2.2 统计学方法 用SPSS13.0 统计软件,实验数据以均数±标准差(±s)表示,两组间比较用成组t 检验,多组间比较用方差分析,相关性用Spearman 相关分析。
2 结果
2.1 不同海拔地区ACI 组与正常对照组相比,血清MMP-2、hsCRP 水平增高,随海拔增高,ACI患者MMP-2 与hsCRP 水平增高;不同海拔ACI 患者,在病程不同时间,MMP-2 与hsCRP 水平不同,MMP-2 在7 d 时增高最明显,而hsCRP 水平则在病程48 h 内增高明显(见表1)。
2.2 不同海拔ACI 组血清MMP-2、hsCRP 与神经功能受损程度的关系(见表2)。
2.3 不同海拔ACI 患者血清MMP-2、hsCRP与梗死体积比较,血清hsCRP 在小梗死组无变化(见表3)。
2.4 不同海拔ACI 患者血清MMP-2、hsCRP水平与预后的关系(见表4)。
表1 不同海拔ACI 患者血清MMP-2、hsCRP 水平的比较(±s)
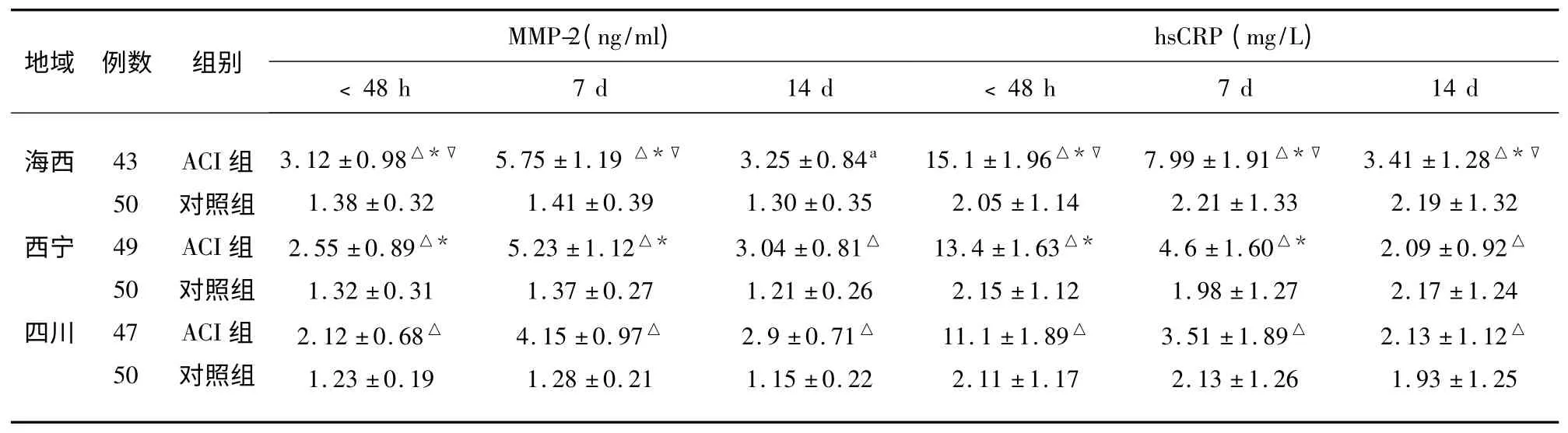
表1 不同海拔ACI 患者血清MMP-2、hsCRP 水平的比较(±s)
表示同海拔ACI 与对照组比较△P<0.05;不同地区ACI 比较,表示与四川ACI 比较* P<0.05,表示与西宁地区ACI 比较▽P<0.05
表2 不同海拔不同程度神经功能受损患者血清MMP-2、hsCRP 水平变化(±s)
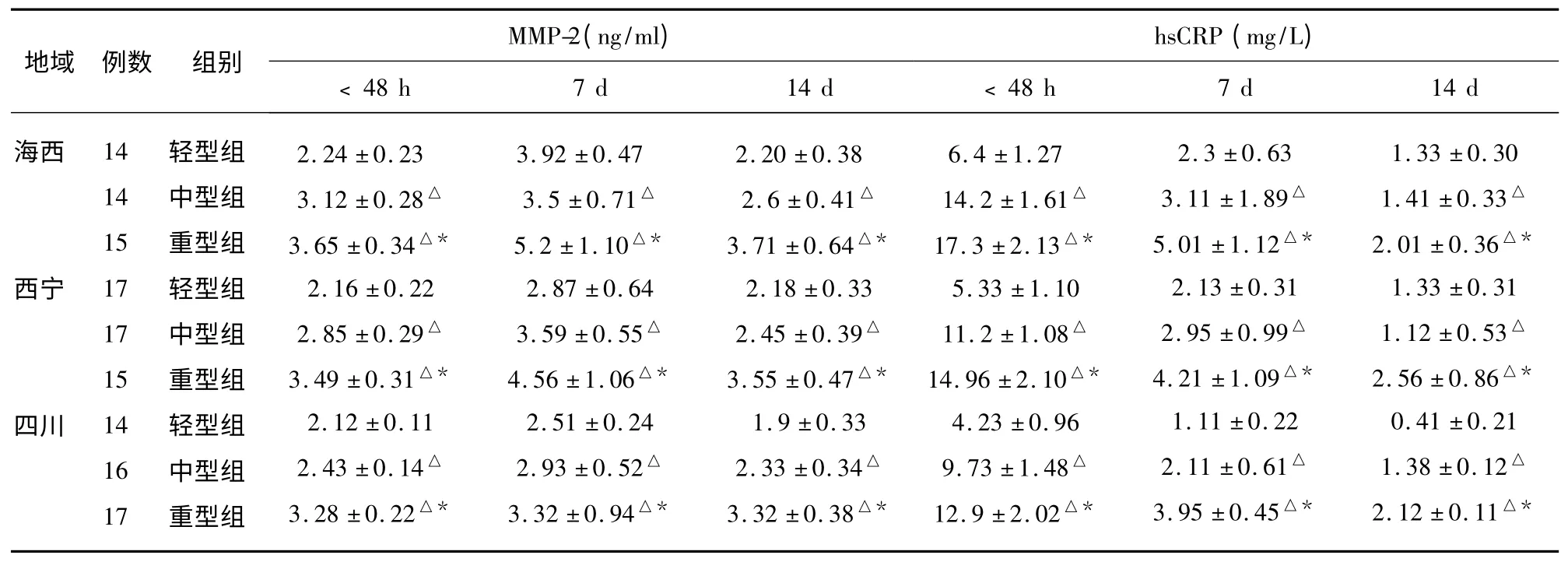
表2 不同海拔不同程度神经功能受损患者血清MMP-2、hsCRP 水平变化(±s)
同海拔ACI 中,与轻型组比较△P<0.05;同海拔ACI 中,与中型组比较* P<0.05
表3 不同海拔脑梗死患者血清MMP-2、hsCRP 水平与梗死体积大小比较(±s)
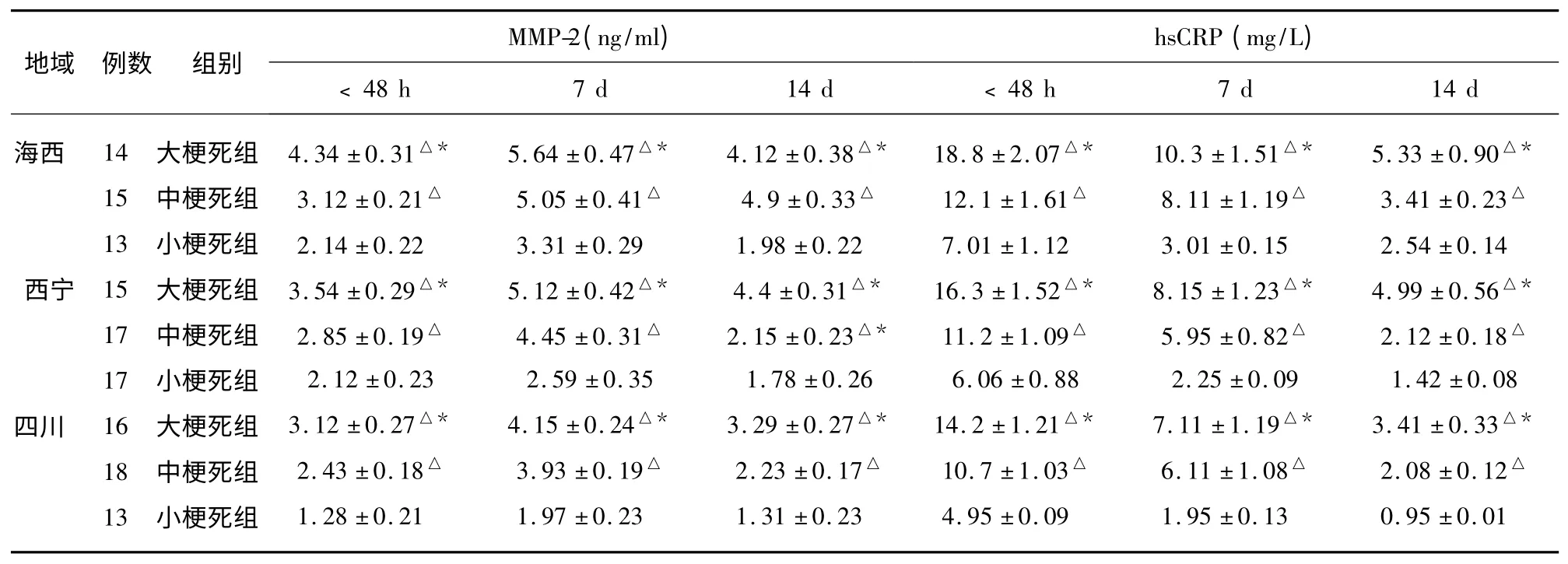
表3 不同海拔脑梗死患者血清MMP-2、hsCRP 水平与梗死体积大小比较(±s)
同海拔ACI,与小梗死体积组比较△P<0.05;同海拔ACI,与中梗死体积组比较* P<0.05
表4 不同海拔脑梗死患者血清MMP-2、hsCRP 水平与预后比较(±s)
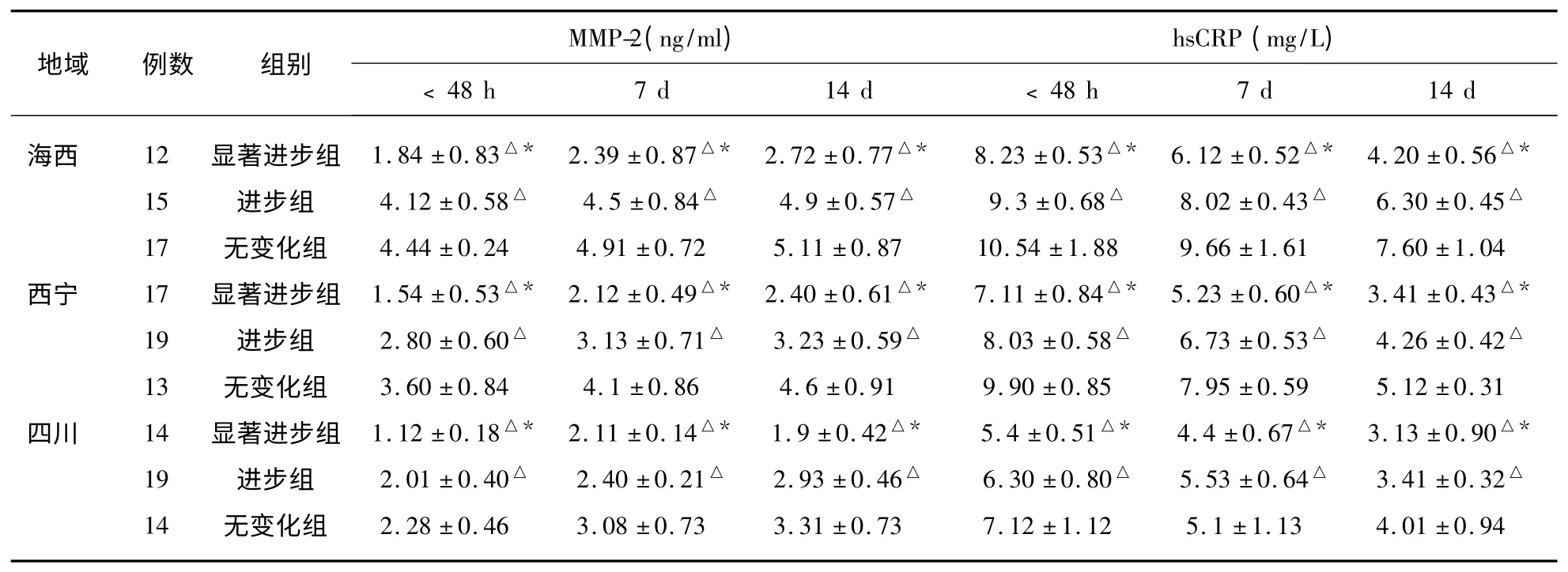
表4 不同海拔脑梗死患者血清MMP-2、hsCRP 水平与预后比较(±s)
同海拔ACI,与无变化组比较△P<0.05;同海拔ACI,与进步组比较* P<0.05
3 讨论
MMP-2 广泛存在于正常人体的各个组织,特异性地将胶原降解成小的片段,分解包括弹性蛋白、层黏连蛋白等多种细胞外基质[3]。研究发现MMP-2的表达与脑微血管生成、血脑屏障的通透性改变、血脑屏障的崩溃、炎细胞浸润密切相关。脑缺血后血脑屏障开放具有双向性,血脑屏障在大脑中动脉阻断后最初3 h 的开放与MMP-2 有关,而MMP-2 活性在细胞内24 h 时升高,并在5 d 后达最大值[4]。Yang[5]研究不同海拔大鼠在脑缺血后,MMP-2、9 在24 h、48 h 升高明显。
本研究显示,高原地区对照组血清MMP-2、hsCRP 水平高于平原,且不同海拔ACI 血清MMP-2、hsCRP 水平高于各对照组,且增高程度与海拔梯度密切相关,同时发现不同海拔ACI 组在病程48 h 内血清MMP-2 水平增高,7 d 时达高峰,后渐下降,还发现不同海拔脑梗死体积越大,神经功能缺损程度越重,血清MMP-2 和hsCRP 水平越高,预后越差。
我们推测高原缺氧、低气压和强紫外线等特殊环境的影响,造成神经和血管内皮细胞一系列反应导致体内环境变化,与Hagobian 研究一致[6]。在不同海拔地区各对照组血清MMP-2、hsCRP 随梯度升高考虑炎性因子与高原缺氧引起的敏感性增高有关,在高海拔地区ACI 不仅梗死灶局部MMP-2 水平及活性增高,且相应外周血MMP-2 水平也会增高,推测其机制为,ACI 时,局部出现缺血/缺氧,作为一种信号刺激内皮细胞、胶质细胞、炎性细胞因子等激活MMP-2,导致梗死灶局部MMP-2 表达与活性增高,增高的MMP-2 降解基底膜,导致脑血管通透性增高,引起血脑屏障破坏,使局部MMP-2 及炎性产物进入外循环系统。同时,卒中也会导致全身免疫反应,使周围循环系统炎性细胞合成和分泌MMP-2,从而使血清MMP-2 上升。
hsCRP 是重要的急性期蛋白,脑缺血后脑组织可导致炎症介质白介素-1、6 的释放,促进hsCRP 的合成,所以hsCRP 作为一种炎症标记物在ACI 患者血清中的浓度增高曾被认为是ACI 的伴随现象,即ACI 导致了hsCRP 的浓度增高。研究发现不同海拔ACI 患者hsCRP 在病程48 h 内增高明显且高于对照组,考虑炎性因子致高原地区ACI 发病的可能机制:由于人体长期处于高寒缺氧,引起血液黏度升高、血小板聚集增强、血流阻力增加、代谢产物在局部潴留,使酸性代谢产物增多,导致血管内皮血氧供应不足而坏死脱落。当内皮细胞受损,使MMP-2、hsCRP释放增加刺激炎性因子表达增强,导致脑组织缺血缺氧。随海拔的增高、缺氧加剧等因素,炎性介质可激活局部血管内皮细胞和白细胞,诱导细胞表面黏附分子数量及功能明显上调,造成白细胞与内皮细胞大量牢固的黏附,引起血管阻塞[7,8]。
研究显示,单独检测血清hsCRP 水平可作为首发和再发脑血管事件的危险预测因子[9]。ACI 时,缺血造成的再灌注损伤,诱发了急性炎症反应,加之机体处于应急状态,血清hsCRP 水平也会升高,使得ACI 患者血清hsCRP 水升高,显著高于正常人群,且随着海拔增高及慢性缺氧加重,引起炎性反应增强,从而加重脑组织的损伤。高原的低压性缺氧使人体血氧含量和血氧饱和度降低甚至导致低氧血症,是高原环境对人体影响最明显和最严重的因素[10],这与本次研究相吻合。
高原人群长期慢性缺氧刺激机体血液代偿性产生红细胞、血红蛋白及红细胞压积增加,血液黏度增高,血流减慢,使血小板聚集增强,易附于损伤的血管壁形成血栓,粘稠的血液也可直接影响脑循环的有效灌注,这可能是高原ACI 易发的主要原因[11]。因此,临床中应注意及时抑制、减轻脑梗死后发生的炎症反应,降低血清MMP-2、hsCRP 浓度,防止由此造成的脑组织损害。
总之,血清MMP-2、hs-CRP 参与血管内膜的炎性反应,其增高是引起脑梗死的关键因素之一。炎症反应与不同海拔之间的关系,可能与高寒缺氧、环境恶劣、低气压有关,其相关性有待于进一步研究。
[1]Tuttolomondo A,Di Raimondo D,Pecoraro R,et al.Inflammation in ischemic stroke subtypes[J].Curr Pharm Des,2012,18(28):4289-4290.
[2]中华医学会神经科学会.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29:379.
[3]刘子科,林智敏,许海珍,等.基质金属蛋白酶-2 与脑血管畸形关系的研究[J].吉林医学,2011,32(19):3887-3888.
[4]Hill JW,Poddar R,Thompson JF,et al.Intranuclear matrix metalloproteinases promote DNA damage and apoptosis induced by oxygen glucose deprivation in neurons[J].Neuroscience,2012,18(12):277-280.
[5]Yang Y,Candelario-Jalil E,Thompson JF,et al.Increased intranuclear matrix metalloproteinase activity in neurons interferes with oxidative DNA repair in focal cerebral ischemia[J].Neurochem,2010,112(1):134-140.
[6]Hagobian TA,Jacobs KA,Su budhi AW,et al.Cytokine responses at high altitude:effects of exercise and antioxidant sat 4300m[J].Med Sci Sports Exerc,2006,38(6):276-285.
[7]高景良.外伤后大面积脑梗死血白细胞计数及血浆D-二聚体的检测及临床意义[J].实用心脑肺血管病杂志,2010,18(9):1208-1209.
[8]Zeng L,He X,Liu J,et al.Differences of circulating inflammatory markers between large-and small vessel disease in patients with acute ischemic stroke[J].Int J Med Sci,2013,10(10):1399-1341.
[9]王立志,邓宇平,李博生.脑梗死急性期超敏C 反应蛋白水平与神经功能恢复的关系[J].中国实用神经疾病杂志,2012,4(15):8-11.
[10]薛 婧,徐江涛,宋永斌,等.高原脑血管病的研究进展[J].现代生物医学展,2009,9(21):4199-4201.
[11]朱爱琴,褚以德.高原地区急性脑梗死患者炎性反应相关因子含量的变化[J].中华老年心脑血管病杂志,2007,9(6):394-395.

