黄杆菌肝素酶Ⅱ重组菌培养条件的优化及高密度发酵
周斌,程咏梅,邓超,刘卫超,陈潮梁,陈敬华,许正宏
1江南大学药学院,江苏 无锡 214122
2江南大学无锡医学院,江苏 无锡 214122
肝素酶是指一类作用于肝素或者硫酸乙酰肝素的多糖裂解酶。目前从肝素黄杆菌中提取的肝素酶主要为肝素酶Ⅰ、Ⅱ、Ⅲ三种[1]。其中肝素酶Ⅱ有较宽的底物选择性,可以特异性切割肝素、硫酸乙酰肝素类分子内的连接键,主要应用于阐明肝素的结构[2]、研究抗凝血机制[3]、制备抗肿瘤药物[4]及低分子量肝素[5]等。传统生产肝素酶的方法是肝素黄杆菌发酵法。Galliher等[6]采用合成培养基代替天然培养基,以肝素作诱导剂,将肝素酶总酶活提高了4倍。此后他们研究了不同碳氮源、诱导剂对酶活的影响,并采用流加补料方式发酵,将总酶活提高近60倍[7],此方法得到的肝素酶为肝素酶Ⅰ、Ⅱ、Ⅲ的混合物,且并未单独对肝素酶Ⅱ的生产进行研究。Lohse等[8]从肝素黄杆菌发酵的混合肝素酶液中经多步纯化制备出肝素酶Ⅱ,但回收率仅有1.02%。此外研究人员主要通过改变融合策略来简化肝素酶Ⅱ的纯化步骤以期达成肝素酶Ⅱ的可溶性表达,提高酶活和收率。Su等[9]将肝素酶Ⅱ基因Hep B克隆,并在大肠杆菌中重组表达,结果表明肝素酶Ⅱ易形成包涵体,且包涵体所占的比例在37–25℃随着温度的降低而下降。傅文彬等[10]将Hep B插入质粒pET24a中构建重组菌,低温20℃成功诱导表达了带有组氨酸标签的融合肝素酶Ⅱ,但该过程中也易形成包涵体,可溶性表达量不高,酶活仅为50 U/L。Blain等[11]将肝素酶Ⅱ的基因插入到肝素酶Ⅰ调节区的下游,整合得到全新的转化子菌株,结果表明,在新的表达体系中肝素酶Ⅱ的表达量提高了5倍。邢新会等[12]将HepⅡ与MBP融合并在宿主TB1实现了可溶性表达,SDS-PAGE凝胶电泳中融合蛋白呈单一条带,但酶活仍不高,仅为118.4 IU/L。总体而言,目前对肝素酶Ⅱ的生产研究仍较少,且据文献报道产量仍偏低。
本实验室构建了重组基因工程菌E.coli BL21(DE3)-pET19b-HepⅡ,该菌株能可溶性表达带有组氨酸标签的 HepⅡ(His-HepⅡ),酶活可达180 U/L。为进一步提高肝素酶Ⅱ的可溶性表达,实现肝素酶Ⅱ产量和酶活的提高,现以此工程菌为出发点,对其诱导条件进行优化,并将该条件应用到高密度发酵中,以实现His-HepⅡ产量和酶活的大幅度提高,为HepⅡ的工业化生产与应用奠定基础。
1 材料与方法
1.1 材料
重组工程菌E.coli BL21(DE3)-pET19b-HepⅡ由本实验室自行构建;利用基因工程手段PCR扩增出肝素酶Ⅱ基因Hep B,再将其插入pET19b质粒,构建重组质粒,然后将重组质粒导入感受态E.coli BL21(DE3),构建重组工程菌。
实验中确定诱导条件所用培养基为LB培养基[13],高密度发酵培养基为R培养基[13]。
R培养基:磷酸氢二钾13.5 g/L,柠檬酸1.7 g/L,微量金属离子溶液10 mL/L,七水硫酸镁1.4 g/L,赖氨酸2 mg/L,加合适的碳源与氮源,调节pH值至7.0。
微量金属离子溶液(g/L):七水硫酸铁10,二水氯化钙2,七水硫酸锌2.2,四水硫酸锰0.5,五水硫酸铜1,四水合钼酸铵0.1,四硼酸钠0.02,用5 mol/L HCl溶解。
1.2 方法
1.2.1 种子活化
将保存菌种按1%的量接种至10 mL的LB液体培养基中,加氨苄青霉素至终浓度为50 μg/mL,37℃、200 r/min条件下培养12 h。
1.2.2 摇瓶发酵
将活化后菌种按1%的接种量接种至100 mL的LB液体培养基中,加氨苄青霉素至终浓度为50 μg/mL,37℃、200 r/min条件下培养,取不同时间段培养液测定菌体浓度OD600,确定生长曲线。在对数期间内加入IPTG低温诱导培养一定时间,取菌液测定OD600,离心破碎测定酶活。
1.2.3 发酵罐发酵
1.5统计学方法采用SPSS19.0统计学软件处理数据。计量资料以均数±标准差(±s)表示,采用t检验;计数资料以率(%)表示,采用X2检验。P<0.05表示差异有统计学意义。
5 L发酵罐 (上海保兴生物设备工程有限公司)中装入2.0 L培养基,接种100 mL培养过夜的摇瓶培养液,加氨苄青霉素至终浓度为50 μg/mL,37℃发酵,初始转速600 r/min,初始通气流量为3 L/min,随着菌体OD600值而增加转速与通气流量,以维持溶氧值达20%以上。采用DO-Start模式[14]来流加500 g/L的葡萄糖与20 g/L的MgSO4·7H2O混合液,用28%氨水、1 mol/L的HCl调节pH值使其稳定在7.0。
1.2.4 酶活测定
酶活检测采用UV232法[15]。在1 mL缓冲液(50 mmol/L醋酸钠,5 mg/mL的肝素,pH 7.3)中加入50 μL粗酶液,于30℃水浴中反应10 min。反应结束后立即置100℃水浴中终止反应,12 000 r/min离心10 min,取上清液测232 nm处吸光值。计算公式:
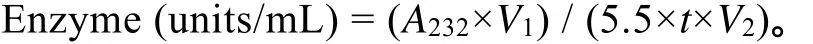
A232为232 nm处测定的紫外吸收值,V1为反应液的总体积;V2为加入酶液的体积;t为反应时间(min);根据酶活力定义:一个酶活力单位是指30℃、pH 7.0的条件下,在1 min内产生1 μmol具有△4,5不饱和糖醛酸键的寡糖片段的酶量,该△4,5不饱和糖醛酸寡糖片段的摩尔消光系数为5 500,生成物为1 μmol不饱和糖醛酸所需要的酶量为一个活力单位,所以吸光系数经过换算为5.5(μmol/mL)。
2 结果与分析
2.1 诱导条件优化
2.1.1 诱导时机对重组菌产酶的影响
前期实验结果表明该重组菌对数期OD600在0.5–3.8之间。选择对数生长期内的几个不同时期(OD600分别为 0.747、1.612、2.426、3.624),降温至20℃,分别加入诱导剂IPTG至终浓度为0.25 g/L,诱导培养10 h,检测菌体浓度并测定酶活。结果如图1A所示,对数生长前期诱导后酶活最高,此时菌体生长代谢旺盛,蛋白大量合成表达,外源蛋白也易于诱导表达,若诱导太晚,则菌体代谢开始降低,不利于外源蛋白的表达[16]。
2.1.2 诱导剂IPTG浓度对重组菌产酶的影响
此重组菌表达系统上带有乳糖基因(lac)启动子,需要IPTG作为诱导剂诱导外源蛋白的表达。当菌体浓度OD600为0.74时,分别加入不同量的诱导剂IPTG,20℃诱导培养10 h,检测菌体浓度并测定酶活。如图1B所示,随着IPTG浓度的增加,诱导结束后菌体的浓度OD600有略微的下降,表明IPTG对菌体的生长有一定的抑制作用。此外,IPTG浓度较低时,外源蛋白的表达水平随着诱导剂浓度的升高而不断升高;当浓度超过一 定限度时,蛋白表达水平又会受到影响。
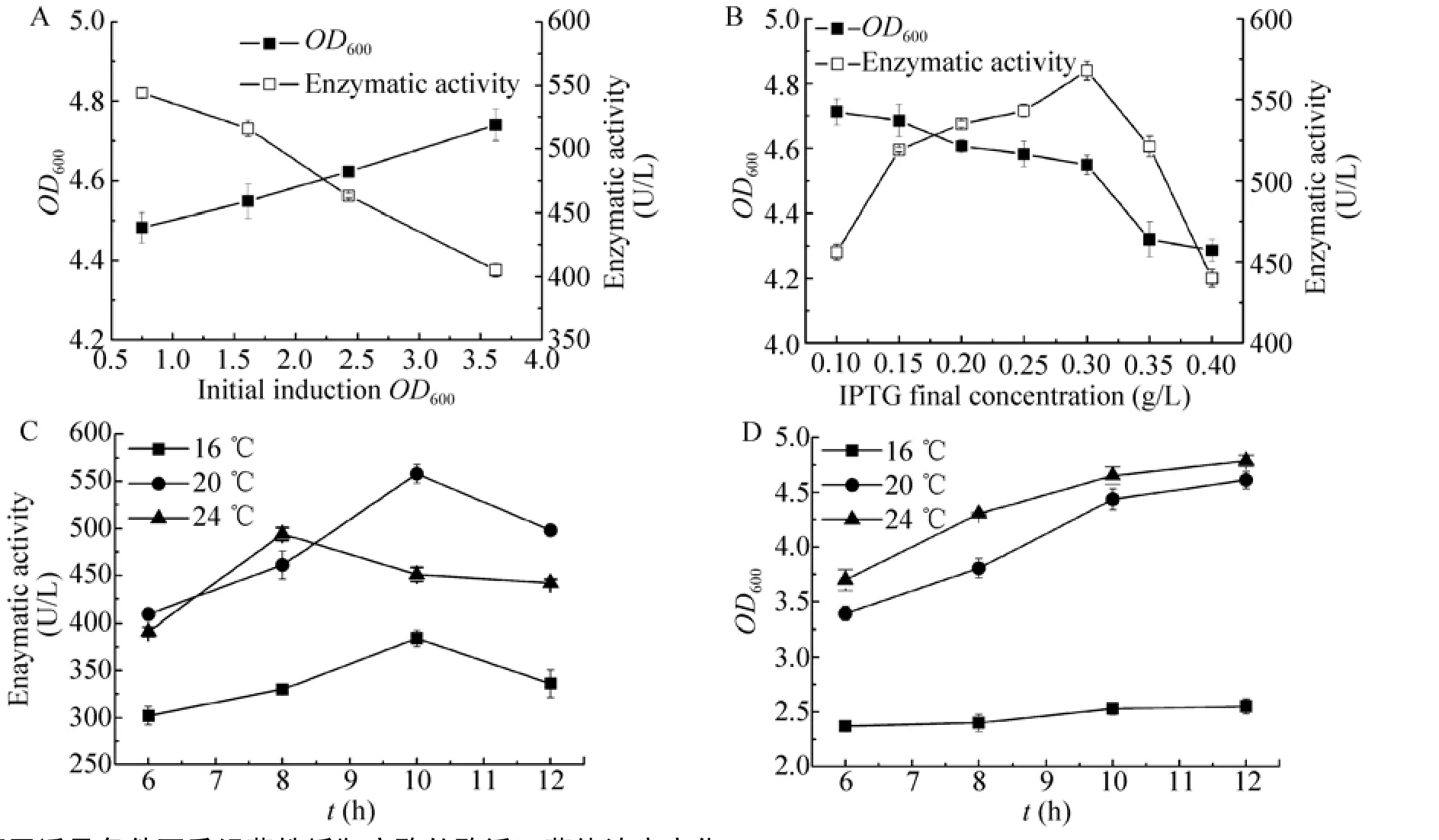
图1 不同诱导条件下重组菌株摇瓶产酶的酶活及菌体浓度变化Fig.1 Enzymatic activity of His-HepⅡand cell growth in flask culture of recombinant E.coli under different induction conditions.(A)Enzymatic activity and cell growth under different initial induction OD600.(B)Enzymatic activity and cell growth under different IPTG final concentration.(C)Enzymatic activity under different induction temperature.(D)Cell growth under different induction temperature.
2.1.3 诱导温度与诱导时间对重组菌产酶的影响
重组菌的诱导温度与诱导时间相关联,本实验对诱导温度与诱导时间对重组菌产酶的影响进行了综合考察。培养菌体浓度OD600为0.6–0.8,添加诱导剂IPTG至终浓度为0.3 g/L,分别于16℃、20℃、24℃诱导培养6–12 h,检测菌体浓度并测酶活。由图1C与1D可见,16℃下诱导不利于菌体生长,酶活也较低;20℃下诱导10 h酶活最高,为570 U/L;24℃下诱导8 h酶活较高,但酶活仍低于20℃下诱导的最高酶活。可见升高温度有利于菌体的生长代谢,而适度的低温有利于外源蛋白的可溶性表达,针对不同的目标采用不同的培养手段,有利于发酵水平的提高和发酵周期的缩短。
通过诱导条件的优化,发现37℃培养重组菌至对数生长前期,降温至20℃,添加诱导剂IPTG至终浓度为0.3 g/L,诱导培养10 h,酶活可达570 U/L,相比未优化前提高2倍多。
2.2 R培养基最佳碳氮源优化
高密度发酵是一种通过提高单位体积菌体密度从而提高重组酶的产量与酶活,降低生产成本的发酵方式[16]。本实验拟在前期研究基础上,选用R培养基作为高密度发酵的基础培养基,以高菌体浓度与高酶活为目标,考察R培养基中不同碳源和氮源对菌体生长量及酶活的影响。
2.2.1 碳源优化
分别以5–15 g/L的葡萄糖、蔗糖、甘油作为碳源,其他成分与R发酵培养基相同,采用以上优化的诱导条件进行诱导发酵产酶。其中以15 g/L的葡萄糖、10 g/L的甘油、15 g/L的蔗糖作为碳源时菌体生长最好 (图2A),且上述3种碳源培养菌体诱导发酵产酶的酶活分别为984 U/L、754 U/L和467 U/L。由此可见,葡萄糖组具有生长时间短,菌体浓度高,酶活表达量高等优点,故选取葡萄糖为后续发酵罐培养碳源。
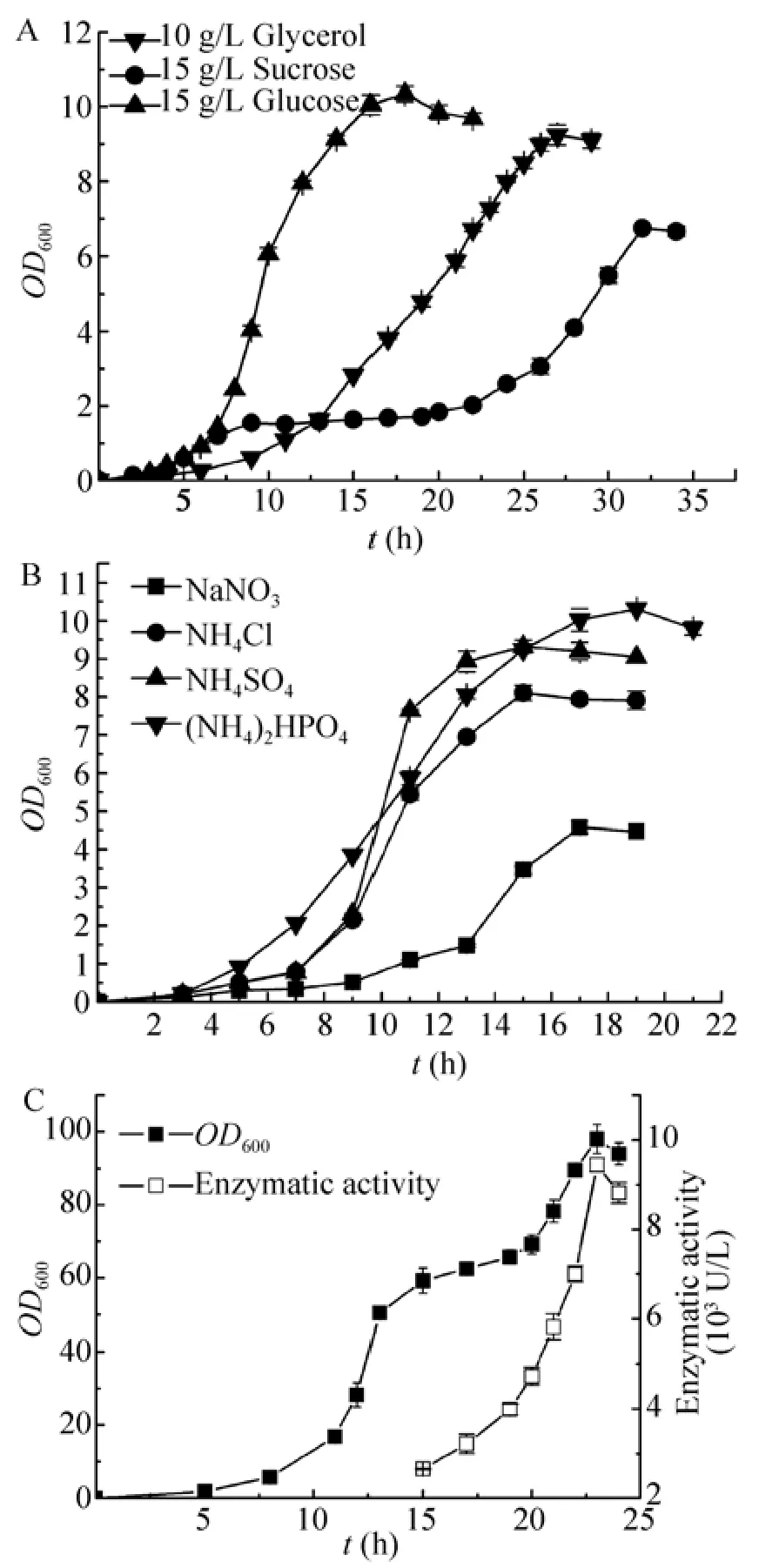
图2 R培养基中发酵优化Fig.2 Optimization of fermentation in R medium.(A)Carbon source.(B)Nitrogen source.(C)High cell density fermentation.
2.2.2 氮源优化
分别以7.6 g/L硝酸钠、5.0 g/L氯化铵、6.0 g/L硫酸铵、6.0 g/L磷酸氢二铵作为培养基氮源 (4种氮源中所含氮量相同,均为1.25 g/L),采用以上优化的条件进行诱导培养。其中以磷酸氢二铵作为氮源时菌体浓度最高 (图2B),且上述4种氮源培养菌体诱导发酵产酶的酶活分别为336 U/L、774 U/L、825 U/L和986 U/L,故取磷酸氢二铵为后续发酵罐培养碳源。
2.3 优化条件下重组菌的发酵罐高密度发酵
将LB培养基中最佳产酶条件与R培养基中最佳碳氮源优化结果相结合,进行发酵罐高密度发酵。37℃培养菌体13 h至对数生长前期,其OD600为50.5左右时,降低发酵液温度至20℃后,加入IPTG至终浓度0.3 g/L,诱导培养,每隔一段时间测量菌体浓度并测酶活。结果如图2C所示:诱导初期,重组菌适应新的生长环境,生长缓慢,但菌体已开始诱导产酶,酶活性有较大的增加;诱导培养6 h后,重组菌生长速度加快,酶活性增加的速度也加快;诱导培养10 h后,菌体浓度与酶活值均达到最高,菌体浓度OD600为98,比摇瓶发酵菌体浓度提高了近21倍,酶活为9 436 U/L,比摇瓶发酵提高了近16倍,酶活得到大幅提高,但相对单位菌体来说酶活有一定的降低。可能原因是高密度发酵过程中积累了一些抑制重组菌外源蛋白表达的有害代谢物,如乙酸[17-18]。乙酸的产生与细胞中电子传递和三羧酸循环有关,高密度发酵比生长速率高,重组菌通过氧化代谢产生的能量不能满足菌体合成与异化作用的需求,必须通过乙酸生成途径提供能量及相关酶,乙酸的过多积累会影响外源蛋白的表达,从而导致单位菌体酶活降低。
3 结论
文中在摇瓶体系中对黄杆菌肝素酶Ⅱ重组菌的诱导产酶条件进行了优化,并在此基础上进行了重组菌的发酵罐高密度培养,菌体浓度和酶活较摇瓶发酵分别提高了21倍和16倍,达到了较高的生产水准。该研究为HepⅡ的工业化生产与应用进一步奠定了基础。
[1]Ranga G,Ram S.A comparative analysis of theprimary sequences and characteristics of Heparinases I,II,and III from Flavobacterium heparinum.Biochem Biophys Res Commun,1996,229(3):770–777.
[2]Garg HG,Cindhuchao N,Quinn DA,et al.Heparin oligo-saccharide sequence and size essential for inhibition of pulmonary artery smooth muscle cell proliferation.Carbohydr Res,2002,337(21–23):2359–2364.
[3]Sasisekharan R,Moses MA,Nugent MA,et al.Heparinase inhibits neovascularization.Proc Natl Acad Sci USA,1994,91(4):1524–1528.
[4]Liu DF,Kevin P,Zachary S,et al.Use of heparinase III in cancer treatment and inhibition of tumor cell growth:WO,2001066772.2001-09-13.
[5]Hirsh J,AnandSS,Halperin JL,etal.Guideto anticoagulant therapy:heparin.Circulation,2001,103(24):2994–3018.
[6]Galliher PM,Cooney CL,Langer R,et al.Heparinase production by Flavobacterium heparinum.Appl Environ Microbiol,1981,41(2):360–365.
[7]Galliher PM,Linhardt RJ,Conway LJ,et al.Regulation of heparinase synthesis in Flavobacterium heparinum.Appl Microbiol Biotechnology,1982,15(4):252–257.
[8]Lohse DL,Linhardt RJ.Purification and characterication of heparin lyases from Flavobacterium heparinum.J Biol Chem,1992,267(34):24347–24355.
[9]Su H,Blain F,Musil RA,et al.Isolation and expression in Escherichia coli of hepB and hepC,genes coding for the glycosaminoglycan-degrading enzymes heparnaseⅡand heparinase III, respectively, from Flavobacterium heparinum. Appl Environ Bacteriol, 1996, 62(8):2723–2734.
[10]Fu WB,Yu X,Zhao J,et al.Cloning and expression of Flavobacteriunheparinum HeparinaseⅡ.Food Drug,2007,9(3):1–4(in Chinese).傅文彬,余晓,赵健,等.黄杆菌肝素酶Ⅱ的克隆与表达.食品与药物,2007,9(3):1–4.
[11]Blain F,Tkalec AL,Su H,et al.Expression system for high levels of GAG lyase gene expression and study of the hepA upstream region in Flavobacterium heparinum.J Bacteriol,2002,184(12):3242–3252.
[12]Xing XH,Li Y,Ye FC,et al.A method of heparinasesⅡfusion protein coding gene and expression: CN,201010259905.2010-08-20(in Chinese).邢新会,李晔,叶逢春,等.一种肝素酶Ⅱ融合蛋白及其编码基因与表达方法:CN,201010259905.2010-08-20.
[13]Liu Y,Chen JH,Chen J,et al.Effects of carbon sources and feeding strategieson heparosan production by Escherichia coli K5.Bioprocess Biosyst Eng,2012,35(7):1209–1218.
[14]Ram S,Mark B,Kelley WM,et al.Cloning and expression of heparinase I gene from Flavobacterium heparinum.Proc Natl Acad Sci USA,1993,90(8):3660–3664.
[15]Dae-Hyuk K,Nam SH,Kyung-Moo P,etal.Overproduction of Phytolacca insularis protein in batch and fed-batch of recombinant Escherichia coli.Process Biochem,2001,36(1):537–542.
[16]Shiloach J,Fass R.Growing E.coli to high cell density—a historical perspective on method development.Biotechnol Adv,2005,23(5):345–357.
[17]Lee SY.High cell-density culture of Escherichia coli.Trends Biotechnol,1996,14(3):98–105.
[18]Han K,Lim HC,Hong J.Acetic acid formation in Escherichia coli fermentation.Biotechnol Bioeng,1992,39(6):663–671.

