转popW基因烟草的构建及相关表型分析
王翠,刘红霞,曹静,王超,郭坚华
1南京农业大学植物保护学院植物病理学系,江苏 南京 210095
2江苏省生物源农药工程中心,江苏 南京 210095
3南京农业大学 农作物生物灾害综合治理教育部重点实验室,江苏 南京 210095
PopW蛋白是本实验室前期从青枯劳尔氏菌Ralstonia solanacearum ZJ3721中鉴定得到的一个39.79 kDa的新胞外蛋白[1],它同以前报道的harpin类物质具有相同的性质:酸性,富含甘氨酸和丝氨酸,缺少半胱氨酸,对热稳定,对蛋白酶敏感,能在非寄主植物烟草上引起过敏反应。通过前期研究,我们发现PopW是青枯劳尔氏菌中广泛存在的一个定位于寄主细胞壁上,受hrpB基因的调控,通过Ⅲ型泌出系统分泌到胞外,不影响菌株对寄主致病性的新harpin蛋白[2]。在前期试验中,我们发现原核表达的PopW蛋白能够诱导烟草对TMV产生抗性,同时,PopW蛋白还能促进烟草生长,提高烟草的品质,增加中、上等烟的比例[3]。在田间试验中,我们还发现PopW蛋白处理能增强番茄对叶霉病、水稻对稻曲病以及黄瓜对霜霉病的抗病性,并且能促进辣椒提前开花,增加黄瓜叶片中叶绿素的含量从而促进其生长,在提高黄瓜产量的同时增加果实中可溶性糖、可溶性蛋白、游离氨基酸及维生素C的含量,从而提高黄瓜的品质[4-6]。PopW蛋白在温室及田间都表现出了较好的防病、促生效果,在生产上具有较高的应用潜力,因此,我们对其原核表达的条件进行了优化,在温室的条件下探究了该蛋白使用的最佳浓度及持效期[4]。深入研究PopW蛋白的诱抗机制将对其在生产上的应用提供理论依据。
本研究将popW基因连接到植物表达载体上转化模式植物三生烟,以研究PopW蛋白在烟草体内表达是否和外源施用一样,可以诱导烟草的抗病性、促进烟草生长,为popW基因在烟草体内直接表达产生的效应及其机制提供研究基础。
1 材料与方法
1.1 材料
供试烟草品种为三生烟,于 (25±2)℃温室内培养,光周期为10 h/14 h(光/暗)。大肠杆菌TOP10,青枯劳尔氏菌ZJ3721、YN10,根癌土壤杆菌Agrobacterium tumefaciens EHA105以及双元载体pBI121均由本实验室保存。
Ex-Taq DNA聚合酶,rTaq DNA聚合酶,dNTPs,限制性内切酶BamHⅠ和XbaⅠ,核酸分子质量标准,DNA凝胶回收试剂盒、质粒抽提试剂盒等均购自爱思敬公司。T4 DNA连接酶购自Promega公司。引物由上海赛百盛生物公司合成。
1.2 植物表达载体的构建
以青枯劳尔氏菌ZJ3721的基因组DNA为模板克隆popW基因 (GenBank Accession No.EF080949),引物序列见表1[2],将其连接到双元载体pBI121上的BamHⅠ和XbaⅠ酶切位点之间构建成转基因重组体pB-popW(图1)。重组质粒经测序后,将测序序列与原始序列比对确认popW序列完全正确。将重组质粒用冻融发转化根癌土壤杆菌EHA105,经卡那霉素抗性筛选,以popW特异性引物对农杆菌的转化子进行菌落PCR验证,凡获得预期1 142 bp的特异性条带的菌落均被认为是阳性转化子。保存阳性克隆供转化烟草使用。
1.3 农杆菌介导的烟草遗传转化
采用叶盘法转化烟草。用含有pB-popW质粒的根癌土壤杆菌菌液侵染无菌烟草的叶圆片,侵染后在共生培养基 (MS+6-BA 1 mg/L)中25℃黑暗共培养,2−3 d后转入分化培养基(MS+6-BA 1 mg/L+Km 100 mg/L+Cp 500 mg/L)中分化培养。将长到1 cm以上的不定芽切下转入生根培养基中 (1/2 MS+Km 100 mg/L+IAA 0.2 mg/L)诱导生根,待根长好后将无菌小苗的瓶盖打开在25℃下炼苗2 d后移栽到盆钵中,放到 (25±2)℃温室培养。本实验中用作对照的转空载体烟草是用叶盘转化法转化不含有外源基因的pBI121质粒后获得。所有用于实验的转基因烟草植株均为T3代。
1.4 转基因烟草的分子鉴定
用CTAB法提取烟草基因组DNA,以popW和CaMV 35S启动子的特异性引物对转基因烟草进行PCR验证,引物序列见表1。
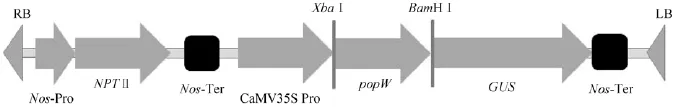
图1 植物表达载体pB-popW的结构示意图Fig.1 Construction of plant expression vector with popW.LB:left border;RB:right border;NPTⅡ:neomycin phosphotransferaseⅡ gene;Pro:promoter;Ter:terminator;GUS:β-glucuronidase gene.
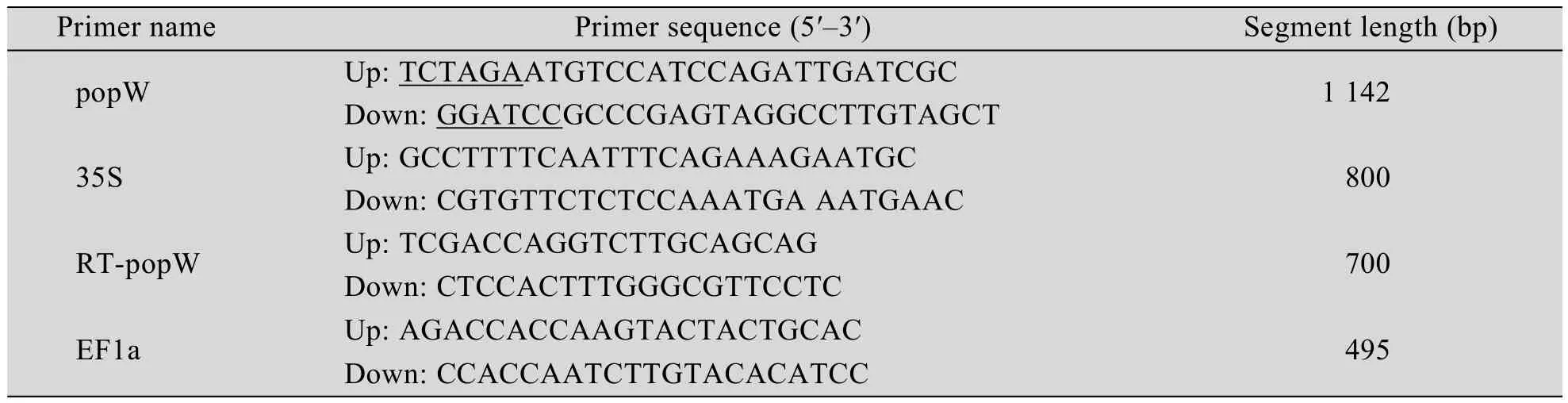
表1 PCR扩增所用的引物序列及参数Table 1 Sequence of PCR prmiers and relative characteristics
采用RT-PCR的方法鉴定烟草叶片中popW基因的表达情况。使用Trizol试剂 (Invitrogen)提取烟草叶片总RNA,进行RT-PCR(具体方法见PrimeScriptTM1st Strand cDNA Synthesis Kit(TaKaRa))分析基因表达量。以真核生物内保守表达的EF1a作为参照,RT-PCR产物用1%的琼脂糖凝胶电泳,溴化乙锭染色,利用凝胶分析系统 (Kodak Image Station 2000R,The Center for Integrated BioSystems,USA)对基因的表达量进行相对定量。
1.5 转基因烟草的GUS组织化学染色
采用Jefferson(1987)的染色方法[7],对转基因烟草进行GUS染色检测。将出芽后2周的烟草幼苗进行GUS染色,以野生型烟草和转空载体烟草植株作为对照。GUS染色阳性的组织呈现蓝色,阴性呈无色或白色。
1.6 转基因烟草的生长测定
将T2代转基因烟草种子表面消毒后铺于1/2 MS平板上培养,15 d后测定各株系植株的根长,并与野生型烟草和转空载体烟草植株进行比较。将测定完根长的幼苗移栽到穴盘中生长,30 d后从穴盘移栽至盆钵中,移栽至盆钵中60 d后测定烟草植株的各项生长指标。
1.7 转基因烟草对TMV的抗性测定
对移栽后6−7周的T3代烟草进行TMV抗性测定,采用摩擦接种法接种TMV[8]。每个株系接种12株烟草,每株接种中部3张完全展开的叶片,接种后的叶片用水轻轻冲洗后置于 (25±2)℃温室中培养[9],实验重复3次,以野生型三生烟和转空载体烟草作对照。接种72 h后调查叶片枯斑发生情况。抗病性表示为转基因植株与对照相比病斑个数减少的百分数,即:抗病效果 (%)=[(对照烟草叶片上的平均枯斑数-转基因烟草叶片平均枯斑数)/对照烟草叶片上平均枯斑数]×100%。
1.8 数据分析
实验数据采用DPS数据处理系统 (Data Processing System)中的Duncan’s新极复差法比较差异显著性,标有相同字母的平均数表示无显著差异 (P<0.05)。
2 结果与分析
2.1 转基因烟草的获得
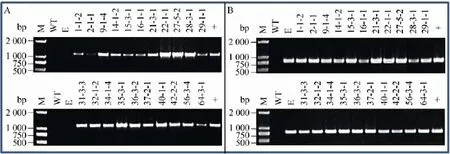
图2 转基因烟草植株的PCR检测Fig.2 PCR detection of transgenic tobacco plants.(A)PCR detection of transgenic tobacco plants with popW specific primer.(B)PCR detection of transgenic tobacco plants with 35S specific primer;M:DL2000 marker;WT:wild type tobacco plants;E:transformed vector plants;+:plasmid pB-popW as positive control;other lanes are transgenic tobacco plants.
以插入片段的特异性引物popW对根癌土壤杆菌的转化子进行菌落PCR检测,凡获得1 142 bp特异条带的菌落均被认为是阳性转化子。采用叶盘法将pB-popW质粒通过根癌土壤杆菌介导转化三生烟,转化烟草经过侵染、愈伤形成、产生不定芽、诱导生根等步骤,最终得到51个株系 (T0)的转popW基因烟草。通过繁殖和抗性筛选得到21个T3代纯合的转基因烟草株系用于本实验后续研究。
2.2 转基因烟草的PCR检测
提取转基因烟草叶片总DNA,根据目的基因popW设计特异引物进行PCR检测,检测结果表明,21个株系的T3代转基因烟草和阳性对照质粒pB-popW一样,均能扩增出1 142 bp的目的基因popW,而野生型烟草和转空载体烟草植株均没有扩增条带出现 (图2A)。同时,我们根据35S启动子序列设计引物对转基因烟草植株进行了PCR验证,结果显示,转基因烟草和转空载体烟草植株均能扩增出800 bp的预期大小的片段,而野生型烟草植株没有出现特异性条带 (图2B)。因此,无论是对目的基因popW还是对35S启动子的PCR检测结果都表明popW基因已经成功转入到烟草中。
2.3 转基因烟草中popW基因的RT-PCR分析
为了检测转基因烟草中popW基因是否表达,提取T3代转基因烟草叶片的总RNA进行了RT-PCR分析。结果表明,转基因烟草叶片中popW均有表达,且不同株系间表达量存在差异,其中 14-1-2、16-1-1、21-3-1、31-3-3、37-2-1和40-1-1叶片中的popW有较强的表达,而15-3-1、22-1-1、42-2-2和64-3-1表达量较低,同时在野生型以及转空载体烟草植株的叶片中均没有popW表达 (图3)。
2.4 转基因烟草的GUS染色

图3 转基因烟草的RT-PCR分析Fig.3 RT-PCR analysis of transgenic tobacco.WT:wild type tobacco plants;E:transformed vector plants;other lanes are transgenic tobacco plants.
对出芽后2周的烟草幼苗进行GUS组织化学染色分析,以检测转基因烟草中目的基因的表达情况。经GUS染色液染色,70%乙醇脱色后显示,转基因烟草叶部和根部都出现了蓝色阳性反应,而野生型三生烟则为白色 (图4)。这表明带有GUS基因的转基因重组载体已经转化到烟草中,并且在烟草的不同部位均可以正常表达,但在不同株系中表达量不同,其中14-1-2、16-1-1、21-3-1、31-3-3、37-2-1、40-1-1、42-2-2具有较强的GUS活性,32-1-2、34-1-4、64-3-1的GUS活性较低,而在22-1-1、28-3-1、35-3-1中未检测到肉眼可见的GUS活性 (图片未显示),结合RT-PCR的结果分析可能是因为在这3个转基因烟草株系中popW的表达量极低,导致肉眼不可见。
2.5 转基因烟草的生长测定
为了比较转基因烟草与野生型烟草在生长上的差异,我们对转基因烟草的整个生育期进行了观察,并测定了移栽后60 d的各项生长指标。T2代转基因烟草的种子在1/2 MS培养基上生长15 d后,除15-3-1、35-3-1以外,其他株系的根长均显著长于野生型烟草植株,其中16-1-1、32-1-2、22-1-1的根长分别为野生型的1.7、1.6、1.4倍 (图5)。转基因烟草在整个生育期都能够正常生长且在形态上与野生型烟草没有差异,移栽60 d后,除9-1-4、16-1-1以外,其他株系的株高、鲜重和干重均大于野生型烟草植株,22-1-1、37-2-1等8个株系的三项指标均显著大于野生型烟草,其中22-1-1的株高、鲜重和干重分别达野生型烟草的1.4、1.7、1.8倍 (图6)。

图4 转基因烟草的GUS染色分析Fig.4 GUS staining of transgenic tobacco.WT:wild type tobacco plants;E:transformed vector plants;others are transgenic tobacco plants.
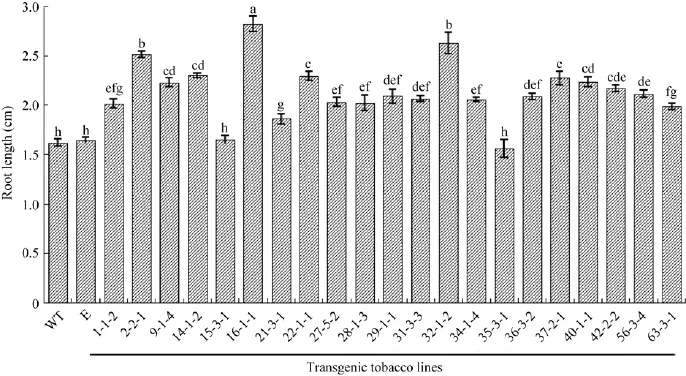
图5 转基因烟草种子在1/2 MS培养基上生长15 d后的根长Fig.5 Root length of transgenic tobacco seedlings 15 days afer sown in 1/2 MS medium.WT:wild type tobacco plants;E:transformed vector plants;others are transgenic tobacco plants.
2.6 转基因烟草对TMV抗性测定
对生长6−7周的T3代转基因烟草植株进行TMV接种,接种48 h后接种叶片上出现坏死斑(图7C),接种TMV 72 h后对接种叶片上的病斑进行统计发现,除9-1-4以外,其他转基因烟草叶片上的病斑数均少于野生型以及转空载体烟草植株 (图7A,B)。其中有16个株系的转基因烟草植株对TMV的抗病性显著强于野生型烟草,抗病性最强的株系31-3-3叶片上的病斑数仅为野生型烟草的0.46倍,防效达54.25%(图7A,C)。
3 讨论
Harpin蛋白是革兰氏阴性植物病原细菌hrp(Hypersensitive response and pathogenicity)基因编码的,通过Ⅲ型泌出通道分泌的一类效应蛋白[10]。在非寄主上使用Harpins,可引起植物产生多种有益反应,如提高作物的抗病、抗虫能力,促进植物生长和增强植物的抗逆性等[11-17],同时研究发现转编码harpin蛋白基因的作物对干旱胁迫表现出较高的耐受性[18]。尽管harpin蛋白有着上述诸多的功能,但目前只有美国Eden公司的messenger(HarpinEa)得到产业化应用,并且人们对harpin蛋白的作用位点及抗病机理也知之甚少,还有待进一步的深入研究。本实验室前期从青枯劳尔氏菌ZJ3721中鉴定得到的PopW蛋白具有其他harpin蛋白所共有的生物活性,能诱导烟草产生由水杨酸信号通路激发的系统获得抗性(SAR)[1-2],并且通过亚细胞定位实验发现PopW蛋白定位于植物的细胞壁上。Li和Fan[19]报道,在马铃薯中表达的harpinEa,无论hrpN基因前加或不加信号肽,即harpinEa不论是位于细胞内还是细胞外,均可以诱导马铃薯对晚疫病的抗性。这很可能是因为harpins在植物中的作用位点不只一个,由于作用位点不同,激发的信号通路也不同[1]。
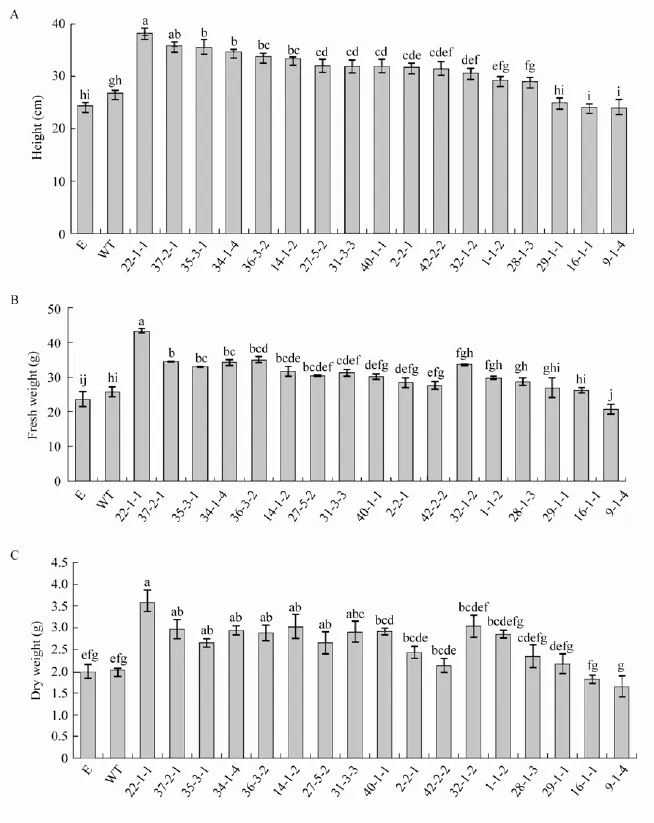
图6 转基因烟草移栽后60 d的生长测定Fig.6 Growth assay of transgenic tobacco plants 60 days after transplanting to pots.Plant height(A),fresh weight(B)and dry weight(C)of transgenic tobacco plants 60 days after transplanting to pots.WT:wild type tobacco plants;E:transformed vector plants;others are transgenic tobacco plants.
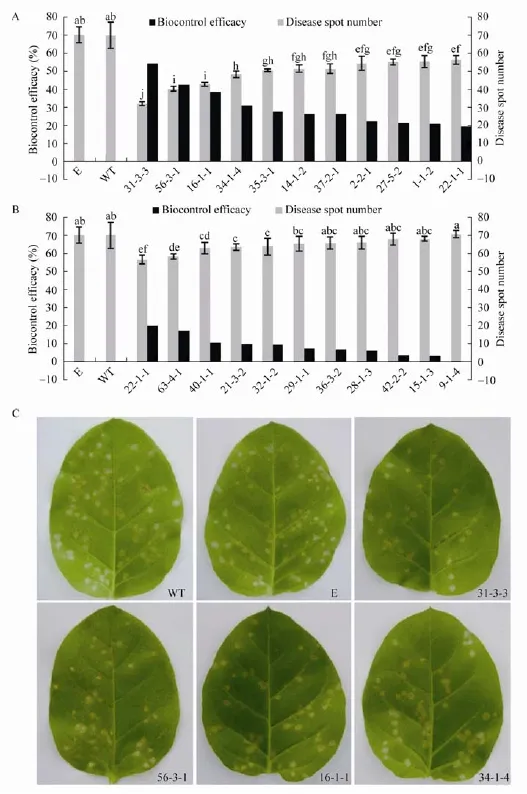
图7 转基因烟草对TMV的抗病测定Fig.7 Resistance detection of transgenic tobacco plants to TMV.(A–B)Disease spot number and biocontrol efficacy of transgenic tobacco 72 h after inoculation with TMV.(C)Symptom of resistant transgenic tobacco against TMV(leaves photographed 72 h after inoculation with TMV;WT:wild type tobacco plants;E:transformed vector plants;others are transgenic tobacco plants.
在本研究中,我们采用农杆菌介导的叶盘转化法转化烟草叶片,获得51株转popW基因烟草,由于在生长过程中管理不善最终仅获得32株转基因烟草的种子,对获得的烟草种子进行卡那霉素抗性筛选,通过PCR验证、RT-PCR分析最终获得21个株系的T3代转popW基因烟草(图2和图3)。PCR及RT-PCR分析的结果表明,外源基因已成功插入烟草基因组并进行了转录,但不同株系在转录水平上存在较大差异 (图3),这可能是因为不同的转基因植株中外源基因的拷贝数不同,并且整合位点是随机的[20-21]。我们对PCR分析为阳性的21个转基因烟草株系进行GUS染色,以检测目的蛋白的表达情况,结果发现并不是所有的转基因烟草都有肉眼可见的GUS活性,这可能是因为目的蛋白在这些株系中表达量极低,未达到GUS组织化学染色可检测的最低量[22-23]。将RT-PCR分析及GUS染色的结果进行比较,我们发现popW在转录水平和翻译水平并不完全一致,其中42-2-2在转录水平仅有微弱的表达却有较高的GUS活性,而22-1-1、28-3-1、32-1-2、34-1-4、35-3-1的转录并不是最低却只检测到微弱甚至未检测到GUS活性,这可能是因为蛋白的表达水平不仅跟转录有关,还受翻译和翻译后修饰等过程中多个因素的影响[24]。在对转基因烟草的生长测定和抗病性测定中我们发现大多数转基因烟草的生物量都有所增加同时增强了对TMV的抗性 (图6和图7)。然而,转popW基因后对烟草的促生及抗病效果与RT-PCR、GUS染色的结果并没有相关性 (图3和图4),这是因为转基因植物中外源基因的表达及其功能的发挥是受多方面因素影响的,如目的基因的拷贝数、插入位点等[20-21]。
转popW基因能促进烟草的生长同时增强烟草对TMV的抗性,这与体外施用PopW蛋白的结论一致[1-7]。Xu等[25]的报道表明,过表达harpinXoo增强了菊花对黑斑病的抗性,并且能促进菊花的生长;与这一结果类似,转hrf2基因油菜增强了对菌核病的抗病性,同时提高了油菜的农艺性状,增加了油菜的产量[26]。
此外,与野生型三生烟相比,转基因烟草对青枯病的抗病性也有所增强,一些转基因烟草如1-1-2、34-1-4等在接种病原菌后会快速产生活性氧爆发及细胞死亡 (另文发表),这表明popW基因的表达可能缩短了烟草对病原菌的反应时间,从而赋予植物抗病的能力。在今后的研究中我们将选出具有显著表型的株系对转基因烟草的抗病、促生机制进行进一步的解析。在实验过程中,我们还发现与野生型烟草相比转基因烟草对H2O2的耐受性有所增强,在含有一定浓度H2O2的MS平板上转基因烟草的幼苗可以正常生长,而野生型烟草的生长却受到了抑制,转popW基因烟草抗氧化的机理也是我们今后研究的重点之一。
[1]Li JG.Characterization and evaluation of biological and diseaseresistantfunction ofPopW from Ralstonia solanacearum [D].Nanjing:Nanjing Agricultural University,2009(in Chinese).李建刚.青枯劳尔氏菌PopW蛋白生物学特性及其抗病功能研究[D].南京:南京农业大学,2009.
[2]Li JG,Liu HX,Cao J,et al.PopW of Ralstonia solanacearum,a new two-domain harpin targeting the plant cell wall.Mol Plant Pathol,2010,11(3):371–381.
[3]Li JG,Cao J,Sun FF,et al.Control of tobacco mosaic virus by PopW as a result of induced resistance in tobacco under greenhouse and field conditions. Phytopathology, 2011, 101(10):1202–1208.
[4]Cao J. Effect of PopW from Ralstonia solanacearum on inducing plants disease resistance and obtaining of transgenic tobacco expressing popW [D]. Nanjing: Nanjing Agricultural University,2011(in Chinese).曹静.青枯菌PopW蛋白诱导植物抗病功能研究及其转基因烟草的构建[D].南京:南京农业大学,2011.
[5]Zheng L,Luo YM,Xue QY.Control and growth promotion of PopW to cucumber downy mildew under greenhouse and field conditions.Acta Phytopathol Sin,2013,43(2):179–186(in Chinese).郑丽,罗玉明,薛庆云.PopW蛋白对黄瓜霜霉病的防病促生作用.植物病理学报,2013,43(2):179–186.
[6]Zheng L. The biological control study of cucunmber downy mildew by Pseudoperonospore cubensis [D]. Nanjing: Nanjing Agricultural University,2012(in Chinese).郑丽.黄瓜霜霉病的生物防治研究初探[D].南京:南京农业大学,2012.
[7]Jefferson RA,Kavanagh TA,Bevan MW.GUS fusions:beta-glucuronidase asa sensitive and versatile gene fusion marker in higher plants.EMBO J,1987,6(13):3901–3907.
[8]Fang ZD.Methods in Plant Disease Research.3rd.Beijing:China Agriculture Press,1998:261–264(in Chinese).方中达.植病研究方法.3版.北京:中国农业出版社,1998:261–264.
[9]Wang FD,Feng GH,Chen KS.Burdock fructooligosaccharide induces resistance to tobacco mosaic virus in tobacco seedlings.Physiol Mol Plant Pathol,2009,8:1–7.
[10]Alfano JR,Collmer A.The typeⅢ(Hrp)secretion pathway of plant pathogenic bacteria:Trafficking harpins,Avr proteins,and death.J Bacteriol,1997,179(18):5655–5662.
[11]Wei ZM,Qiu D,Kropp MJ,et al.Harpin,an HR elicitor,actives both defense and growth systems in many commercially important crops.Phytopathology,1998,88:91–96.
[12]Strobel RN,Gopalan JS,Kuc JA,et al.Induction of systemic acquired resistance in cucumberby Pseudomonas syringae pv.syringae HrpZpss protein.Plant J,1996,9:431–439.
[13]Dong H,Delaney TP,Beer SV.Harpin induces disease resistance in Arabidopsis through the systemic acquired resistance pathway mediated by salicylic acid and the NIM1 gene.Plant J,1999,20(2):207–215.
[14]Li WQ,Shao M,Zhong WG,et al.Ectopic expression of Hrf1 enhances bacterial resistance via regulation of diterpene phytoalexins,silicon and reactive oxygen species burst in rice.Plos one,2012,7(9):1–10.
[15]Pavli OI,Kelaidi GI,Tampakaki AP,et al.The hrpZ gene of Pseudomonas syringae pv.phaseolicola enhances resistance to rhizomania disease in transgenic Nicotiana benthamiana and sugar Beet.PloS one,2011,6(3):1–9.
[16]Peng JL,Bao ZL,Ren HY,et al.Expression of HarpinXooin transgenic tobacco induces pathogen defense in the absence of hypersensitive cell death.Phytopathology,2004,94(10):1048–1055.
[17]Sang SL,Li XJ,Gao R,et al.Apoplastic and cytoplasmic location of harpin protein Hpa1Xooplaysdifferentrolesin H2O2generation and pathogen resistance in Arabidopsis.Plant Mol Biol,2012,79:375–391.
[18]Zhang L,Xiao SS,Li WQ,et al.Overexpression of a Harpin-encoding gene hrf1 in rice enhances droughttolerance.JExp Bot,2011,62(12):4229–4238.
[19]Li RG,Fan YL.Reduction of lesion growth rate of late blightplantdisease in transgenic potato expressing harpin protein.Sci China Ser C,1999,42(1):96–101.
[20]Oh SJ,Jeong JS,Kim EH,et al.Matrix attachment region from the chicken lysozyme locus reduces variability in transgene expression and confers copy number-dependence in transgenic rice plants.Plant Cell Rep,2005,24:145–154.
[21]Gambino G,ChitarraW,Maghuly F,etal.Characterization of T-DNA insertions in transgenic grapevines obtained by Agrobacterium-mediated transformation. Mol Breeding, 2009, 24(3):305–320.
[22]Li N,Du XZ,Pan XZ,et al.Study on the transgenic tobacco expressing truncated wheat cold shock protein gene TA3-13 and analysis of disease resistance.Hereditas,2011,33(5):520–526(in Chinese).李娜,杜秀贞,潘小玫,等.转小麦冷胁迫蛋白截短基因烟草及其抗病性分析.遗传,2011,33(5):520–526.
[23]Deng XM,Zhou GY.Transgenic tobacco plants obtained by introduction of exogenous gus report gene and tissue specific expression of GUS.Acta Agri Shanghai,1966,12(4):85–87(in Chinese).邓晓梅,周根余.gus基因导入烟草获得转基因植株及其组织特异性表达.上海农业学报,1996,12(4):85–87.
[24]Fischer U,Kuhlmann M,Pecinka A,et al.Local DNA features affect RNA-directed transcriptional gene silencing and DNA methylation.Plant J,2008,53:1–10.
[25]Xu GJ,Chen SM,Chen FD.Transgenic chrysanthemum plants expressing a harpinXoogene demonstrate induced resistance to alternaria leaf spot and accelerated development.Russ J Plant Physiol-Engl Tr,2010,57(4):548–553.
[26]Huo R,Wang Y,Ma LL,et al.Assessment of inheritance pattern and agronomic performance of transgenic rapeseed having harpinXooc-encoding hrf2 gene.Transgenic Res,2010,19:841–847.

