含迷迭香的蛋白基薄膜对高氧气调包装生鲜猪肉的护色及抗氧化作用
李大虎,应丽莎,程玉娇,张 敏*
(西南大学食品科学学院,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆市特色食品工程技术研究中心,重庆 400715)
含迷迭香的蛋白基薄膜对高氧气调包装生鲜猪肉的护色及抗氧化作用
李大虎,应丽莎,程玉娇,张 敏*
(西南大学食品科学学院,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆市特色食品工程技术研究中心,重庆 400715)
以不同质量浓度迷迭香与大豆分离蛋白复合制备活性蛋白膜,并将该蛋白膜用于高氧气调下生鲜猪肉的护色保鲜。分析猪肉贮藏期间CIE a*值、正铁肌红蛋白、硫代巴比妥酸反应(thiobarbituric acid reactive substances,TBARS)值、蛋白质羰基及肉品硬度的变化情况。结果表明:肉样表面喷洒0.05 g/100 mL迷迭香提取物有效抑制了高氧气调包装肉品的脂类氧化和贮藏后期的颜色劣变。而蛋白膜加入不同质量浓度迷迭香对高氧气调包装的猪肉表现出不同的抗氧化活性。纯蛋白膜和0.025 g/100 mL迷迭香包装组对猪肉没有表现出护色作用,但对猪肉贮藏期间脂类和蛋白质的氧化起到了一定的抑制作用;0.1、0.2 g/100 mL迷迭香包装组有效延缓了猪肉a*值的下降和正铁肌红蛋白、TBARS值的生成,且其对猪肉的护色效果好于迷迭香直接喷洒处理,但无法抑制蛋白质羰基的形成。而0.05 g/100 mL迷迭香包装组在整个贮藏期间对猪肉颜色、脂类、蛋白质等的抗氧化效果均好于迷迭香直接喷洒处理,且基本维持了肉品贮藏期间的硬度,这表明蛋白膜对迷迭香的包埋显著提高了迷迭香对高氧气调下猪肉的抗氧化活性。
迷迭香;大豆分离蛋白;高氧气调;抗氧化;猪肉
颜色是生鲜猪肉最重要的外观属性之一,直接影响消费者的购买欲望[1]。肉品在没有腐败的情况下颜色也会变暗、变褐,导致销售困难,给生产厂家和销售商造成巨大的经济损失[2]。高氧气调包装通常应用于生鲜肉品使肉品呈现吸引人的红色,但高体积分数氧气也会促使肉品色素、脂类等发生氧化反应,导致肉品品质劣变[3]。天然植物提取物如迷迭香被认为是一种天然高效的抗氧化剂,主要通过提供氢离子中断脂肪自动氧化的自由基反应链。迷迭香对肉品的抗氧化作用已被广泛报道[4-7]。目前,迷迭香等抗氧化剂的添加方式主要采用与肉制品直接混合或配成溶液对肉品进行喷洒、浸渍等处理,然而直接添加可能导致迷迭香与食品成分发生中和及分解等一系列复杂反应从而很快被消耗殆尽,喷洒或浸渍处理则会使迷迭香从表面扩散进入食品内部,导致食品表面有效质量浓度降低,活性下降,这对于表面不致密的食品如新鲜肉品而言尤为突出[8],大大降低了迷迭香对肉品表面的抗氧化效用。
为了改善传统添加方式导致的迷迭香抗氧化作用的降低,一种新型的贮藏方式如活性包装能有效增强迷迭香对生鲜猪肉抗氧化作用的有效性和持续性。活性包装指的是包装材料内加入抗菌剂或抗氧化剂等活性物质使材料能积极作用于食品或包装内环境[9],起到维持或提高食品品质的目的。当前,众多研究集中于活性材料的制备及性能表征[10-12],仅有少量研究报道了活性薄膜在食品中的运用。de Abreu等[9]报道聚乙烯薄膜涂覆抗氧化剂延缓了鲨鱼冷冻贮藏期间的脂类水解,并增加了其抗氧化稳定性。Wu等[13]发现聚乙烯醇-淀粉膜掺杂儿茶素抑制了牛肉的脂类氧化。Nerín等[14]也报道,将不同质量浓度的迷迭香固定在聚丙烯薄膜,有效延缓了高氧气调包装的牛肉(metmyoglobin,MetMb)和硫代巴比妥酸反应(thiobarbituric acid reactive substances,TBARS)值的形成,且该活性薄膜对肉品的抗氧化作用达到了迷迭香直接添加的作用效果。
近几年,随着对环保包装材料的迫切需求,可降解生物聚合物材料如蛋白质类越来越受到研究者的普遍关注。大豆分离蛋白作为一种应用较为广泛的蛋白质原料,具有优秀的成膜能力,且价格低廉。相比于其他植物蛋白,由大豆分离蛋白制备的薄膜具有更好的柔韧性、光滑度、水溶性和清晰度[15]。本研究者利用大豆分离蛋白掺杂迷迭香制备活性蛋白膜,探索蛋白膜对高氧气调下生鲜猪肉颜色变化和抗氧化稳定性的影响,为评估迷迭香活性包装对猪肉的护色及抗氧化效果及其在食品工业等领域的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
猪通脊肉 市购;迷迭香粉末 海南舒普生物科技有限公司;大豆分离蛋白(>85%) 北京奥博星生物技术有限责任公司。
乙酸乙酯、丙三醇、2,4-二硝基苯肼、三氯乙酸、硫代巴比妥酸(均为分析纯) 成都科龙化工试剂厂;丙二醛二乙缩醛、盐酸胍(均为分析纯) 北京大田丰拓化学技术有限公司。
1.2 仪器与设备
MAP-500D袋式气调包装机 上海一恒科学仪器有限公司;GL-20G-Ⅱ高速冷冻离心机 上海安亭科学仪器厂;1-15 PK冷冻离心机 德国Sigma公司;5810台式高速离心机 德国Eppendorf公司;UV-2450PC紫外-可见分光光度计 日本岛津公司;PHS-3C pH计 上海精科有限公司;JJ-1精密增力电动搅拌器常州博远实验分析仪器厂;TA.XT2i物性测定仪 英国Stable Micro System 公司;UltraScan®PRO测色仪 美国HunterLab公司。
1.3 方法
1.3.1 蛋白基薄膜制备
大豆分离蛋白溶液参照Cho等[15]方法制备。将5 g大豆分离蛋白缓慢溶解于100 mL蒸馏水中,分别加入1.25 g甘油和山梨醇,充分搅拌,用NaOH溶液调整该混合体系pH值为10,然后置于70 ℃水浴中加热搅拌30 min。迷迭香用无水乙醇溶解加入到成膜溶液中,配成迷迭香质量浓度分别为0、0.025、0.05、0.1、0.2 g/100 mL的5 组成膜溶液,分别记为spi、sr250、sr500、sr1000、sr2000。取一定量膜液流延于聚丙烯塑料板上,置于室温条件下干燥过夜。揭膜后于50%相对湿度环境中保存,备用。选取厚度为(62.22±6.48) mm的薄膜用于实验。
1.3.2 肉样制备
将猪通脊肉剔除可见脂肪,用无菌手术刀切成1.5 cm厚的肉排,暴露在空气中1 h(4 ℃)使其充分熟化[16]。对部分肉样表面喷洒0.05 g/100 mL迷迭香提取物(记为r500),其余样品用含不同迷迭香质量质量浓度的大豆蛋白膜包裹,对照组样品(记为Con)不作处理。
所有肉样均置于18.5 cm×11.5 cm×2.5 cm的聚苯乙烯塑料托盘内,用0.1 mm厚的聚酰胺-聚乙烯复合袋进行80% O2/20% CO2气调包装,顶空与内容物比率为1∶1[17]。最后,将样品放置在超市标准荧光灯下于4 ℃贮藏12 d,每3 d取样进行分析。
1.3.3 指标测定
1.3.3.1 表面颜色测定
参照Rubio等[18]方法。根据CIE L*a*b*颜色标准采用色差仪于室温条件下测得。使用D65照明光源,10°标准观察角。每个样品取上表面均匀分布的6 处不同位置进行测量并求其平均值。同时用式(1)计算肉品的色相(Hue):

1.3.3.2 MetMb含量测定
参照Krzywicki[19]方法。MetMb用冷的0.04 mol/L、pH 6.8的磷酸盐缓冲液提取,样品和缓冲液的比例为1∶10。样品匀浆以50 000×g离心30 min(5 ℃),吸取上清液在525、545、565、572 nm波长处测其吸光度。不同形态肌红蛋白所占百分比由公式(2)、(3)得出[19]:
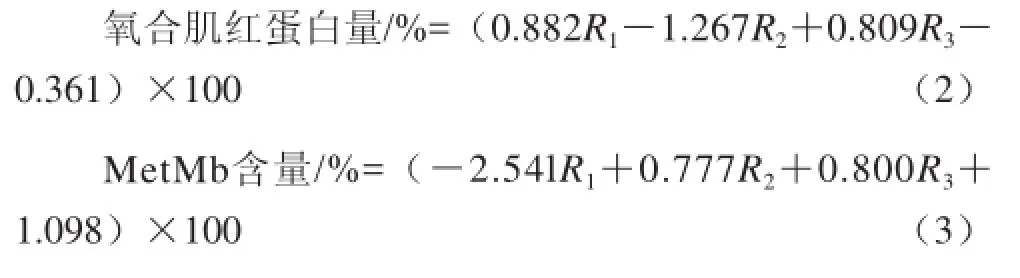
式中:R1、R2和R3分别是吸光度比值A572nm/A525nm、A565 nm/A525 nm和A545 nm/A525 nm。
1.3.3.3 脂肪氧化测定
参照Sørensen等[20]方法。检测猪肉脂肪氧化的次级产物丙二醛的含量。取5 g肉样加入到15 mL 7.5%三氯乙酸溶液中充分混匀,过滤。滤液与同体积0.02 mol/L硫代巴比妥酸混合,100 ℃水浴40 min,用流动的自然水冷却至室温。取上清液在532 nm波长处比色。用丙二醛二乙缩醛作丙二醛标准曲线,由曲线可得出样品的TBARS值。
1.3.3.4 蛋白质氧化测定
参照Oliver等[21]方法。取1 g猪肉在磷酸盐缓冲液中高速匀浆,移取两份等量提取液分别与20%三氯乙酸反应。其中一份用0.2%二硝基苯肼处理,另一份用2 mol/L HCl作空白对照。体系置于25 ℃水浴反应30 min,再加1 mL三氯乙酸,冷冻高速离心15min,弃上清液。沉淀经乙醇-乙酸乙酯(1∶l,V/V)洗涤3 次后溶解于6 mol/L盐酸胍溶液中,于370 nm波长处测定其吸光度。总蛋白质含量通过测定HCl空白组在280nm波长处的吸光度,并以牛血清白蛋白作标准曲线计算可得。结果用每毫克蛋白质中含有与二硝基苯肼结合的蛋白浓度表示。
1.3.3.5 硬度的测定
参照Martinez等[22]方法。采用物性仪对肉样进行压缩实验,测试使用直径5 mm的不锈钢圆柱形探头,测前、测中和测后速率分别为2、1、5 mm/s,压缩比为50%,2 次下压时间间隔为5 s,测试时力的方向与肌纤维方向垂直。
1.4 数据分析
使用SPSS 13.0软件对各指标进行单因素方差分析。
2 结果与分析
2.1 表面颜色变化
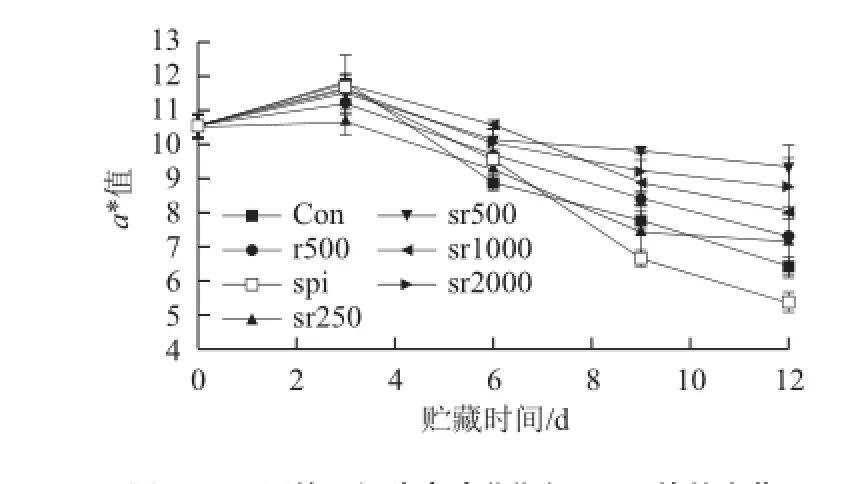
图1 不同处理组猪肉冷藏期间CIE a*值的变化Fig.1 Changes in CIE a* in fresh pork with different treatments during chilled storage
如图1所示,对照组肉品在贮藏前3 d a*值显著增加(P<0.01),这是由于猪肉的肌红蛋白在高氧环境中与O2结合生成了亮红色的氧合肌红蛋白,Martinez等[23]也报道80% O2能显著增加香肠贮藏前期的a*值。但是,高氧气调包装的肉品到贮藏后期颜色会发生急剧褐变。本实验中对照组肉品在第9天a*值已降到8以下,而r500处理组从第9天开始a*值明显大于对照组(P<0.05),说明迷迭香的添加有效改善了高体积分数氧气在贮藏后期引发的氧化问题。但是,喷洒在肉品表面迷迭香由于其反应消耗或扩散行为,随着贮藏时间的延长其有效质量浓度逐渐降低,而将一定量迷迭香包埋于大豆分离蛋白薄膜中,可以实现迷迭香的缓慢释放或在薄膜内部的持续作用。由图1可知,spi和sr250两组没有表现对高氧气调下生鲜猪肉的护色作用,而且,纯蛋白膜包裹加速了肉品贮藏后期颜色的劣变(P<0.01),这可能是由于蛋白膜对氧气有一定的阻隔能力,且低质量浓度迷迭香加入到蛋白质中对蛋白膜结构的影响较小,故spi和sr250两组降低了猪肉表面的氧分压,不利于猪肉颜色的稳定。而sr500、sr1000和sr2000三组从第6天开始a*值明显大于对照组(P<0.01),其中sr500和sr2000两组从第9天开始对猪肉的作用效果明显好于r500(P<0.01),到贮藏末期两组肉品的a*值仍维持在9以上。本实验中r500为高氧气调下迷迭香对生鲜猪肉的最佳抗氧化质量浓度(由前期实验得出)。这说明大豆蛋白薄膜中适量包埋迷迭香能显著增加迷迭香对猪肉的护色效果。Nerín等[14]指出迷迭香活性薄膜包装延缓了高氧气调下牛肉a*值的下降,但活性薄膜对肉品颜色的抗氧化作用并不依赖于迷迭香的质量浓度,这与本实验的结果相似。
2.2 MetMb含量的变化
由图2可知,各组猪肉MetMb的含量均随贮藏时间的延长而增加(P>0.05),迷迭香喷洒处理从第6天开始有效延缓了猪肉MetMb的形成(P<0.05),纯蛋白膜包裹的肉品在前6 d有较低的MetMb含量,之后急剧增加,到第9天MetMb值已接近55%,这与图1所示spi处理组肉品到第9天a*值的迅速降低相一致,表明纯蛋白膜包裹促使猪肉在贮藏后期发生严重褐变。而蛋白膜包埋不同质量浓度迷迭香对猪肉贮藏期间MetMb的形成产生了不同的作用效果。sr250并没有表现出对MetMb的抑制作用,相反,sr250处理组肉品在前3d MetMb值明显大于对照组(P<0.01)。而sr500、sr1000和sr2000三个处理组则显示出蛋白膜与迷迭香的协同作用,这3组肉品在整个贮藏期间MetMb含量均低于迷迭香直接喷洒处理的肉品(P>0.05),其中sr500处理组从第6天开始MetMb值明显低于r500(P<0.01),而sr2000和sr1000分别在第9天和第12天与r500处理组表现出明显差异(P<0.01)。这说明迷迭香活性薄膜对MetMb的抗氧化能力与迷迭香的质量浓度并不成比例,Nerín等[14]利用聚丙烯和迷迭香共挤制备活性薄膜,发现该活性薄膜对牛肉MetMb的抑制作用并不依赖于薄膜中添加的迷迭香质量浓度。而Camo等[24]采用涂覆方式得到的活性薄膜对肉品MetMb的抑制作用随薄膜中牛至属提取物含量的增加而增大。这可能是因为制膜方式、活性成分、成膜载体等均会影响活性薄膜的结构,从而使薄膜内活性成分的行为方式受到影响,而薄膜的最佳抗氧化效果体现在活性成分对自由基的一个恰当的清除速率。

图2 不同处理组猪肉冷藏期间MetMb含量的变化Fig.2 Changes in metmyoglobin content in pork with different treatments during chilled storage
2.3 脂肪氧化
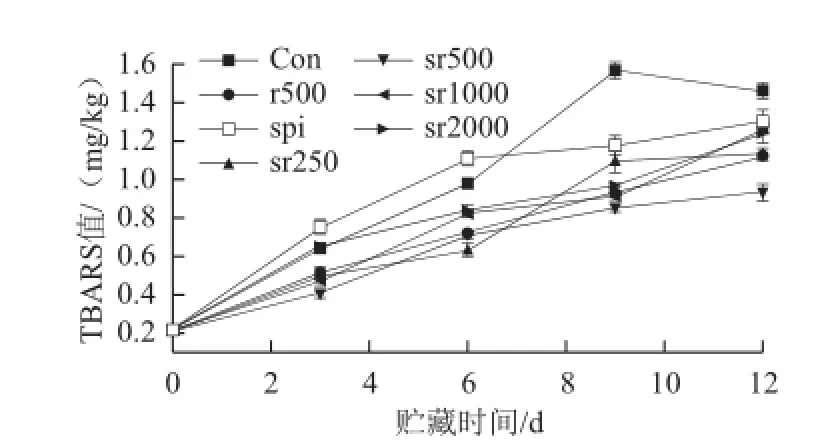
图3 不同处理组猪肉冷藏期间脂肪次级氧化产物TBARS值的变化Fig.3 Changes in secondary lipid oxidation products measured as TBARS in pork with different treatments during chilled storage
由图3可知,对照组肉品前9 d TBARS值急剧增加(P<0.01),但到第12天开始下降(P<0.05),这可能是由于贮藏末期脂肪氧化的次级产物被大量分解成小分子物质,故降低了猪肉的TBARS值。实验发现纯蛋白膜包裹的肉品前6d TBARS值大于对照组(P<0.05),但之后呈缓慢上升趋势,延缓了高氧气调环境中猪肉在贮藏后期TBARS值的形成。而迷迭香与蛋白膜复合形成的活性薄膜提高了蛋白膜对猪肉脂肪的抗氧化能力。其中sr250、sr500和sr1000三组活性薄膜包裹的肉品在整个贮藏期间TBARS值均明显低于对照组(P<0.01),sr2000从第6天开始明显抑制了TBARS值的快速生成(P<0.01)。实验发现sr500对脂肪TBARS值的抑制作用明显大于sr2000(P<0.01)。这是因为在制备的活性薄膜中,迷迭香被分散并固定于蛋白质的网络结构中,迷迭香分子通过从薄膜迁移到肉品表面或在薄膜内部吸附猪肉产生的氧化产物而达到清除自由基的目的,薄膜中装载的迷迭香的量不同,导致薄膜的微观结构出现差异,从而影响迷迭香对自由基的清除速率,故薄膜的抗氧化活性的强弱与迷迭香质量浓度的高低并无直接联系。
由图3可知,迷迭香喷洒处理明显抑制了猪肉的脂类氧化(P<0.01),但r500对猪肉TBARS值的抑制作用介于sr500和sr2000之间。实验发现sr500处理组肉品在整个贮藏期间TBARS值均低于r500处理组,且两者从第9天开始表现出明显差异(P<0.01),这说明蛋白膜对适量迷迭香的包埋可以增强迷迭香对生鲜猪肉脂肪的抗氧化能力,而且,本实验也可以说明对于相同质量浓度迷迭香,蛋白膜的包埋可以增加迷迭香的抗氧化活性。而Camo等[25]报道相比迷迭香活性薄膜,迷迭香直接添加对高氧气调下羊肉TBARS值起到了更好的的抑制作用,这可能是由于活性膜的迷迭香没有达到最适质量浓度。
2.4 蛋白质氧化

图4 不同处理组猪肉冷藏期间蛋白质羰基含量的变化Fig.4 Changes in protein oxidation products measured as carbonyl content in pork with different treatments during chilled storage
由图4可知,迷迭香直接喷洒和纯蛋白膜包裹均减少了肉品贮藏期间蛋白质羰基的生成量(P>0.05),且两个处理组在第12天蛋白质羰基含量明显低于对照组(P<0.01),其中spi对蛋白质羰基的抑制效果略好于r500(P>0.05)。实验发现sr1000虽然对肉品的MetMb和脂肪表现出良好的抗氧化能力,但是对蛋白质羰基的抑制效果不大,sr1000处理组肉品在前9d蛋白质羰基含量略大于对照组(P>0.05),到第9天两者出现明显差异(P<0.05)。sr2000处理组在贮藏前期与对照组并无明显差异,到第12天才表现出对蛋白质羰基的抑制作用(P<0.01)。而蛋白膜包埋低质量浓度迷迭香即sr250和sr500两个处理组从第6天开始蛋白质羰基含量远远低于r500和对照组(P<0.01),对肉品蛋白质表现出优秀的抗氧化能力。sr250虽然无法延缓猪肉a*值的下降和MetMb的形成,但猪肉TBARS值和蛋白质羰基的生成均起到了一定的抑制作用,这可能是由sr250薄膜中迷迭香的抗氧化作用与薄膜对氧气的阻隔作用共同决定的。此外,sr500处理组肉品在整个贮藏期间蛋白质羰基的含量明显低于sr250(P<0.01),到贮藏末期蛋白质羰基含量仍在1.5 nmol/mg以下。
2.5 硬度的变化
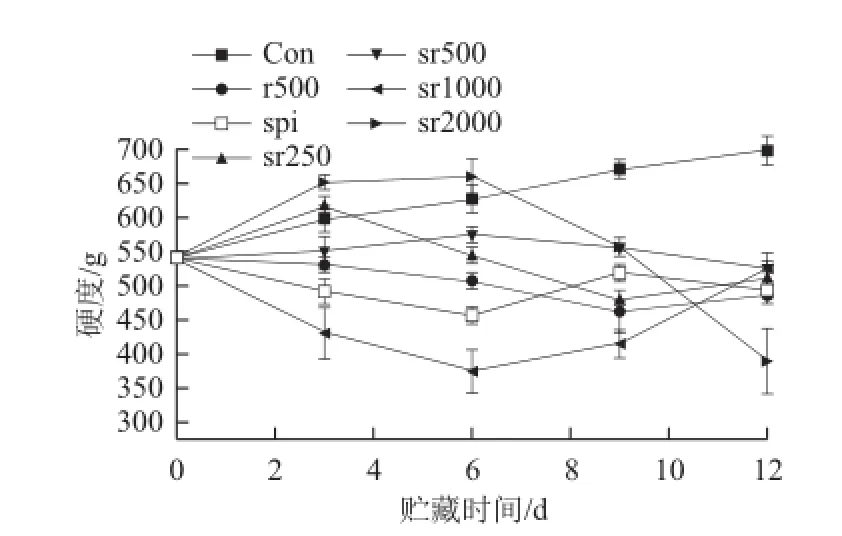
图5 不同处理组猪肉冷藏期间硬度的变化Fig.5 Changes in hardness in fresh pork with different treatments during chilled storage
如图5所示,对照组肉品在高氧环境中硬度变大(P<0.05)。大量研究[26-28]报道高氧气调对肉品嫩度产生不利影响,这与本实验结果一致。Lund等[26]认为高氧气调引起的蛋白质氧化促使肌球蛋白通过二硫键形成分子间交联,从而使肉品变硬,而且氧化也会影响蛋白水解酶的活性,继而阻止肉品的嫩化。由图5可知,纯蛋白膜包裹的肉品前6 d硬度下降,第9天硬度回升,到贮藏末期基本维持在500 g左右。而sr1000处理组肉品贮藏6d后硬度下降到400 g以下,明显低于spi处理组,但之后硬度开始上升,这可能是由蛋白质氧化造成的。由图4可知,sr1000无法抑制猪肉蛋白质羰基的生成,蛋白质降解可能导致猪肉硬度下降,而蛋白质的聚集或蛋白分子间的交联可能又促使sr1000处理组肉品后期硬度值增加。与对照组相比,sr2000则增加了肉品贮藏前期的硬度(P>0.05),到第3天已达到650 g左右,明显大于对照组肉品(P<0.01),但该处理组肉品贮藏6 d后硬度急剧下降,到贮藏末期肉品硬度降到400 g以下。实验发现r500和sr500两个处理组有效抑制了高氧气调包装的肉品硬度的增加(P<0.01),其中sr500基本维持肉品的硬度在初始状态,r500处理组从第6天开始硬度明显低于sr500(P<0.01)。而sr250处理组虽然前3 d硬度略有增加,但与对照组相比差异并不显著(P>0.05),且sr250处理组从第6天开始猪肉的硬度介于sr500和r500之间。
3 结 论
纯蛋白膜包裹无法延缓猪肉颜色的劣变和MetMb的生成,但在贮藏后期对TBARS值和蛋白质羰基起到了一定的抑制作用。蛋白膜加入不同质量浓度迷迭香对生鲜猪肉表现出不同的抗氧化效果。sr250(0.025 g/100 mL)对猪肉的颜色和MetMb没有表现出抗氧化作用,但明显抑制了猪肉脂类和蛋白质氧化。sr1000(0.1g/100mL)和sr2000(0.2 g/100 mL)两个处理组对猪肉的颜色、MetMb、TBARS值起到了良好的抑制作用,且两组对猪肉的护色作用达到甚至超过了迷迭香直接添加的作用效果,但sr1000和sr2000对猪肉蛋白质羰基的生成没有起到明显的抑制作用,也无法维持肉品贮藏期间的硬度。这可能是由于猪肉的蛋白质和脂类在气调贮藏环境中表现的氧化机制不同,两者可能并无直接联系[29]。而sr500(0.05g/100mL)在整个贮藏期间对猪肉颜色和硬度的维持及对肉品脂类、蛋白质等的抗氧化作用均好于r500(0.05g/100mL喷洒),且随着贮藏时间的延长,迷迭香与大豆分离蛋白的复合表现出明显的优势。
通过对比活性蛋白膜和迷迭香直接喷洒对猪肉护色和抗氧化效果的影响,可以得出大豆分离蛋白加入适量迷迭香对猪肉的抗氧化效果可以达到甚至超过迷迭香直接添加的作用效果,而且对于相同质量浓度迷迭香,大豆蛋白膜的包埋可以增强迷迭香的活性。但是活性蛋白膜对猪肉抗氧化作用的机理并不清晰。本实验中使用的是脂溶性迷迭香,根据相似相容原理,迷迭香可能由于布朗运动从蛋白膜的网络结构中扩散迁移到肉品表面,从而实现对猪肉的抗氧化作用。而生鲜猪肉本身含有的水分使包裹的蛋白膜发生溶胀,薄膜中聚合物的流动性增加,也可能促使迷迭香扩散行为的发生。Granda-Restrepo等[30]报道生育酚从多层活性薄膜中迁移到食品表面从而延缓了全脂奶粉的脂类氧化。但迷迭香也可能被固定于大豆分离蛋白膜内,在薄膜表面或内部实现对自由基的清除能力。Tovar等[31]研究迷迭香提取物从活性塑料薄膜向模拟物的迁移行为,发现迷迭香的迁移量非常低。而Nerín等[32]报道活性薄膜能够通过吸收顶空中的活性氧,从而起到清除自由基的目的。
此外,研究报道蛋白膜在低湿环境中对氧气具有优秀的阻隔能力[33],虽然生鲜猪肉包装内具有较高的湿度环境,但蛋白膜的包裹可能还是会对猪肉表面的氧气体积分数产生影响。而且大豆分离蛋白中含有的酪氨酸、苯丙氨酸和色氨酸对300 nm波长以下的光线具有较强的吸收能力[34],因此,大豆蛋白膜对氧气和紫外线的阻隔能力也可能对猪肉脂类蛋白质的氧化起到了一定的抑制作用。
[1] MANCINI R A, HUNT M C. Current research in meat color[J]. Meat Science, 2005, 71(1): 100-121.
[2] 应丽莎, 刘星, 周晓庆, 等. 肉类产品护色技术研究进展[J]. 食品科学, 2011, 32(3): 291-295.
[3] 应丽莎, 赵东方, 傅阳, 等. 迷迭香与高氧气调对生鲜猪肉的护色及抗氧化效果[J]. 食品科学, 2013, 34(2): 256-261.
[4] HERNANDEZ-HERNANDEZ E, PONCE-ALQUICIRA E, JARAMILLO-FLORES M E, et al. Antioxidant effect rosemary (Rosmarinus officinalis L.) and oregano (Origanum vulgare L.) extracts on TBARS and colour of model raw pork batters[J]. Meat Science, 2009, 81(2): 410-417.
[5] LIU D C, TSAU R T, LIN Y C, et al. Effect of various levels of rosemary or Chinese mahogany on the quality of fresh chicken sausage during refrigerated storage[J]. Food Chemistry, 2009, 117(1): 106-113.
[6] LARA M S, GUTIERREZ J I, TIMON M, et al. Evaluation of two natural extracts (Rosmarinus offi cinalis L. and Melissa offi cinalis L.) as antioxidants in cooked pork patties packed in MAP[J]. Meat Science, 2011, 88(3): 481-488.
[7] MARTINEZ L, CILLA I, BELTRAN J A, et al. Effect of illumination on the display life of fresh pork sausages packaged in modified atmosphere. Influence of the addition of rosemary, ascorbic acid and black pepper[J]. Meat Science, 2007, 75(3): 443-450.
[8] 应丽莎, 赵东方, 付海姣, 等. 控释技术在食品活性包装中应用与研究[J]. 食品科学, 2012, 33(9): 335-340.
[9] de ABREU D A P, LOSADA P P, MAROTO J, et al. Natural antioxidant active packaging film and its effect on lipid damage in frozen blue shark (Prionace glauca)[J]. Innovative Food Science & Emerging Technologies, 2011, 12(1): 50-55.
[10] SEYDIM A C, SARIKUS G. Antimicrobial activity of whey protein based edible films incorporated with oregano, rosemary and garlic essential oils[J]. Food Research International, 2006, 39(5): 639-644.
[11] BOURBON A I, PINHEIRO A C, CERQUEIRA M A, et al. Physicochemical characterization of chitosan-based edible films incorporating bioactive compounds of different molecular weight[J]. Journal of Food Engineering, 2011, 106(2): 111-118.
[12] BYUN Y, KIM Y T, WHITESIDE S. Characterization of an antioxidant polylactic acid (PLA) film prepared with alpha-tocopherol, BHT and polyethylene glycol using film cast extruder[J]. Journal of Food Engineering, 2010, 100(2): 239-244.
[13] WU J G, WANG P J, CHEN S C. Antioxidant and antimicrobial effectiveness of catechin-impregnated pva-starch film on red meat[J]. Journal of Food Quality, 2010, 33(6): 780-801.
[14] NER¸N C, TOVAR L, DJENANE D, et al. Stabilization of beef meat by a new active packaging containing natural antioxidants[J]. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7840-7846.
[15] CHO S Y, LEE S Y, RHEE C. Edible oxygen barrier bilayer film pouches from corn zein and soy protein isolate for olive oil packaging[J]. LWTFood Science and Technology, 2010, 43(8): 1234-1239.
[16] DJENANE D, SANCHEZ-ESCALANTE A, BELTRAN J A, et al. Ability of alpha-tocopherol, taurine and rosemary, in combination with vitamin C, to increase the oxidative stability of beef steaks packaged in modified atmosphere[J]. Food Chemistry, 2002, 76(4): 407-415.
[17] JAKOBSEN M, BERTELSEN G. Colour stability and lipid oxidation of fresh beef. Development of a response surface model for predicting the effects of temperature, storage time, and modified atmosphere composition[J]. Meat Science, 2000, 54(1): 49-57.
[18] RUBIO B, MARTINEZ B, GARCIA-CACHAN M D, et al. Effect of the packaging method and the storage time on lipid oxidation and colour stability on dry fermented sausage salchichon manufactured with raw material with a high level of mono and polyunsaturated fatty acids[J]. Meat Science, 2008, 80(4): 1182-1187.
[19] KRZYWICKI K. The determination of haem pigments in meat[J]. Meat Science, 1982, 7(1): 29-36.
[20] S±RENSEN G, J RGENSEN S S. A critical examination of some experimental variables in the 2-thiobarbituric acid (TBA) test for lipid oxidation in meat products[J]. ZeitschriftfürLebensmitteluntersuchung und-Forschung A, 1996, 202(3): 205-210.
[21] OLIVER C N, AHN B W, MOERMAN E J, et al. Age-related changes in oxidized proteins[J]. Journal of Biological Chemistry 1987, 262(12): 5488-5491.
[22] MARTINEZ O, SALMERON J, GUILLEN M D, et al. Texture profile analysis of meat products treated with commercial liquid smoke flavourings[J]. Food Control, 2004, 15(6): 457-461.
[23] MARTINEZ L, DJENANE D, CILLA I, et al. Effect of varying oxygen concentrations on the shelf-life of fresh pork sausages packaged in modified atmosphere[J]. Food Chemistry, 2006, 94(2): 219-225.
[24] CAMO J, LORES A, DJENANE D, et al. Display life of beef packaged with an antioxidant active film as a function of the concentration of oregano extract[J]. Meat Science, 2011, 88(1): 174-178.
[25] CAMO J, BELTRAN J A, RONCALES P. Extension of the display life of lamb with an antioxidant active packaging[J]. Meat Science, 2008, 80(4): 1086-1091.
[26] LUND M N, LAMETSCH R, HVIID M S, et al. High-oxygen packaging atmosphere influences protein oxidation and tenderness of porcine longissimus dorsi during chill storage[J]. Meat Science, 2007, 77(3): 295-303.
[27] ZAKRYS P I, O’SULLIVAN M G, ALLEN P, et al. Consumer acceptability and physiochemical characteristics of modified atmosphere packed beef steaks[J]. Meat Science, 2009, 81(4): 720-725.
[28] DIKEMAN M E, GROBBEL J P, HUNT M C, et al. Effects of packaging atmospheres on beef instrumental tenderness, fresh color stability, and internal cooked color[J]. Journal of Animal Science, 2008, 86(5): 1191-1199.
[29] LUND M N, HVIID M S, SKIBSTED L H. The combined effect of antioxidants and modified atmosphere packaging on protein and lipid oxidation in beef patties during chill storage[J]. Meat Science, 2007, 76(2): 226-233.
[30] GRANDA-RESTREPO D M, SOTO-VALDEZ H, PERALTA E, et al. Migration of alpha-tocopherol from an active multilayer film into whole milk powder[J]. Food Research International, 2009, 42(10): 1396-1402.
[31] TOVAR L, SALAFRANCA J, S NCHEZ C, et al. Migration studies to assess the safety in use of a new antioxidant active packaging[J]. Journal of Agricultural and Food Chemistry, 2005, 53(13): 5270-5275.
[32] NER¸N C, TOVAR L, SALAFRANCA J. Behaviour of a new antioxidant active film versus oxidizable model compounds[J]. Journal of Food Engineering, 2008, 84(2): 313-320.
[33] RHIM J W, MOHANTY K A, SINGH S P, et al. Preparation and properties of biodegradable multilayer films based on soy protein isolate and poly (lactide)[J]. Industrial & Engineering Chemistry Research, 2006, 45(9): 3059-3066.
[34] GUERRERO P, STEFANI P M, RUSECKAITE R A, et al. Functional properties of films based on soy protein isolate and gelatin processed by compression molding[J]. Journal of Food Engineering, 2011, 105(1): 65-72.
Effect of Protein-Based Film Containing Rosemary on Color and Oxidative Stability of Fresh Pork in High-Oxygen Modified Atmosphere
LI Da-hu, YING Li-sha, CHENG Yu-jiao, ZHANG Min*
(Chongqing Special Food Program and Technology Research Center, Laboratory of Quality and Safety Risk Assessment for Argo-products on Storage and Preservation (Chongqing), Ministry of Agriculture, College of Food Science, Southwest University, Chongqing 400715, China)
The active protein films prepared with different concentrations of rosemary and soy protein isolate were used for color protection and preservation of fresh pork in high-oxygen modifi ed atmosphere. Changes in CIE a* value, metmyoglobin, thiobarbituric acid reactive substances (TBARS) value, protein carbonyl and hardness value of fresh pork were determined. The results showed that direct treatment with rosemary at 0.05 g/100 mL effectively inhibited lipid oxidation and discolouration in the later period of storage in high oxygen atmosphere packaging. Protein films incorporated with different concentrations of rosemary showed different antioxidant effects on pork. Pure protein film and the film with rosemary at a concentration of 0.025 g/100 mL were unable to inhibit discoloration of pork, but they delayed lipid and protein oxidation to a certain extent. The fi lms with rosemary concentration at 0.1 and 0.2 g/100 mL effectively delayed the decline of a* value and the formation of metmyoglobin and TBARS value, and its protection on meat color was better than that observed with direct addition of rosemary, but these two groups failed to inhibit the formation of protein carbonyl. While the fi lm with 0.05 g of rosemary /100 mL exerted better protection than that o f direct addition of rosemary on color, lipids, proteins and other parameters of fresh pork, it basically maintained the hardness value of meat during storage. These results indicate that protein fi lm incorporated with rosemary increased the antioxidant activity of rosemary on pork in high oxygen atmosphere packaging.
rosemary; soy protein isolate; high-oxygen modifi ed atmosphere; antioxidation; pork
TS251.5
A
1002-6630(2014)24-0321-06
10.7506/spkx1002-6630-201424062
2014-06-15
重庆市科技攻关应用技术研发类重点项目(cstc2012gg-yyjsB80003);中央高校基本科研业务费专项(XDJK2013C130)
李大虎(1989—),男,硕士研究生,研究方向为食品包装技术。E-mail:ldh060308@126.com
*通信作者:张敏(1975—),男,副教授,硕士,研究方向为食品包装保鲜材料及技术。E-mail:zmqx123@163.com

