苜蓿冰结构蛋白的提取及对冷冻面团的影响
曲 敏,董正婷,陈凤莲,刘羽佳,李凌俐,孙兆国,鲍 欢
(哈尔滨商业大学 食品科学与工程省级重点实验室,黑龙江 哈尔滨 150076)
苜蓿冰结构蛋白的提取及对冷冻面团的影响
曲 敏,董正婷,陈凤莲,刘羽佳,李凌俐,孙兆国,鲍 欢
(哈尔滨商业大学 食品科学与工程省级重点实验室,黑龙江 哈尔滨 150076)
以“肇东”紫花苜蓿干草为原料。利用磷酸盐缓冲溶液法提取苜蓿蛋白,通过单因素和响应曲面试验,得到提取苜蓿蛋白的最佳工艺条件为料液比1∶20、磷酸盐缓冲溶液浓度63 mmol/L、p H 7.7、草粉粉碎粒度80 目、搅拌时间2 h。在此条件下苜蓿蛋白的提取率为37.77%。经硫酸铵沉淀,透析脱盐,冷冻干燥后复溶,对其溶液进行冰晶形态观察,可以看出苜蓿蛋白的冰晶体积小、数量多、形态多样,说明其抑制冰晶生长及对冰晶的形态修饰效果显著,具有很好的抗冻活性,为冰结构蛋白。将其应用于冷冻面团后,冷冻面团的硬度明显降低,弹 性、回复性和内聚性稍增强,咀嚼性有所降低,质地细腻柔软。
苜蓿;冰结构蛋白;冰晶;冷冻面团
冰结构蛋白(ice structuring proteins,ISPs),又称为抗冻蛋白、不冻蛋白(antifreeze proteins,AFPs),或热滞蛋白(thermal hysteresis proteins,THPs)[1-2]。近年来,国内外趋向统称为冰结构蛋白,是一类保护生物体抵御外界寒冷环境而产生的多肽,具有一定的热滞活性,能够控制冰晶生长、修饰冰晶形态,并抑制冰晶重结晶[3-4]。ISPs先后在冷水鱼类、昆虫、植物、细菌和真菌[5-7]中发现,植物ISPs发现的最晚[8]。严寒环境中的生物体体内产生的冰晶会损伤细胞,导致细胞破裂、直至生物体死亡。ISPs是生物体应激性抵御冻害的重要生存策略之一。植物ISPs热滞值较低(0.2~0.6 ℃)[9-11],但其修饰冰晶形态、抑制冰晶重结晶的作用显著,与鱼类、昆虫的ISPs明显不同。ISPs对冰晶形态的修饰作用,已经成为检验蛋白质是否具有抗冻活性的一项重要指标[12-13]。ISPs的作用不同于常见的盐、蔗糖等离子抗冻剂。作为一类新型食品添加剂,ISPs及其在食品行业中的应用受到研究者的广泛关注,但有关ISPs的来源、制备及其在冷冻食品中应用等方面的相关研究较少。由于ISPs价格昂贵,因此,开发食品源的、价格低廉、安全的冰结构蛋白日益成为研究的热点与方向。夏露等[14]将2.5%的冬小麦麸皮ISPs添加到速冻汤圆中,汤圆的品质得到明显改善。李玲玲等[15]研究了冬小麦ISPs对湿面筋蛋白冻藏稳定性的影响,通过观察湿面筋中可冻结水含量、流变学特性及超微结构发生变化,得到冬小麦ISPs通过抑制冰晶的形成和重结晶,减小冻藏过程中湿面筋蛋白的网络遭受破坏。潘振兴等[16]研究了ISPs对长期冻藏冷冻面团抗冻发酵特性与超微结构的影响,发现添加0.5% ISPs的冷冻面团,经过冻藏105d后,仍存在明显的面筋网络结构。
绿色植物是最大的廉价蛋白资源,富含植物蛋白、资源丰富、成本低廉的植物品种主要集中在豆科牧草和禾本科牧草[17]。苜蓿(Medicago sativa L.),俗称金花菜,属豆科多年生牧草,经极端低温后的返青率达到90%以上。是世界上分布最广、栽培历史最古老的优良牧草,被称为“牧草之王”[18]。我国的种植面积约133万hm2,居世界第五位。苜蓿富含蛋白质、脂肪、多种矿物质元素、多种维生素以及适合生长发育的必需氨基酸,营养价值高,是对人体健康营养最全面的草本植物之一[19]。用于食品可以改进人们的膳食营养成分,应用前景非常广阔[20]。本研究通过提取苜蓿ISPs,观察其冰晶形态,并添加到冷冻面团中,检测其物性指标变化,旨在研究苜蓿ISPs的抗冻活性及对冷冻面团的质地及物性的影响,为拓宽植物ISPs资源及其应用提供理论依据。
1 材料与方法
1.1 材料与试剂
“肇东”紫花苜蓿由黑龙江省农业科学院草业研究所苜蓿实验基地提供。
考马斯亮蓝G250 美国Sigma公司;磷酸氢二钠、磷酸二氢钠、硫酸铵、氯化钠(均为分析纯) 天津市致远化学试剂有限公司。
1.2 仪器与设备
多功能粉碎机 永康市帅通工具有限公司;UV-5100B紫外-可见分光光度计 上海元析仪器有限公司;FDU-1200型冷冻干燥机 日本东京理化;Z366高速大容量台式离心机 德国哈默公司;DM750生物显微镜瑞士莱卡显微系统有限公司;TA-XT2i型质构仪 英国SMS公司。
1.3 方法
1.3.1 预处理及苜蓿干草蛋白含量的测定
选用“肇东”紫花苜蓿干草,取嫩茎叶,经粉碎、过筛后,草粉备用。采用KDY-9820半自动凯氏定氮仪进行测定,测定苜蓿干草的粗蛋白含量。
1.3.2 蛋白含量及提取率的测定
采用考马斯亮蓝比色法。分别精密吸取标准蛋白质溶液0.0、0.1、0.2、0.3、0.4、0.5、0.6 mL于具塞试管中,各管加水至1 mL,加入考马斯亮蓝G250溶液5 mL,充分混匀,静置5 min,于595 nm波长处测定吸光度,绘制标准曲线。
蛋白含量测定:准确量取提取液1 mL,按上述标准曲线的测定方法,分别测定其吸光度,计算样品中蛋白质的含量,并按下式计算苜蓿蛋白提取率。
苜蓿蛋白提取率/%=m1/m2×100
式中:m1为提取蛋白量,即上清液中的蛋白含量;m2为总蛋白量,即原料蛋白含量。
1.3.3 苜蓿蛋白提取的单因素试验
称取一定量的苜蓿草粉按设定的料液比与磷酸缓冲液混合,覆盖保鲜膜防止氧化。在磁力搅拌器上搅拌,以320 目滤布过滤,弃去草渣。
1.3.3.1 草粉粉碎粒度对苜蓿蛋白提取率的影响
分别将过筛目数为40、60、80、100、120 目的草粉,以料液比1∶20浸泡于10 mmol/L磷酸盐缓冲溶液,pH8.0,搅拌4 h,8 000 r/min离心15 min,测定上清液蛋白含量,计算苜蓿蛋白提取率。
1.3.3.2 搅拌时间对苜蓿蛋白提取率的影响
草粉过筛目数80 目、磷酸盐缓冲溶液浓度10 mmol/L、料液比1∶20、溶液pH 8.0,分别搅拌1、2、3、4、5 h,8 000 r/min离心15 min,测定上清液蛋白含量,计算苜蓿蛋白提取率。
1.3.3.3 磷酸盐缓冲液pH值对苜蓿蛋白提取率的影响
草粉过筛目数80 目、磷酸盐缓冲溶液浓度10 mmol/L、料液比1∶20,溶液pH值分别为6.0、6.5、7.0、7.5、8.0、8.5、9.0,搅拌2 h,8 000 r/min离心15 min,测定上清液蛋白含量,计算苜蓿蛋白提取率。
1.3.3.4 料液比对苜蓿蛋白提取率的影响
草粉过筛目数80 目、磷酸盐缓冲溶液浓度10 mmol/L、溶液pH 8.0,料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25、1∶30,搅拌2 h,8 000 r/min离心15 min,测定上清液蛋白含量,计算苜蓿蛋白提取率。
1.3.3.5 磷酸盐缓冲溶液浓度对苜蓿蛋白提取率的影响
草粉过筛目数80 目、溶液pH 8.0、料液比1∶20,磷酸盐缓冲溶液浓度分别为10、20、30、40、50、60、70、80 mmol/L,搅拌2 h,8 000 r/min离心15 min,测定上清液蛋白含量,计算苜蓿蛋白提取率。
1.3.4 响应面法确定最优工艺条件
根据Box-Behnken设计原理,以蛋白质提取率为响应值,在单因素试验结果的基础上,综合考虑选择磷酸盐缓冲溶液浓度、料液比、pH值3 个因素进行响应面试验设计,见表1。

表1 响应面试验因素与水平Table 1 Process variables and levels in the three-variable and threelevel response surface design for protein extraction
1.3.5 苜蓿蛋白溶液的冰晶观察
将苜蓿蛋白上清液浓缩后,以硫酸铵饱和度为80%沉淀。透析脱盐,将苜蓿蛋白提取物冷冻干燥。
分别取30 μL的蒸馏水、2%的苜蓿蛋白溶液、2%的氯化钠溶液冷冻30 min,置于显微镜观察,观察各溶液的冰晶大小及形态。
1.3.6 苜蓿ISPs在冷冻面团中的应用
用高筋粉制作面团,等比例水和面,分别制作3 个空白面团,3 个添加1%苜蓿ISPs粗品面团。冷冻48 h以上,进行物性检测,3 次平行实验。采用质构仪对冷冻面团进行质构分析,测定方式:T.P.A;探头:P/50;测试前速率:2.00 mm/s;测试中速率:1.00 mm/s;测试后速率:1.00 mm/s;压缩程度:50%;力度:100 g;停留间隔:5 s;数据采集速率:200 pps。从质构特性参数当中选取硬度、内聚性、回复性、弹性和咀嚼性指标进行评价。
2 结果与分析
2.1 苜蓿干草的水分及粗蛋白含量
经检测,苜蓿干草的粗蛋白含量为20.85%,水分含量为1.3%。
2.2 牛血清蛋白标准曲线的绘制
得到标准曲线的回归方程为y=0.006 3x+0.005 1,R2=0.998 1,标准曲线的相关性良好。根据提取的上清液的吸光度,对应牛血清标准曲线,可以计算出提取液中的蛋白含量,进一步可计算出蛋白的提取率。
2.3 苜蓿蛋白的提取单因素试验结果
2.3.1 草粉粉碎粒度对苜蓿蛋白提取率的影响

图1 草粉粉碎粒度对苜蓿蛋白提取率的影响Fig.1 Effect of raw material particle size on protein extraction
由图1可以看出,苜蓿蛋白提取率在原料粉碎粒度40~80 目之间上升迅速,在80 目时提取率达到16.91%,而100 目后增加幅度较小。因此,选取80 目过筛。
2.3.2 搅拌时间对苜蓿蛋白提取率的影响
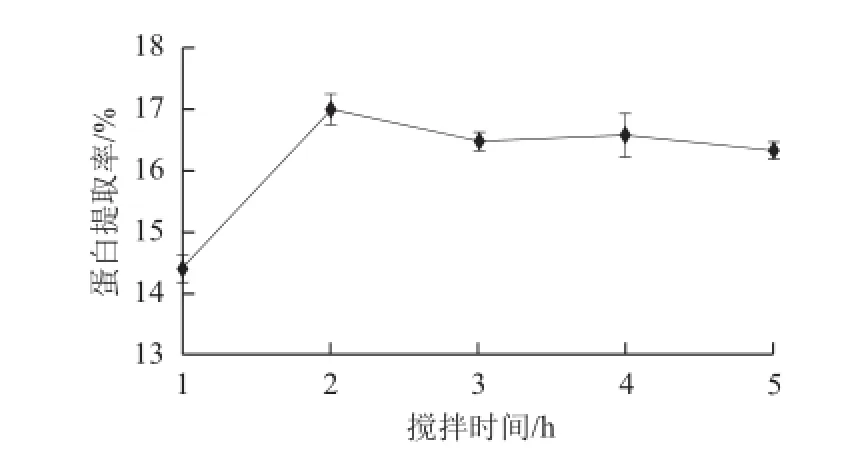
图2 搅拌时间对苜蓿蛋白提取率的影响Fig.2 Effect of stirring time on protein extraction
由图2可知,在搅拌时间2 h内,苜蓿中蛋白提取量随时间延长呈递增的趋势,2 h时提取量最大,提取率达到17.01%,2 h后趋于平衡。这个过程可能是浸提时间延长,蛋白的溶出增加,一定时间后,蛋白的溶出达到饱和,则溶出率趋于平衡。因此,搅拌时间选择2 h。
2.3.3 磷酸盐缓冲液的pH值对苜蓿蛋白提取率的影响
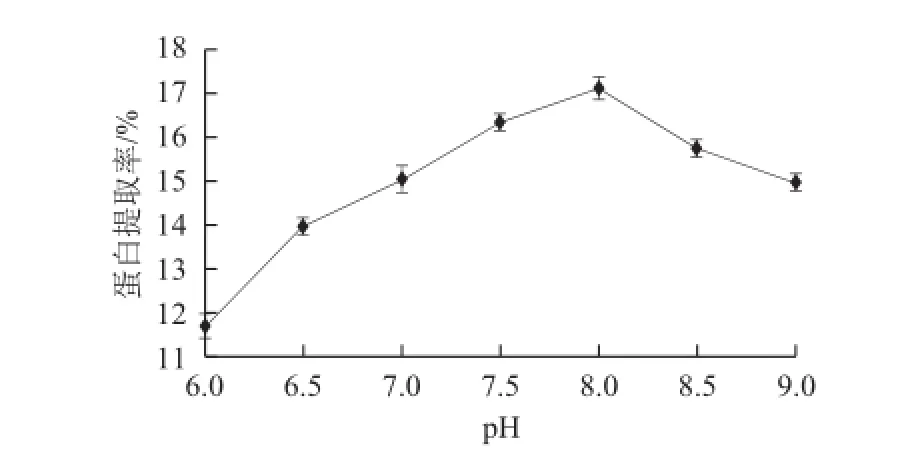
图3 pH值对苜蓿蛋白提取率的影响Fig.3 Effect of pH on protein extraction
由图3可知,在pH 6.0~8.0的条件下苜蓿蛋白提取率上升趋势明显,提取率由11.48%增至17.10%。当溶液pH值高于8.0提取率呈下降趋势,因此,可确定磷酸盐缓冲溶液的pH值为8.0。

图4 料液比对苜蓿蛋白提取率的影响Fig.4 Effect of solid/solvent ratio on protein extraction
2.3.4 料液比对苜蓿蛋白提取率的影响由图4可知,苜蓿蛋白提取率在料液比1∶5~1∶20之间上升迅速,由12.07%增加至19.86%,之后缓慢增加,可当料液比小于1∶20提取率变化不大。从提取成本考虑,料液比为1∶20时为最宜。

图5 磷酸盐缓冲溶液浓度对苜蓿蛋白提取率的影响Fig.5 Effect of buffer concentration on protein extraction
2.3.5 磷酸盐缓冲溶液浓度对苜蓿蛋白提取率的影响由图5可知,苜蓿蛋白提取率随着磷酸盐缓冲溶液浓度的增高而逐渐增多,在浓度为30~60 mmol/L时,提取率增长明显,由20.28%增至37.43%。之后,提取率明显下降。故最佳磷酸盐缓冲液适宜浓度为60 mmol/L。
2.4 最佳提取工艺条件的确定
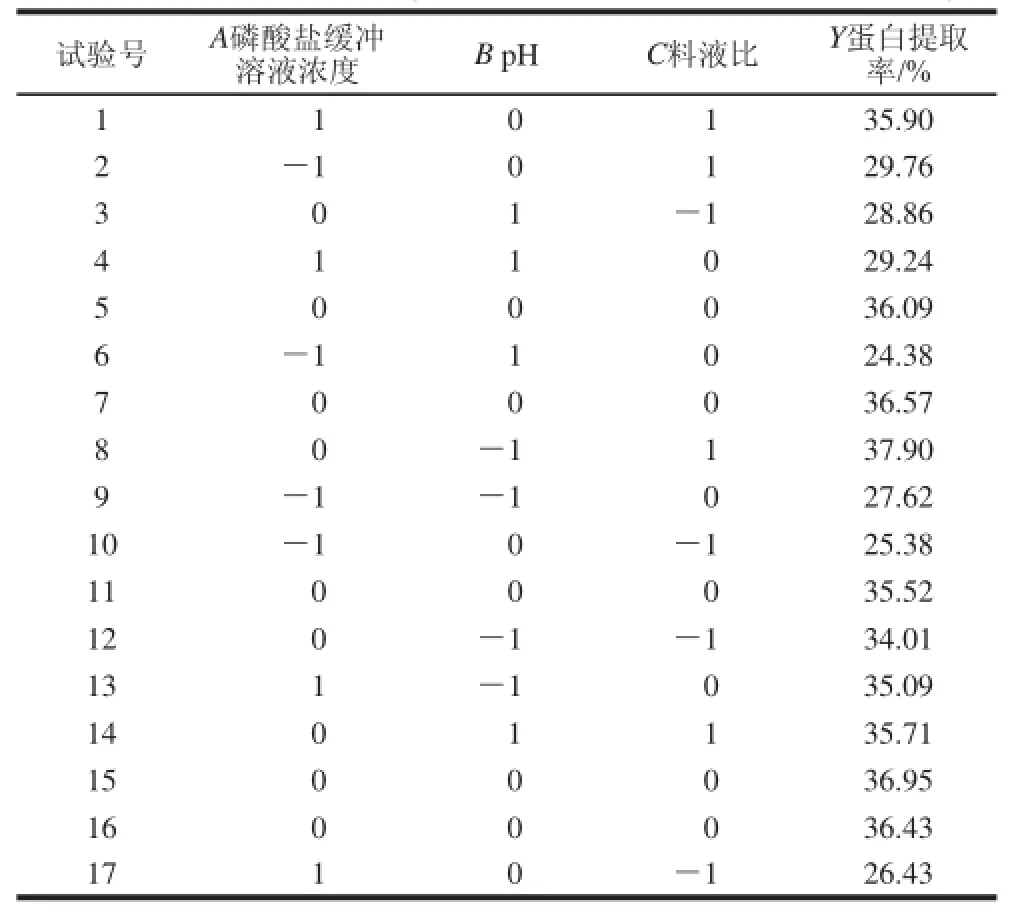
表2 响应面试验分析方案及结果Table 2 Experimental design and results for response surface analysis
通过单因素方差分析,得到因素对苜蓿蛋白提取率的影响程度大小顺序为:磷酸盐缓冲溶液浓度>料液比>pH值>草粉粉碎粒度>提取时间,故最佳提取工艺条件优化时,选择影响程度最大的3 个因素。根据Box-Behnken的中心组合试验设计原理,选择磷酸盐缓冲溶液浓度、料液比、pH值3 个因素,采用三因素三水平的响应分析方法求取优化的工艺参数,试验设计和结果见表2、3。试验次数为17 次,其中析因部分试验次数为12,中心点重复试验次数为5。利用 Design Expert 软件对表2的试验结果进行二次多元回归拟合,并进行方差分析,结果见表3。对响应值与各因素进行回归拟合后,得到的苜蓿蛋白质提取率(Y)对编码自变量的回归模型(去掉不显著项)表达式。
Y=36.31+2.44A-2.05B+3.07C+1.27AC-5.99A2-1.24B2-0.95C2

表3 回归模型的方差分析Table 3 Analysis of variance for the established regression model
从表3可知,此模型显著(P<0.05),A、B、C、AC、A2、B2对苜蓿蛋白提取率有显著影响。模型失拟项(P = 0.064 6,不显著),说明该回归模型对试验结果拟合较好,回归方程整体模型比较显著,并且失拟项不显著,表明该回归模型与实测值能较好地拟合。因此可利用该回归模型对试验结果进行分析,并确定苜蓿蛋白质的最优提取工艺。
各因素的F值可以反映出各因素对试验指标的重要性,F值越大,表明对试验指标的影响越大。从方差分析结果可知:F(A)=55.03,F(B)=38.99,F(C)= 87.33,即各因素对苜蓿蛋白提取率的影响程度大小顺序为:料液比>磷酸盐缓冲溶液浓度>pH值。
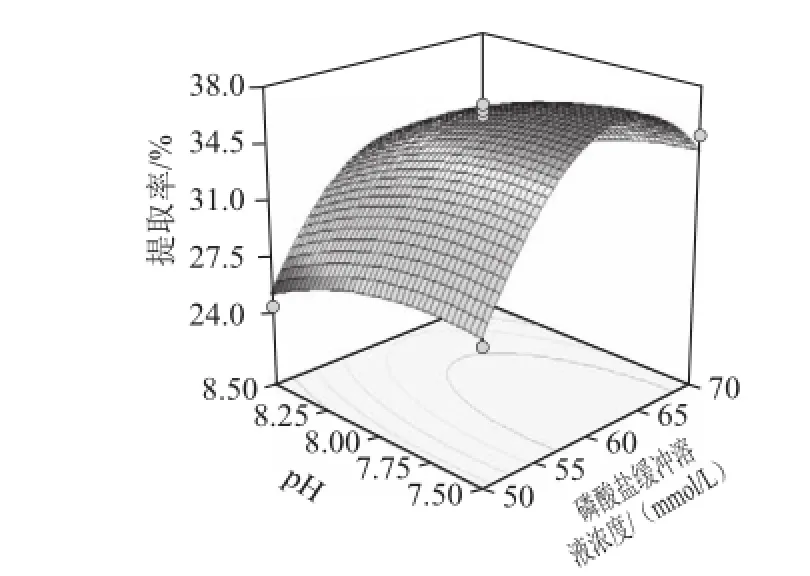
图6 pH值与磷酸盐缓冲溶液浓度的交互效应对蛋白提取率的影响Fig.6 Response surface plot showing the effect of pH and buffer concentration on the yield of protein
为了考察交互项对苜蓿蛋白提取率的影响,在其他因素条件固定不变的情况下,考察交互项对蛋白提取率的影响,对模型进行降维分析。经Design Expert 7.0软件分析,所得的响应面见图6。随着每个因素的增大,响应值增大;当响应值增大到极值后,随着因素的增大,响应值逐渐减小或不再增大。在交互项对蛋白提取率的影响中,磷酸盐缓冲溶液浓度和pH值交互作用对提取率的影响最小,其次是pH值和料液比交互作用,影响最大的是磷酸盐缓冲溶液浓度和料液比交互作用。

图7 料液比与磷酸盐缓冲溶液浓度的交互效应对蛋白提取率的影响Fig.7 Response surface plot showing the effect of solid to solvent ratio and buffer concentration on the yield of protein
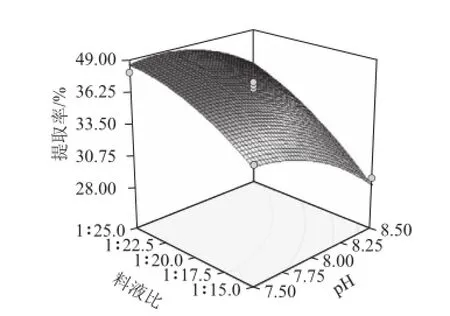
图8 pH值与料液比的交互效应对蛋白提取率的影响Fig.8 Response surface plot showing the effect of pH and solid to solvent ratio on the yield of protein
通过软件分析,得到最优提取条件为料液比1∶25、磷酸盐缓冲溶液浓度63.44 mmol/L、pH 7.69,得到蛋白提取率为39.48%。根据实际操作要求,考虑到实验后续的浓缩,选取最佳工艺条件为料液比1∶20、磷酸盐缓冲溶液浓度63 mmol/L、pH 7.7,经过3 组平行实验,得到苜蓿蛋白的提取率为37.77%,稍低于试验设计值,但接近于最优提取条件的预测值,所以试验值与预测值相符合。
2.5 苜蓿蛋白冻干粉的蛋白含量
苜蓿蛋白提取物冷冻干燥后,测得冻干粉的蛋白含量为71.2%。
2.6 苜蓿蛋白溶液冰晶观察
从图9可看出,水的冰晶形态是较大的圆泡;2% NaCl溶液的冰晶体积较小,数量较多,但形态较为单一。而2%苜蓿蛋白溶液的冰晶体积大小与NaCl溶液相仿,形态小、数量多。但冰晶形态丰富,且均匀,有小圆形与梭形、四边形、五边形、六边形、短棒形和异形。可见,苜蓿蛋白对冰晶生长的抑制及对冰晶的形态修饰作用显著,说明苜蓿蛋白具有很好的抗冻活性,为ISPs。
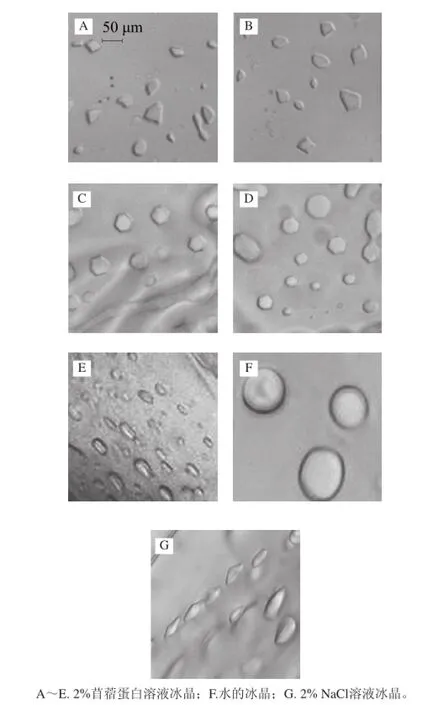
图9 冰晶修饰形态(×4400)Fig.9 Modified ice crystal morphology (×40)
2.7 添加苜蓿ISPs的冷冻面团质构特性的变化
Wang等[21]观察加有ISPs的冰淇淋样品冰晶细小且均匀,而未加ISPs的冰淇淋样品冰晶大且不均匀。因此,冷冻食品中晶体的大小、分布、位置以及形态均与与其最终质量密切相关[22]。从质构特性参数当中选取硬度、内聚性、回复性、弹性和咀嚼性等指标,是衡量ISPs对面团冷冻效果有影响的重要指标[23]。从图10及表4可知,添加了苜蓿ISPs的冷冻面团物性有明显的变化。首先冷冻面团的硬度明显降低,从这点可以看出抗冻蛋白可以修饰冰晶,使冰晶形态更小,分布得更均匀,从而形成了质地细腻且柔软的冷冻面团。其次,回复性、内聚性和弹性略增强,咀嚼性有所降低。其中未添加苜蓿ISPs的冷冻面团和添加苜蓿ISPs的冷冻面团的硬度、内聚性、弹性和咀嚼性均存在显著差异。

图10 对照(A)和添加苜蓿IISSPPss(B)的冷冻面团质构图Fig.10 Texture analysis of control and frozen dough with added alfalfa ice structural protein

表4 冷面团质构特性的测定Table 4 Texture properties of frozen dough
3 结 论
本研究利用磷酸缓冲溶液法提取苜蓿蛋白,通过单因素和响应面试验,得到提取苜蓿蛋白的最佳工艺条件为料液比1∶20、磷酸盐缓冲溶液浓度63 mmol/L、pH 7.7、草粉粉碎粒度80 目、搅拌时间2 h。在此条件下苜蓿蛋白的提取率为37.77%。
苜蓿蛋白溶液进行冰晶形态观察,并以水和NaCl溶液为对照,可以看出苜蓿蛋白溶液的体积小、冰晶数量多、形态多样,说明苜蓿蛋白抑制冰晶生长及对冰晶的形态修饰效果显著,具有很好的抗冻活性,为ISPs。
将苜蓿ISPs应用于冷冻面团后,检测其质构特性可以看出,冷冻面团的硬度明显降低,回复性、内聚性和弹性略增强,咀嚼性有所降低。说明添加ISPs的冷冻面团质地发生变化,细腻柔软。
[1] GRAETHER S P, KUIPER M J, GAGN S M, et al. Helix structure and ice-binding properties of a hyperactive antifreeze protein from an insect[J]. Nature, 2000, 406: 325-328.
[2] LI N, CHIBBER B A, CASTELLINO F J, et al. Mapping of disulfide bridges in antifreeze proteins from overwintering larvae of the beetle Dendroides canadensis[J]. Biochemistry, 1998, 37(18): 6343-6350.
[3] DAVIES P L, BAARDSNES J, KUIPER M J, et al. Structure and function of antifreeze proteins[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2002, 357: 927-935.
[4] HON W C, GRIFFITH M, MLYNARZ A, et al. Antifreeze protein in winter rye are similar to pathogenesis-related proteins[J]. Plant Physiology, 1995, 109(3): 879-889.
[5] 孙琳杰. 新疆荒漠昆虫抗冻蛋白在酿酒酵母低温保存中的应用[D].乌鲁木齐: 新疆大学, 2008: 69-79.
[6] GRAHAM L A, QIN W, LOUGHEE S C, et al. Evolution of hyperactive, repetitive antifreeze proteins in beetles[J]. Journal of Molecular Evolution, 2007, 64(4): 387-398.
[7] PUDNEY P D, BUCKLEY S L, SIDEBOTTOM C M, et al. The physico-chenical characterization of boiling stable antifreeze protein from a perennial grass (Lolium perenne)[J]. Archives of Biochemistry and Biophysics, 2003, 410(2): 238-245.
[8] GRIFFITH M, ALA P, YANG D S, et al. Antifreeze protein produced endogenously in winter rye leaves[J]. Plant Physiology, 1992, 100(2): 593-596.
[9] 张超, 赵晓燕, 马越, 等. 使用差示扫描量热仪测定抗冻蛋白热滞活性方法的研究[J]. 生物物理学报, 2008, 24(6): 465-471.
[10] 尉姗姗, 尹林克, 牟书勇, 等. 新疆沙冬青抗冻蛋白的提取分离及其热滞活性测定[J]. 云南植物研究, 2007, 29(2): 251-255.
[11] 刘尚, 廖祥儒, 张建国, 等. 一种女贞叶抗冻蛋白的分离纯化[J]. 植物学通报, 2007, 24(4): 505-510.
[12] HON W C, GRIFFITH M, CHONG P, et al. Extraction and isolation of antifreeze proteins from winter rye (Secale cereale G.) leaves[J]. Plant Physical, 1994, 104(3): 971-980.
[13] GRAETHER S P, KUIPER M J, GAGNE S M, et al. β-helix structure and ice-binding properties of a hyperactive antifreeze protein from an insect[J]. Nature, 2000, 406: 325-328.
[14] 夏露, 张超, 王立. 冬小麦抗冻蛋白制备及其在汤圆中的应用研究[J].食品工业科技, 2009, 30(11): 241-243; 310.
[15] 李玲玲, 贾春利, 黄卫宁. 冰结构蛋白对湿面筋蛋白冻藏稳定性的影响[J]. 食品科学, 2010, 31(19): 25-28.
[16] 潘振兴, 邹奇波, 黄卫宁, 等. 冰结构蛋白对长期冻藏冷冻面团抗冻发酵特性与超微结构的影响[J]. 食品科学, 2008, 29(8): 39-42.
[17] 曲敏, 马永强, 杨大鹏, 等. 不同方法提取苜蓿叶蛋白效果的比较及表征[J]. 食品科学, 2012, 33(14): 91-95.
[18] 薛正莲, 刘艳, 杨浩, 等. 植物叶蛋白的研究[J]. 安徽工程科技学院学报, 2005, 20(2): 70-73.
[19] 王鑫, 李永强, 李娟, 等. 紫花苜蓿营养成分及其主要生物学特性[J].草业科学, 2003, 20(10): 39-41.
[20] 谢正军. 苜蓿叶蛋白和酶法制备抗氧化肽的研究[D]. 无锡: 江南大学, 2009.
[21] WANG S Y, DAMODARAN S. Ice-structuring peptides derived from bovine collagen[J]. Journal of Agricultural and Food Chemistry, 2009, 57(12): 5501-5509.
[22] 赵金红, 胡锐, 刘冰, 等. 几种冷冻新技术对食品冻结过程中冰晶形成的影响[J]. 食品与机械, 2012, 28(2): 241-245.
[23] 任士贤. 冰结构蛋白及在中式冷冻面团中的应用[D]. 无锡: 江南大学, 2010: 18-25.
Extraction of Alfalfa Ice Structuring Proteins and Their Effect on Frozen Dough
QU Min, DONG Zheng-ting, CHEN Feng-lian, LIU Yu-jia, LI Ling-li, SUN Zhao-guo, BAO Huan
(Key Laboratory of Food Science and Engineering, Harbin University of Commerce, Harbin 150076, China)
In the present study, proteins were extracted from the young stems with leaves of Zhaodong alfalfa with phosphate buffer solution. Furthermore, the optimal extraction conditions for alfalfa proteins were determined by singlefactor experiment and response surface methodology. The results revealed that when the extraction was carried out by 2 h stirring of the 80-mesh raw material powder suspended in 63 mmol/L phosphate buffer solution at pH 7.7 with a solid/liquid ratio of 1:20, the yield of alfalfa proteins was 37.77%. The observed ice crystal morphology suggested that the ice crystals of the purified alfalfa proteins were small in size, increased in number and varied morphologically, indicating that the alfalfa proteins are able to significantly inhibit the growth and modify the conformations of ice crystals. These results demonstrate that the alfalfa proteins, which possess excellent antifreeze activity, are ice structuring proteins. In addition, we characterized the functional role of these alfalfa proteins in practical application by application in frozen dough. The results of texture properties demonstrated that the frozen dough mix had a soft and delicate texture, and increased elasticity, resilience and cohesion, but reduced chewiness.
alfalfa; ice structuring protein; ice crystal; frozen dough
TS201.1
A
1002-6630(2014)24-0057-06
10.7506/spkx1002-6630-201424011
2014-06-30
黑龙江省自然科学基金项目(C2011-24);黑龙江省教育厅科学技术研究项目(12511128);黑龙江省博士后科研启动基金项目(LBH-Q13098)
曲敏(1966—),女,教授,博士,主要从事新型植物蛋白及食品添加剂研究。E-mail:qumin777@126.com

