不同剂量吉非替尼对博莱霉素所致大鼠肺纤维化影响的比较*
黄文亭,林采余,韩 睿,王玉波,陈恒屹,卢从华,李 力,何 勇△
(第三军医大学大坪医院野战外科研究所:1.呼吸科;2.胸外科,重庆400010)
吉非替尼是表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)的一种,目前被广泛应用于进展或难治性非小细胞肺癌(non small cell lung cancer,NSCLC)的小分子靶向药物,具有高选择性和低毒性的优点,在改善晚期NSCLC的近远期疗效与生活质量等方面具有令人鼓舞的前景。在临床诊疗过程中,间质性肺疾病(interstitial lung disease,ILD)是吉非替尼少见但致命的不良反应,全球范围内使用吉非替尼治疗NSCLC并发ILD的总体发生率约为1%,死亡率高达30%[1-2]。但目前国内外有基础研究认为吉非替尼对博莱霉素诱导的大鼠(或小鼠)肺纤维化有抑制作用,这一结论与临床实践完全相反,故明确吉非替尼对博莱霉素诱导的肺纤维化的影响有利于探索临床TKI相关性ILD的干预措施[3-5]。
TKI相关性ILD发病率较低,因此单纯用吉非替尼灌胃动物,成功诱导出肺纤维化概率非常低,动物模型建立困难。有研究者证实即使单纯大剂量吉非替尼(200mg/kg)灌胃亦不能引起小鼠明显肺纤维化改变[3-4]。博莱霉素诱导的大鼠肺纤维化动物模型已较成熟,故采用博莱霉素致大鼠肺纤维化后,以吉非替尼干预博莱霉素所致肺纤维化,观察其对纤维化的影响是高效、切实可行的办法。本研究建立了博莱霉素致大鼠肺纤维化模型,探讨不同剂量吉非替尼对纤维化的影响及剂量与效应之间的关系。
1 材料与方法
1.1 材料 选取6周龄健康雄性SD大鼠75只(购自第三军医大学大坪医院野战外科研究所实验动物中心),体质量200~210g。吉非替尼购自英国Tocris Bioscience公司。Masson染色试剂盒由福州迈新生物技术公司生产。ELISA试剂盒由武汉优尔生公司生产。
1.2 方法
1.2.1 动物模型的制备及分组 将75只SD大鼠适应性喂养1周后,分为对照组、博莱霉素组、低剂量吉非替尼联用组、中剂量吉非替尼联用组和高剂量吉非替尼联用组,每组15只。将75只SD大鼠分别用1%戊巴比妥钠腹腔注射麻醉后,仰卧固定于鼠板上,颈部去毛后乙醇消毒,纵行切开颈前皮肤,分离组织后暴露气管。向气管内注入博莱霉素(5mg/kg,5g/L),对照组注入无菌生理盐水200μL,注射后迅速将动物直立,旋转,使药液在肺内分布均匀。各组大鼠于气管内注射当天开始连续灌胃21d,对照组与博莱霉素组予生理盐水2mL灌胃,低、中、高剂量吉非替尼联用组分别给予相同体积吉非替尼20、90、200mg/kg灌胃。气管内注射后第21天,杀鼠取肺。
1.2.2 肺组织病理学检查 大鼠左肺以4%多聚甲醛固定后,石蜡包埋切片,组织切片进行常规HE染色及 Masson胶原染色,胶原染色严格按照Masson染色试剂盒说明书进行操作。纤维化程度按Ashcroft等[6]的方法进行评分。
1.2.3 肺组织羟脯氨酸含量的测定 采用ELISA方法,严格按照试剂盒说明书操作。
1.3 统计学处理 采用SPSS13.0统计软件进行分析,计量资料以±s描述。Ashcroft评分及羟脯氨酸含量比较采用独立样本t检验,大鼠死亡率组间两两比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠肺组织病理学检查 实验第21天对照组肺组织结构清晰,无明显充血、出血、炎症浸润和纤维化等。博莱霉素组肺泡间隔明显增宽,炎症细胞浸润,纤维组织增生。低、中剂量吉非替尼联用组肺组织病理改变与博莱霉素组表现相近。高剂量吉非替尼联用组见组织破坏严重,纤维化明显,肺泡间隔内成纤维细胞,上皮下肌成纤维细胞显著增多,炎症细胞浸润,局部实变。组织切片经Masson染色后肌纤维呈红色,胶原纤维呈蓝色(图1)。博莱霉素组Ashcroft评分较对照组显著增高(P<0.05);低、中剂量吉非替尼联用组Ashcroft评分与博莱霉素组比较,差异无统计学意义(P>0.05),高剂量吉非替尼联用组评分较博莱霉素组显著增高(P<0.05)。5组大鼠肺纤维化病理评分,见表1。
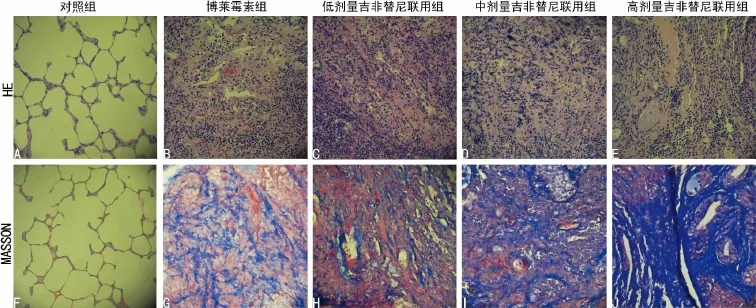
图1 各组大鼠第21天时肺组织HE染色及Masson染色(×200)
2.2 大鼠肺组织中羟脯氨酸含量的测定 博莱霉素组大鼠肺组织中羟脯氨酸含量较生理盐水对照组高(P<0.05);低剂量吉非替尼联用组肺组织中羟脯氨酸含量与博莱霉素组比较,差异无统计学意义(P>0.05);高剂量吉非替尼联用组及中剂量吉非替尼联用组肺组织中羟脯氨酸含量明显高于博莱霉素组(P<0.05),见表1。
表1 Ashcroft评分及羟脯氨酸含量比较(±s)
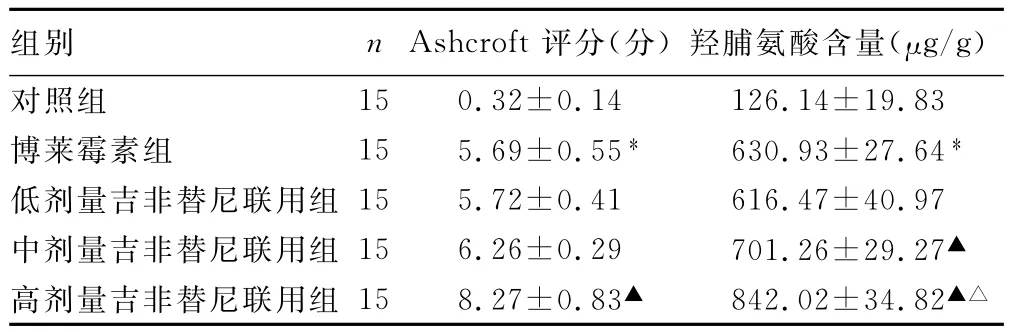
表1 Ashcroft评分及羟脯氨酸含量比较(±s)
*:P<0.05,与对照组比较;▲:P<0.05,与博莱霉素组比较;△:P<0.05,与中剂量吉非替尼联用组比较。
组别 n Ashcroft评分(分)羟脯氨酸含量(μg/g)对照组15 0.32±0.14 126.14±19.83博莱霉素组 15 5.69±0.55* 630.93±27.64*低剂量吉非替尼联用组 15 5.72±0.41 616.47±40.97中剂量吉非替尼联用组 15 6.26±0.29 701.26±29.27▲高剂量吉非替尼联用组 15 8.27±0.83▲ 842.02±34.82▲△
2.3 大鼠一般情况比较 对照组大鼠体格健壮,体质量增加明显,进食及饮水好,毛发有光泽,活动灵敏,至21d均存活。博莱霉素组、低剂量吉非替尼联用组、中剂量吉非替尼联用组大鼠体质量增加缓慢,精神状态较差,毛发无光泽,活动较少。高剂量吉非替尼联用组大鼠在给药后第3天有8只出现腹泻,至第5天13只大鼠呈稀水样便(包括死亡的7只大鼠),21d时仍存活的4只大鼠较其他组大鼠体型明显瘦弱、毛发晦暗、精神萎靡、反应迟钝。
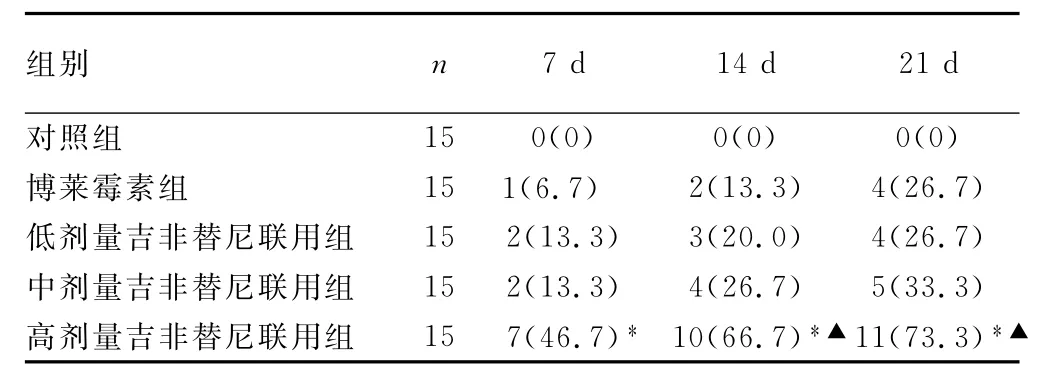
表2 不同时间点大鼠死亡情况[n(%)]
2.4 各组大鼠死亡率比较 各组大鼠7、14、21d死亡率见表2。
3 讨 论
动物模型是指用来进行生物学、行为学、自发或诱发性病理过程研究,能够表现一个或多个方面类似人类或其他动物种类的研究模型[7]。作为人类疾病的“复制品”,动物模型应具有再现性好、复制率高等特点。在临床诊疗过程中,吉非替尼治疗NSCLC并发相关ILD的发病率低,单纯用吉非替尼灌胃动物再现性差。本研究以博莱霉素建立ILD模型为基础,予吉非替尼干预,可以观察到吉非替尼对ILD动物模型肺纤维化程度的影响。因此,该模型是研究TKI相关性ILD的一个可靠的模型。但该模型仍有一定的局限性。博莱霉素诱导的肺纤维化按病理变化可分为4个阶段,14~28d为肺间质弥漫性纤维化期,故鼠肺纤维化实验通常需要观察到14d后,甚至更长[8]。在本动物实验中,高剂量吉非替尼联用组大鼠呈稀水样便,21d时较其他组大鼠体型明显瘦弱,死亡率高达73.3%。吉非替尼常见的药物不良反应中消化道症状发生率高达84.8%,其中腹泻占43.3%[9]。因此本研究认为,在吉非替尼干预博莱霉素诱导的大鼠肺纤维化动物实验中,消化道不良反应是严重影响动物存活率,增加非纤维化相关死亡的主要原因。这也是该模型有待解决及提高的方面。
吉非替尼可加重博莱霉素所致大鼠肺纤维化,该动物研究结果与既往大量临床实践中患者服用吉非替尼导致严重间质性肺炎的情况一致,这进一步肯定了吉非替尼可诱导ILD而非抑制ILD[10]。之前有学者提出,200mg/kg吉非替尼联用能抑制博莱霉素诱导的肺纤维化的结论,探究其原因,可能与纤维化模型建立成功与否及动物数量多少有关。本研究建立纤维化动物模型采用的是大鼠气管切开注射博莱霉素的方法,确保了博莱霉素通过气道进入肺从而致纤维化[11-12]。另一方面,各组动物避免了死亡导致的剩余样本量太少造成的误差。
在博莱霉素致纤维化的情况下,高剂量吉非替尼联用组大鼠纤维化病理改变明显加重(P<0.05),Masson染色示肺组织中胶原沉积明显增多,肺组织羟脯氨酸含量显著升高(P<0.05)。虽然中等剂量吉非替尼联用组Ashcroft评分较单纯气道内注入博莱霉素组差异无统计学意义(P>0.05),但羟脯氨酸含量有明显增加(P<0.05)。而低剂量吉非替尼联用组各项指标与博莱霉素组比较,差异无统计学意义(P>0.05)。以上研究结果提示,吉非替尼剂量越大加重纤维化的程度越高,呈剂量-效应关系。吉非替尼在临床应用中,其推荐剂量为250mg/d,且不因年龄、体质量以及基础疾病等原因对剂量进行调整。已有多项临床研究表明,既往患有低蛋白血症或肺间质纤维化等疾病会增加ILD发生的风险,其原因是否与吉非替尼血药浓度增加有关尚不清楚[13]。因此,笔者认为对每天服用250mg推荐剂量吉非替尼并伴有低体质量、营养不良或ILD病史的患者,吉非替尼的使用需谨慎。
综上所述,吉非替尼能加重博莱霉素所致大鼠肺纤维化,且吉非替尼剂量越大,大鼠肺纤维化程度越高。吉非替尼干预博莱霉素所致大鼠肺纤维化是研究TKI-ILD的一个可靠的模型,在此基础上可进一步探讨其效应及发病机制,探索临床TKI相关性ILD的干预措施,乃至开发有效治疗药物。
[1] Inoue A,Saijo Y,Maemondo M,et al.Severe acute interstitial pneumonia and gefitinib[J].Lancet,2003,361(9352):137-139.
[2] Cohen MH,Williams GA,Sridhara R,et al.FDA drug approval summary:gefitinib(ZD1839)tablets[J].Oncologist,2003,8(4):303-306.
[3] Shii Y,Fujimoto S,Fukuda T.Gefitinib prevents bleomycin-induced lung fibrosis in mice[J].Am J Respir Crit Care Med,2006,174(5):550-556.
[4] Wang P,Tian Q,Liang ZX,et al.Gefitinib attenuates murine pulmonary fibrosis induced by bleomycin[J].Chin Med J(Engl),2010,123(16):2259-2264.
[5] 李伟峰,李理,袁伟锋,等.吉非替尼抑制博莱霉素诱导的小鼠肺纤维化[J].中国病理生理杂志,2010,26(8):1565-1569.
[6] Ashcroft T,Simpson JM,Timbrell V.Simple method of estimating sever ity of pulmonary fibrosis on a numerical scale[J].J Clin Patho,1988,41(4):467-470.
[7] Hau J,Schapiro SJ,Van Hoosier GL Jr.Handbook of laboratory animal sience:animal models[M].Boca Raton,Fla,USA:CRC Press Inc,2003:28-30.
[8] 许祖德,张月娥,陈忠年,等.博莱霉素诱发大鼠肺纤维化时肺内间质细胞的变化[J].上海医科大学学报,1995,22(2):93-97.
[9] Forsythe B,Faulkner K.Overview of the tolerability of gefitinib (IRESSA)monotherapy:clinical experience in non-small-cell lung cancer[J].Drug Saf,2004,27(14):1081-1092.
[10] Jiang H.Overview of gefitinib in non-small cell lung cancer:an Asian perspective[J].Jpn J Clin Oncol,2009,39(3):137-150.
[11] Clark JG,Kostal KM,Marino BA.Bleomycin-induced pulmonary fibrosis in hamsters.an alveolar macrophage product increases fibroblast prostaglandin E2and cyclic adenosine monophosphate and suppresses fibroblast proliferation and collagen production[J].J Clin Invest,1983,72(6):2082-2091.
[12] 王昌明,何庆忠,张瑞祥.丹参酮对鼠肺纤维化过程中组织学变化的影响[J].中华结核和呼吸杂志,1994,17(5):308-310.
[13] Hotta K,Kiura K,Takigawa N,et al.Comparison of the incidence and pattern of interstitial lung disease during erlotinib and gefitinib treatment in Japanese patients with non-small cell lung cancer:the Okayama Lung Cancer Study Group experience[J].J Thorac Oncol,2010,5(2):179-184.

