不同厂家通便灵胶囊微生物限度检查方法学验证的探讨
郑兆显,张秀花,李瑞英,邱权义,王玉芝
(菏泽市食品药品检验中心,山东菏泽274032)
不同厂家通便灵胶囊微生物限度检查方法学验证的探讨
郑兆显,张秀花,李瑞英,邱权义,王玉芝
(菏泽市食品药品检验中心,山东菏泽274032)
目的通过对不同厂家同一品种的方法学验证,建立通便灵胶囊微生物限度检查方法。方法按《中国药典》2010版的要求。通过接种代表性的阳性菌株,用常规法及培养基稀释法对五株阳性菌进行回收率测定。结果该品种有抑菌性,采用培养基稀释法对五株阳性菌株回收率均高于70%。结论本样品微生物限度检查中,细菌检查可用培养基稀释法,霉菌酵母菌及控制菌检查可采用常规法。
通便灵胶囊;微生物限度检查;回收率;方法学验证
通便灵胶囊由番泻叶、当归、肉苁蓉三味中药组成,具有泄热导滞,润肠通便的功效,主要用于热结便秘、长期卧床便秘、一时性腹胀便秘、老年习惯性便秘等[1]。本品属纯中药制剂,副作用小价格便宜,是国家基本药物,使用量大,越来越受到患者的关注。笔者通过全国八家药品生产企业提供的微生物学方法验证资料发现(附表1),其中4家采用常规法,4家采用培养基稀释法。
1 实验材料
1.1 样品 样品1:通便灵胶囊,济南利蒙制药有限公司(批号:13030203);样品2:通便灵胶囊,新乡恒久远药业有限公司(批号:20111201);样品3:通便灵胶囊,天津飞鹰制药有限公司(1112010);样品4:通便灵胶囊,安徽济人药业有限公司(批号:121103);样品5:通便灵胶囊,贵州恒和制药有限公司(批号:130106);样品6:通便灵胶囊,上海北杰集团关东药业有限公司(批号:20121001);样品7:通便灵胶囊,广西迪泰制药有限公司(批号:20130901);样品8:通便灵胶囊,景忠山国药(唐山)有限公司(批号:130302)。
1.2 菌株 大肠埃希菌(Escherichia coli)[CMCC(B)44102],金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003],枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501],白色念珠菌(Candida albicans)[CMCC(F)98001],黑曲霉(Aspergillus niger)[CMCC(F)98003]。以上菌株均由中国药品生物制品检定所提供。
1.3 培养基与稀释液 营养琼脂培养基(批号:20130517)、玫瑰红钠琼脂培养基(批号:20130107)、营养肉汤培养基(批号:20130212)、改良马丁培养基(批号:20121026)、pH 7.0氯化钠蛋白胨缓冲液(批号:130201)等均由北京三药科技开发公司生产。
1.4 仪器 JY2002电子天平(上海精密科学仪器有限公司);YXQ-LS-505II立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);ClassⅡBSC生物安全柜(新加坡ESCD公司);ZF-2三用紫外线分析仪(上海永亭电子仪器厂);BPH-9272精密恒温培养箱(上海一恒科学仪器有限公司)。
2 方法与结果
2.1 菌液制备 将上述5种菌株的新鲜培养物分别接种至规定培养基中,大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌培养24 h、白色念珠菌培养48 h,黑曲霉培养5~7 d,按《中国药典》2010年版(一部)[2]附录方法制备菌(孢子)悬液,平行测定2皿培养计数,制成约为50~100 cfu·mL-1,备用。
2.2 供试液制备 取通便灵胶囊10 g,加pH 7.0无菌氯化钠-蛋白胨缓冲液至100 mL,摇匀,制成1∶10供试液。
2.3 细菌、霉菌及酵母菌计数方法验证
2.3.1 常规法 取“2.2”中供试液注皿,每皿1 mL,分别加入5株试验菌,测定回收率;同时做菌液组、稀释剂对照组及供试品的本底菌数,结果见表2。
2.3.2 培养基稀释法 取“2.2”中供试液注皿,每皿0.2 mL,分别加入5株试验菌,测定回收率;同时做菌液组、稀释剂对照组及供试品的本底菌数,结果见表3。
2.4 控制菌检查方法的验证,结果见表4。
2.4.1 供试品组 取“2.2”中供试液10 mL加入增菌液中,依相应控制菌检查方法检查,大肠菌群检查所加试验菌为大肠埃希菌。
2.4.2 试验组 取“2.2”中供试液10 mL及大肠埃希菌液10~100 cfu,加入增菌液中,依相应控制菌检查方法检查。
2.4.3 阴性菌对照组 取金黄色葡萄球菌液10~100 cfu加入增菌液中,依相应控制菌检查方法检查。
2.4.4 阴性对照组 取稀释液10 mL按相应控制菌检查方法检查。

表1 全国8家生产企业提供的微生物学方法验证及结果
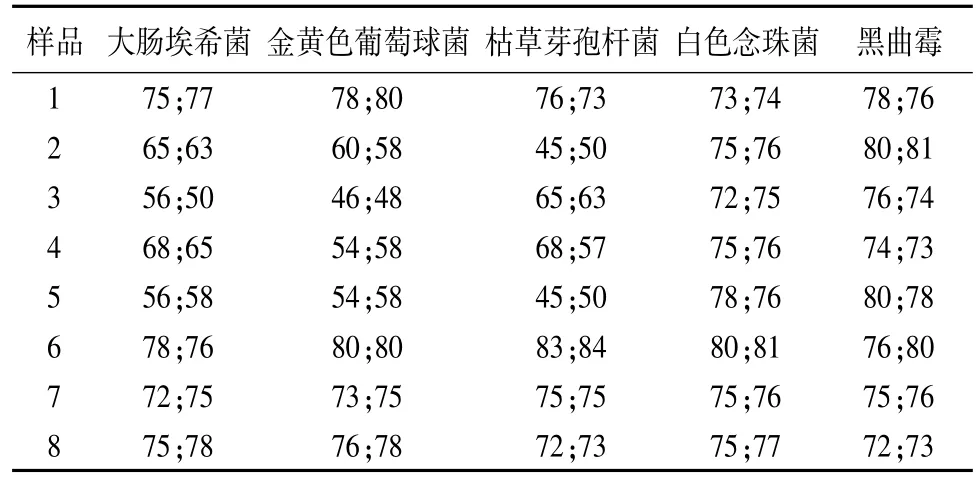
表2 常规法试验组的菌数回收率(%)
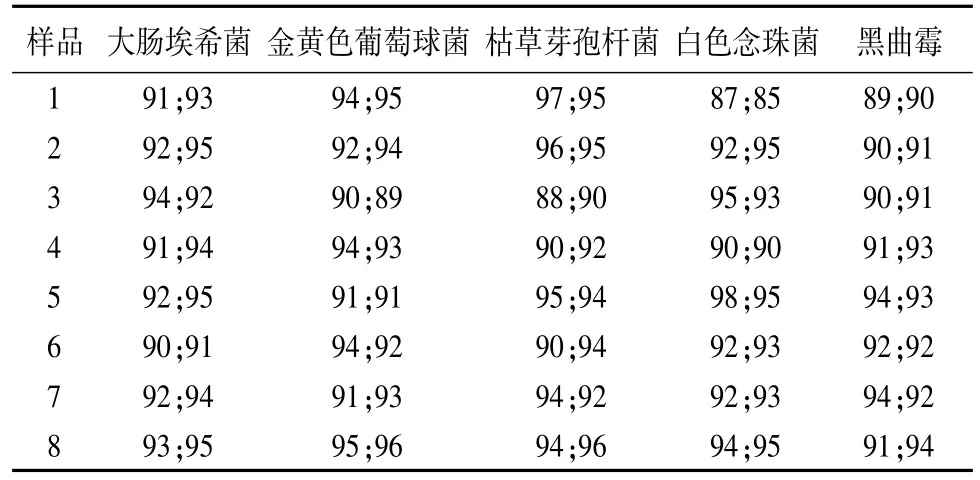
表3 培养基稀释法(0.2 mL/皿)试验组的菌数回收率(%)
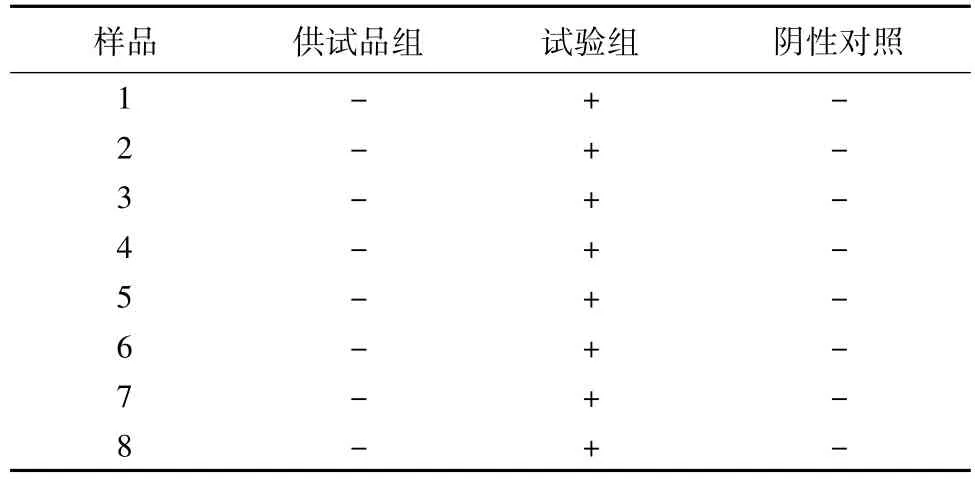
表4 常规法控制菌的方法验证
3 讨论
3.1 微生物限度检查法是检查非规定灭菌制剂及其原料、辅料受污染程度的方法[3]。进行药品微生物限度检查时,如果供试品有抑菌活性,应采用适宜的方法消除供试液的抑菌活性,再依法进行检验。[4]由于各个品种微生物指标不同,同品种不同厂家生产工艺也不一定完全相同,药典中微生物限度检查法未分列于各品种项下[5],因此,针对同品种不同厂家也应分别进行方法学验证,以确保方法的可靠性。
3.2 从表1可看出,同一品种不同厂家,验证方法略有不同。针对此问题我们分别用两种方法进行了验证。从表3可看出,稀释剂对照组的回收率均不低于于70%,说明符合验证要求,实验结果成立。从表2、表3可看出,两种方法的实验结果有显著差异,常规法大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆回收率有4家低于70%,白色念珠菌、黑曲霉回收率均不低于70%;培养基稀释法5种菌株的回收率均在90%左右,由此可见本品采用培养基稀释法进行微生物限度检查结果比较可靠。
3.3 通过比较分析,8家药品生产企业均采用的是同一标准,制备方法完全一致。由于生产环境、生产工艺、药材产地、培养基灵敏度等不同,最后导致方法学验证结果不一致。由此可见,当产品的组分或原检验条件发生改变可能影响检验结果时,计数方法应重新验证。
[1] 国家药典委员会.中华人民共和国卫生部药品标准——中药成方制剂(第七册)[S].北京:国家药典委员会,1993.
[2] 国家药典委员会.中华人民共和国药典2010版(一部)[S].北京:中国医药科技出版社,2010:附录79.
[3] 王伟娇,葛朝霞.头孢氨苄甲氧苄啶胶囊微生物限度检查方法验证[J].中国药品标准,2007,8(5):50-54.
[4] 袁林娜.布洛伪麻胶囊微生物限度检查方法验证试验研究[J].中国现代应用药学杂志,2007,24(3):229-231.
[5] 杜鹃,范兵,冯慰民,等.三类不同药品的微生物限度检验方法验证比较[J].药物分析杂志,2006,26(6):840-842.
Study on the validation ofm icrobial lim it testmethod for Tongbianling Capsules of differentmanufactures
ZHENG Zhao-xian,ZHANG Xiu-hua,LIRui-ying,QIU Quan-yi,WANG Yu-zhi
(Heze Center for Food and Drug Control,Heze 274032,China)
ObjectiveTo establish amicrobial limit testmethod of Tongbianling Capsules through the validation of differentmanufacturers of the same species verificationmethodology.MethodsThe recovery percent of five positive bacteria wasmeasured by inoculating representative positive strains using routinemethod and culturemedium dilutionmethod as the requirements of Chinese Pharmacopoeia,2010.ResultsThe studied object had antimicrobial properties and the recovery percent of the five positive bacteria are higher than 70%using culturemedium dilutionmethod.ConclusionBacteria detection can be tested by the culturemedium dilutionmethod,mold,yeast and control bacteria can be tested by routinemethod.
Tongbianling capsules;Microbial limit tests;Recovery;Methodology validation
R927.12
A
2095-5375(2014)08-0459-003
郑兆显,男,副主任药师,研究方向:药品检验,E-mail:zzx5067616@126.com

