颈动脉粥样硬化疾病的高分辨磁共振成像研究进展
王忠艳,高培毅,3,隋滨滨,3,林燕
颈动脉粥样硬化疾病是缺血性卒中的主要原因之一,动脉粥样硬化斑块的破裂、继发血栓形成以及血管栓塞是其主要的致病机制[1]。人们以往采用动脉管腔的狭窄严重性作为衡量动脉粥样硬化病变的严重程度,但是近期研究发现,即使轻度狭窄也能导致脑血管疾病临床事件的发生,那么关注斑块的形态及成分对于预测斑块的稳定性同样重要[2]。
目前用于斑块的影像检查方式有多种,如数字减影血管造影(digital subtraction angiography,DSA)、超声及计算机断层扫描血管造影(computed tomography angiography,CTA)等。北美和欧洲颈动脉内膜切除术研究中,DSA被证实为判断血管狭窄程度的金标准,DSA能够检测到的溃疡敏感性和特异性分别约45%和75%,超声检查斑块与病理性结果的相关性为46%~75%,CTA显示斑块内钙化和脂质核心成分与病理的整体符合程度约75%[3]。目前仍缺少一种理想的检查方式,可以对粥样硬化的斑块进行有效的解剖定位、评估影像学表现、判断不同程度斑块的预后及治疗效果。高分辨磁共振成像(highresolution magnetic resonance imaging,HRMRI)可以检测斑块组成成分的特征,例如区别脂质核心、纤维成分、钙化以及斑块内出血、溃疡等继发性改变,可以检测斑块内血栓形成以及继发血栓形成,还可以进行动脉粥样硬化病变进展与转归的成像,已经成为研究颈动脉粥样硬化病变最有前途的检查技术[4]。
1 高分辨磁共振成像技术
HRMRI依靠血流相对于周边软组织的信号强度,分为“黑血”和“亮血”序列,包括:三维时间飞跃法磁共振血管成像(threedimensional time-of-flight magnetic resonance angiography,3D-TOF MRA)、T1加权像(T1weighted imaging,T1WI)和增强后T1加权像(contrast enhanced-T1WI,CE-T1WI)、T2加权像(T2weighted imaging,T2WI)、质子密度加权像(proton density weighted imaging,PDWI)[5]。3D-TOF MRA是目前HRMRI中最常用的“亮血”成像技术,图像不仅能够进行后处理重建,还有助于观察斑块纤维帽破溃情况,是区别纤维帽破溃和表面钙化重要的成像序列之一[6]。“黑血”序列是使用预饱和脉冲抑制血流信号,应用双翻转恢复自旋回波(double-inversionrecovery spin echo,DIRSE)获得T1WI,双回波可同时获得T2WI和PDWI。各个序列均具有相应的显像优势,T1WI及T2WI图像有利于显示斑块的不均质成分,T1WI增强图像能较好地显示纤维帽及溃疡等斑块成分,而PDWI图像具有相对较高的对比度[3]。
2 颈动脉斑块定量评价
2.1 斑块负荷评价 斑块负荷被认为是与斑块“易损性”有关的重要因素之一,因为它可直接反映动脉粥样硬化病变的消长,管壁厚度、管壁面积(体积)是斑块负荷常用的评价指标[7]。Boussel等[8]进行超声和HRMRI对比研究动脉管壁厚度,发现两者具有同样高的可重复性,而颈动脉HRMRI比超声能更准确地检测到动脉粥样硬化疾病的早期病变。Yuan等[9]应用MRI对在体和离体动脉的血管管壁参数进行了多方面测定,证实了HRMRI对颈动脉粥样硬化病变的影像学测量与离体测量值误差较小。赵辉林等[10]运用高分辨黑血技术定量测定颈动脉斑块负荷与缺血性卒中的关系,表明基于MRI黑血技术的颈动脉血管壁的定量分析具有可行性,其中,管壁标准化指数(normalized wall index,NWI)[计算公式为管壁面积(wall area,WA)/血管总面积(total vessel area,TVA)]>0.53的病变血管更易导致显著的血管狭窄。NWI可以作为动态监测斑块进程的指标,能直观、有效地反映斑块进程和评价动脉粥样病变的程度以及管腔的狭窄程度。
2.2 动脉管壁内斑块成分的识别 动脉粥样硬化病变发展过程中的病理特点为病变含有细胞外脂质、泡沫细胞、钙沉积、纤维帽等,脑血管疾病临床症状的发生往往是由于动脉粥样硬化病变进展导致的管腔逐渐狭窄引起的缺血性改变[11]。HRMRI可以检测斑块内部形态,例如脂质或坏死核心、纤维成分、钙化、出血、溃疡等成分。Saam等[12]研究者使用1.5T HRMRI定量分析颈动脉粥样硬化斑块,结果显示HRMRI检测到的斑块组织成分与斑块病理高度符合。
美国心脏协会(Am e r ic an H ear t Association,AHA)依据动脉粥样硬化斑块内成分和结构连续变化的病理研究将动脉粥样硬化斑块进行了分类,并以此对不同进展的斑块进行了分期[13](图1)。这一修正的颈动脉粥样硬化斑块分类法为使用HRMRI对颈动脉粥样硬化斑块进行分期诊断提供了依据。
2.3 纤维帽及溃疡的定量分析 纤维帽的厚度(fiber cap thickness,FCT)是一个决定动脉粥样硬化斑块易损性的重要因素之一[14-15],研究显示HRMRI显示的纤维帽的厚度与组织学具有高度一致性[16]。还有研究显示,HRMRI同时检测到溃疡、薄的或破裂的纤维帽与颈动脉粥样硬化斑块患者发生脑缺血事件[短暂性脑缺血(transient ischemic attack,TIA)和卒中]具有很大相关性[17],因此HRMRI测量纤维帽的厚度对辨别斑块易损性和后期的预防治疗均具有重要的意义[16]。
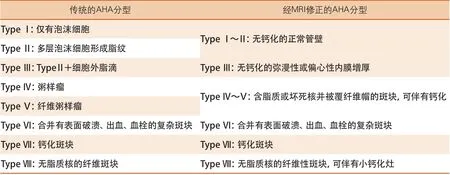
图1 动脉粥样硬化斑块的分类和分期
2.4 斑块转归评价 颈动脉粥样硬化患者临床上多使用降脂药物,这些药物对斑块预后有一定影响,Lee等[18]发现颈动脉粥样硬化患者使用烟酸类药物,HRMRI可以观测到颈动脉管腔面积和斑块体积的减少。Migrino等[19]研究证实经过6个月他汀类药物治疗,HRMRI显示颈动脉粥样硬化斑块的体积会减少,而超声检测的内膜中层厚度变化相对HRMRI有一定的滞后。HRMRI提供了一个新的短期内评估早期治疗效果的检查方式。
2.5 炎症反应的检测 巨噬细胞的堆积可以导致动脉粥样硬化的进展和急性并发症的发生,巨噬细胞的成像信息可以作为亚临床炎性改变的标志,预测未知危险,并有助于新的治疗方案的评估[20]。HRMRI可通过采用超顺磁性的靶向制剂(ultrasmall superparamagnetic particles of iron oxide,USPIO)进行斑块的扫描,巨噬细胞可以吞噬该靶向制剂,使得斑块内局部信号强度下降。这一方法可塑造斑块进展模型,也可以用于检测治疗动脉粥样硬化斑块方法的效果[21]。
2.6 血流动力学检测 Yang等[22]证实血液的流速在斑块进展中与管壁的厚度和管腔切应力有很大相关性。经HRMRI可以得到管壁切应力[23]、静态压改变、局部血液紊流等多种血流动力学指标。
3 血管内线圈技术
随着HRMRI技术的发展,血管内磁共振线圈的出现使表面线圈无法完成的深部动脉成像成为可能。血管内线圈分为环形线圈、无环天线线圈、多级线圈等,其中无环天线线圈又称为磁共振成像导丝(magnetic resolution imaging guidewire,MRIG),已逐步应用于介入治疗和基因治疗等研究[24]。血管内线圈可以有效地进行管腔/壁血管面积测量、斑块内成分显示,与病理解剖具有较高的一致性[25]。但目前,血管内线圈存在影像的运动伪影、血液流动导致的移位及局部温度升高等技术问题,有待进一步的研究[26]。
综上所述,HRMRI不仅能够检测动脉粥样硬化斑块负荷(管壁厚度、管腔面积),同时能很好地显示斑块内成分,判断影响斑块易损性的重要因素,预测未来临床事件的发生,同时由于其检测的有效性和灵敏性,可进行有效的斑块转归评价,显示药物或其他治疗手段的效果。
1 Kwee RM, Truijman MT, van Oostenbrugge RJ, et al. Longitudinal MRI study on the natural history of carotid artery plaques in symptomatic patients[J]. PLoS One, 2012, 7:1-4.
2 Gury-Paquet L, Millon A, Salami F, et al. Carotid plaque high-resolution MRI at 3.0T:evaluation of a new imaging score for symptomatic plaque assessment[J].Magn Reson Imaging, 2012, 30:1424-1431.
3 Hermus L, van Dam GM, Zeebreqts CJ. Advanced carotid plaque imaging[J]. Eur J Vasc Endovasc Surg,2010, 39:125-133.
4 Corti R, Fuster V. Imaging of atherosclerosis: magnetic resonance imaging[J]. Eur Heart J, 2011, 32:1709-1719.
5 Oppenheim C, Naggara O, Tonzè E, et al. Highresolution MR imaging of the cervical arterial wall:What the radiologist needs to know[J].RadioGraphics, 2009, 29:1413-1431.
6 王庆军, 蔡剑鸣, 蔡幼铨, 等. 高分辨颈动脉粥样硬化斑块磁共振成像[J]. 中国医学影像学杂志, 2011, 19:168-173.
7 赵辉林. 颈动脉粥样硬化斑块3.0T MRI临床研究[D].上海:上海交通大学, 2007.
8 Boussel L, Serusclat A, Skilton MR, et al. The reliability of high resolution MRI in the measurement of early stage carotid wall thickening[J]. J Cardiovasc Magn Reson, 2007, 9:771-776.
9 Yuan C, Beach KW, Smith LH Jr, et al. Measurement of atherosclerotic carotid plaque size in vivo using high resolution magnetic resonance imaging[J]. Circulation,1998, 98:2666-2671.
10 赵辉林, 刘晓晟, 许建荣, 等. 应用3.0T MRI定量评价颈动脉斑块负荷与缺血性脑卒中的关系[J]. 中国医学计算机成像杂志, 2009, 15:13-17.
11 Yuan C, Mitsumori LM, Ferquson MS, et al. In vivo accuracy of multispectral magnetic resonance imaging for identifying lipid-rich necrotic cores and intraplaque hemorrhage in advanced human carotid plaques[J].Circulation, 2001, 4:2051-2056.
12 Saam T, Ferguson MS, Yarnykh VL, et al. Quantitative evaluation of carotid plaque composition by in vivo MRI[J]. Arterioscler Thromb Vasc Biol, 2005, 25:234-239.
13 Cai JM, Hatsukami TS, Ferquson MS, et al.Classification of human carotid atherosclerotic lesions with in vivo multicontrast magnetic resonance imaging[J]. Circulation, 2002, 106:1368-1373.
14 Fuster V, Fayad ZA, Moreno PR, et al. Atherothrombosis and high-risk plaque part II:approaches by noninvasive computed tomographic/magnetic resonance imaging[J].J Am Coll Cardiol, 2005, 46:1209-1218.
15 Li ZY, Howarth SP, Tang T, et al. How critical is fi brous cap thickness to carotid plaque stability? A fl ow plaque interaction model[J]. Stroke, 2006, 37:1195-1199.
16 Qian D, Bottomley1 PA. High-resolution intravascular magnetic resonance quantification of atherosclerotic plaque at 3T[J]. J Cardiovasc Magn Reson, 2012, 14:20.
17 Kwee RM, van Oostenbrugge RJ, Mess WH, et al. MRI of carotid atherosclerosis to identify TIA and stroke patients who are at risk of a recurrence[J]. J Magn Reson Imaging, 2013, 37:1189-1194.
18 Lee JM, Robson MD, Yu LM, et al. Effects of highdose modif i ed-release nicotinic acid on atherosclerosis and vascular function:a randomized, placebocontrolled, magnetic resonance imaging study[J]. J Am Coll Cardiol, 2009, 54:1787-1794.
19 Migrino RQ, Bowers M, Harmann L, et al. Carotid plaque regression following 6-month statin therapy assessed by 3T cardiovascular magnetic resonance:comparison with ultrasound intima media thickness[J]. J Cardiovasc Magn Reson, 2011, 13:37.
20 Morishige K, Kacher DF, Libby P, et al. Highresolution magnetic resonance imaging enhanced with superparamagnetic nanoparticles measures macrophage burden in atherosclerosis[J]. Circulation,2010, 122:1707-1715.
21 王非, 耿道颖. USPIO增强MRI在检测颈动脉易损斑块炎性反应中的作用[J]. 国际医学放射学杂志, 2008,31:232-234.
22 Yang C, Canton G, Yuan C, et al. Impact of fl ow rates in a cardiac cycle on correlations between advanced human carotid plaque progression and mechanical fl ow shear stress and plaque wall stress[J]. Biomed Eng Online, 2011, 13:1-10.
23 Sui B, Gao P, Lin Y, et al. Noninvasive determination of spatial distribution and temporal gradient of wall shear stress at common carotid artery[J]. J Biomech,2008, 41:3024-3030.
24 孟延锋, 吕行, 谷会东, 等. 血管内磁共振成像及治疗[J].国际医学放射学杂志, 2008, 31:367-371.
25 Zhao L, Zhang C, Ma XH, et al. Feasibility of using intravascular loopless monopole antenna to image atherosclerotic plaque in a porcine model with 3.0T magnetic resonance imaging[J]. Chin J Cardiol, 2013,42:411-415.
26 Yuan H, Lv X, Ma X, et al. An intravascular loopless monopole antenna for vessel wall MR imaging at 3.0 T[J]. Magn Reson Imaging, 2013, 31:150-155.

