磁敏感加权成像对大面积脑梗死后出血转化早期诊断临床价值的预探索研究
刘远洪,牛智领,梁金花,马娜,张盼盼,刘乐喜,聂志余
既往对脑梗死后出血转化(hemorrhagic transformation,HT)的检测主要依赖于头颅计算机断层扫描(computed tomography,CT),但其敏感性、特异性仅为63.0%和57.7%[1]。磁敏感加权成像(susceptibilityweighted-imaging,SWI)是近年发展起来的一项新的用于脑血管病的诊断技术,因其对血液及其代谢产物敏感,故对脑微出血有很高的诊断价值[2],已被用于急性脑梗死溶栓治疗后HT和蛛网膜下腔出血的研究[3-4]。目前国内外采用SWI诊断大面积脑梗死后HT的研究较少[5],本研究通过对大面积脑梗死患者的SWI和CT检查对比分析,旨在探讨SWI在早期诊断大面积脑梗死后HT中的应用价值。
1 对象与方法
1.1 研究对象 采用前瞻性研究,连续入组2011年6月~2013年6月在我院神经内科住院的大面积脑梗死患者。入选标准:①符合1995年全国第四届脑血管病学术会议通过的脑梗死诊断标准[6],经头颅磁共振成像(magnetic resonance imaging,MRI)确诊的急性大面积脑梗死;②非溶栓治疗患者;③经医院伦理委员会批准,患者同意并签署知情同意书。排除标准:①病情危重不能耐受MRI、CT检查者;②由于外伤、颅内肿瘤和各种因凝血功能异常等导致的颅内出血;③脑血管畸形、颅内海绵状血管瘤、颅内动脉瘤患者;④严重肝、肾功能不全及不合作的患者。大面积脑梗死的定义[7]:磁共振弥散加权成像(diffusion weighted imaging,DWI)梗死灶最大直径≥5cm,并同时累及2个或2个以上脑叶。
1.2 方法
1.2.1 成像方法 于发病后72 h内复查多模式MRI,同日复查CT。①应用德国西门子MAGNETOM AVANTO 1.5T磁共振扫描仪。采用8通道头部表面线圈,MRI扫描序列包括:轴位T1加权像(T1weighted imaging,T1WI)、T2加权像(T2weighted imaging,T2WI)、DWI、SWI以及矢状位液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)成像,SWI序列的参数如下:重复时间(repetition time,TR):49 ms,回波时间(echo time,TE):40 ms,偏转角:15°,矩形视野(field of view,FOV):230,矩阵177×256,扫描层数:56,扫描层厚2 mm,层间距0.5 mm,三维采集后用最小密度投影(minimum-intensity projection,mIP)技术进行薄层重建,层厚5 mm。②应用德国西门子SOMATOM Definition 64排螺旋CT进行头颅扫描。对所采集的所有数据进行后处理得到最终的图像。依据CT或MRI SWI序列层面确诊HT,HT在SWI上表现为梗死区内或边缘出现斑点、线条或团片状显著低信号影,T1WI上表现为低信号的梗死区内斑片状或团片状的高信号灶[8];在CT上表现为在原有低密度梗死灶内出现点、线状及小片状的高密度灶。参考欧洲协作性急性卒中研究(European Cooperative Acute Stroke Study,ECASS)脑梗死HT的CT分型标准[9]将HT分为出血性梗死(hemorrhagic infarction,HI)和脑血肿形成(parenchymal hemorrhage,PH);HI又分为小点状出血的HI-1型和多个融合点状出血的HI-2型;PH又分为有血肿形成、占位效应轻、小于或等于梗死面积30%的PH-1型及血肿超过梗死面积30%且有明显占位效应或远离梗死区出血的PH-2型。
1.2.2 神经功能缺损评价 在行MRI检查前(发病72 h内)采用美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)进行患者神经功能缺损评价。
1.2.3 收集患者的性别、年龄等一般资料,以及有无高血压、糖尿病、心房颤动、吸烟、饮酒、卒中病史等[10],吸烟是指每天至少吸1支烟,并持续6个月以上;饮酒是指在过去1年内平均每周摄入酒精量≥8 g(酒精量)。
研究中的临床资料由神经内科临床医师收集,NIHSS评分由经过量表培训合格的2名神经内科医师完成;影像学结果的判断由2名影像医师完成;均为盲法评估,意见不一致时,会商解决。
1.2.4 统计学分析 应用SPSS 16.0统计学分析软件,计数资料用百分数表示,采用χ2检验,配对资料采用McNemar检验,半计量资料采秩和检验,正态分布的计量资料用s表示,非正态分布的用中位数和四分位数表示,采用单因素方差分析;对CT和MRI诊断的一致性进行Kappa检验;大面积脑梗死HT程度与NIHSS评分相关性采用Spearman相关性分析。P<0.05为差异具有显著性。
2 结果
研究共纳入符合入组标准的大面积脑梗死患者39例,其中,男22例,女17例,平均年龄(66.62±11.01)岁。患高血压病15例(38.46%),高脂血症9例(25.00%),糖尿病9例(25.00%),心房颤动10例(27.78%),脑梗死8例(22.22%),脑出血1例(2.78%),短暂性脑缺血发作1例(2.78%),吸烟8例(22.22%)、饮酒9例(25.00%)。
2.1 出血转化的检出 39例急性大面积脑梗死患者SWI发现HT24例,而CT扫描发现HT5例;发病72 h内,SWI、CT两种方法诊断脑梗死后HT的阳性率分别为61.54%和12.82%,经McNemar检验,SWI对脑梗死HT的检查阳性率明显高于CT(P<0.001),而且从脑梗死后HT的亚型可以看出SWI较CT检出HT的面积更大、更敏感(表1)。图1显示一患者CT检查仅见脑梗死灶内点状出血,为出血转化HI-1型,而同日MRI SWI可见脑梗死灶内的出血灶比脑CT显示的出血面积更大,为HI-2型。另外,经Kappa检验SWI、CT两种方法检出脑梗死后HT亚型的一致性一般,Kappa值为0.45。
2.2 NIHSS评分与SWI序列检出HT分级相关性 本组39例大面积脑梗死病例于发病72 h内行神经功能缺损NIHSS评分,4~22分,其中位数14(7,19)分,经SWI检出的HT患者24例中1级5例(12.82%);2级10例(25.64%);3级6例(15.48%);4级3例(7.69%)。经Spearman相关性分析,基于SWI序列的HT分级与临床NIHSS评分之间有良好的正相关性(R=0.94,P<0.01)(图2)。

表1 两种方法检出的脑梗死后出血转化亚型
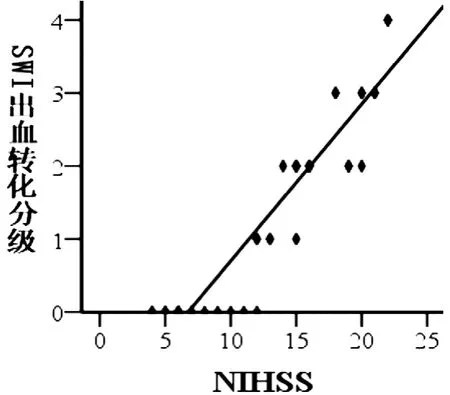
图2 HT的分级与NIHSS的相关性
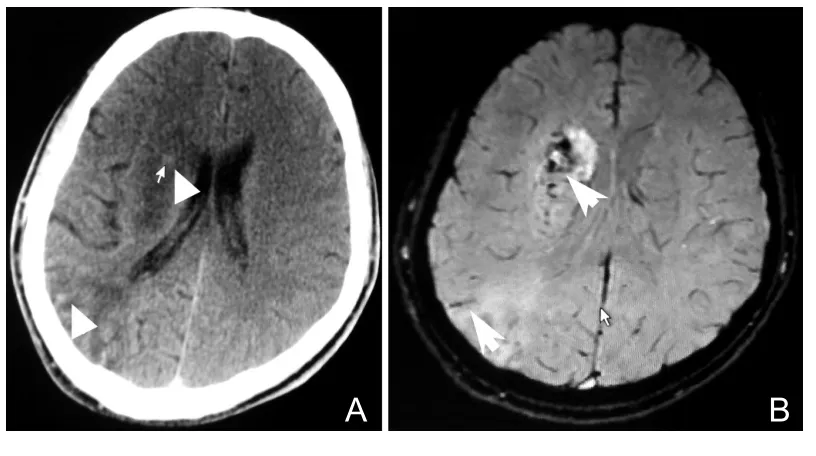
图1 患者同日MRI SWI和CT的检查显示的出血转化特点
3 讨论
大面积脑梗死易发生HT,多数患者为无症状性HT,但如果不能及时发现处理可能导致出血量增加,严重者可导致病情急剧恶化,甚至导致患者死亡,因此,早期检出大面积脑梗死后HT对及时调整制订临床治疗方案起着至关重要的作用[11-12]。一般脑梗死后HT的发生率为3%~43%,而大面积脑梗死后出血发生率为30%~76.1%[13],各报道差异较大可能与大面积脑梗死的定义不统一及检测时间不一致有关。值得注意的一点是,过去依赖脑CT诊断大面积脑梗死后HT可能是低估了大面积脑梗死后HT的发生率。Arnould等[14]比较CT和3种MRI序列检测脑梗死后出血的敏感性,发现MRI检测出血较CT敏感,梯度回波T2*加权成像(gradient-echo T2*-weighted imaging,GRE-T2*WI)检测出血较常规MRI序列更敏感。SWI的出现进一步提高了磁共振对脑梗死后HT的诊断水平,它是一种梯度回波序列,与常规序列相比具有高分辨率、完全流动性补偿、三维采集和薄层重建等特点。SWI图像能更加突出组织间磁敏感性的差异,对红细胞不同时期的降解成分如含氧血红蛋白、去氧血红蛋白、正铁血红蛋白、含铁血黄素及铁离子沉积的检出比较敏感。
国内、外研究均显示SWI序列扫描对脑梗死后HT的检出率明显高于CT扫描;SWI序列在对出血灶面积的判断上较CT扫描准确性更高[15-16],但关于SWI对大面积脑梗死后HT的研究报道较少。本研究显示CT检测大面积脑梗死后72 h内HT阳性率仅为12.82%,而SWI检测的HT阳性率则为61.54%,SWI检出的24例HT病例多表现为点状、线状、斑片状及团块状低信号,为HI-2型或PH-1型。CT检出的5例病例表现为低密度的病灶内出现散在的点状或片状高密度,多为HI-1型,说明SWI对梗死后HT的检出比CT更敏感,能检测出脑梗死后早期微量的脑CT不能发现的出血,这对早期确诊
脑梗死后HT有非常大的价值。对脑CT检查能发现的脑梗死后HT,SWI检测到的脑出血灶的范围比CT检测到的要大,因此,SWI能更真实地反映脑梗死后的HT。国外学者Wycliffe等[17]报道在脑梗死伴少量出血时,SWI序列最早可显示23 min内的脑出血灶,SWI敏感性明显优于CT,本研究结果支持这一观点。
欧洲ECASS研究的脑梗死HT的CT分型标准[9]是目前广为应用的脑梗死后HT的分型方法,在一些脑梗死后HT的磁共振研究中也使用欧洲ECASS分型方法[18],ECASS分型是否适应于磁共振尚未见研究报道,本研究将欧洲ECASS的脑梗死HT的CT分型标准用于磁共振SWI(表1),经Kappa一致性检验,SWI、CT两种方法检出的脑梗死后HT亚型的一致性一般。但基于SWI序列的脑梗死后HT分级与临床NIHSS评分的变化有良好的正相关性(R=0.94,P<0.01),脑梗死后HT分级越高则临床症状越重,表明脑梗死后HT欧洲ECASS分型标准,不但适用于脑梗死后的CT检查,也同样适用于SWI检查。
总之,SWI筛查大面积脑梗死患者急性期内HT优于常规的CT扫描,对临床症状重、NIHSS评分高的患者、特别是大面积脑梗死患者应在急性期行SWI检查,以及早发现脑梗死后HT,以指导临床及时调整治疗方案。本研究存在的不足是样本量小,只是一个预探索研究,对各型脑梗死后HT进行亚组分析时,有的组例数太少,统计分析可能会产生偏差。我们将进一步扩大样本量进行深入研究。
1 Berger C, Fiorelli M, Steiner T, et al. Hemorrhagic transformation of ischemic brain tissue, asymptomatic or symptomatic?[J]. Stroke, 2001, 32:1330-1335.
2 Huang P, Chen CH, Lin WC, et al. Clinical applications of susceptibility weighted imaging in patients with major stroke[J]. J Neurol, 2012, 259:1426-1432.
3 Lu J, Li YH, Li YD, et al. The clinical value ofantiplatelet therapy for patients with hemorrhage after thrombolysis based on susceptibility-weighted imaging:a prospective pilot study[J]. Eur J Radiol, 2012,81:4094-4098..
4 Verma RK, Kottke R, Andereggen L, et al. Detecting subarachnoid hemorrhage:comparison of combined FLAIR/SWI versus CT[J]. Eur J Radiol, 2013, 82:1539-1545.
5 潘林华, 朱成芳, 徐玉萍, 等. 磁敏感加权成像在大面积脑梗死出血性转化中的临床应用价值[J]. 山东医药,2013, 53:49-51.
6 中华神经科学会, 中华神经外科学会. 各类脑血管疾病诊断要点[J]. 中华神经科杂志, 1996, 29:379-380.
7 黄如训, 郭玉璞. 2000年广州全国脑血管病专题研讨会脑卒中的分型分期治疗(建议草案)[J]. 现代实用医学,2003, 15:592-594.
8 Nandigam RN, Viswanathan A, Delgado P, et al. MR imaging detection of cerebral microbleeds:effect of susceptibility-weighted imaging, section thickness,and field strength[J]. AJNR Am J Neuroradiol, 2009,30:338-343.
9 Fiorelli M, BastianeUo S, von Kunmaer R, et al.Hemorrhagic transformation within 36 hours of a cerebral infarct:relationships with early clinical deterioration and 3-month outcome in the European Cooperative Acute Stroke Study I (ECASS I) cohort[J].Stroke, 1999, 30:2280-2284.
10 Paciaroni M, Agnelli G, Corea F. Early hemorrhagic transformation of brain infarction:rate, predictive factors, and inf l uence on clinical outcome:results of a prospective multicenter study[J]. Stroke, 2008, 39:2249-2256.
11 陈立云, 王拥军, 赵性泉. 脑梗死后出血性转化的研究进展[J]. 中国卒中杂志, 2006, 1:904-906.
12 Sussma n ES, Con nol ly ES. Hemorrhag ic transformation:a review of the rate of hemorrhage in the major clinical trials of acute ischemic stroke[J].Front Neurol, 2013, 4:69
13 Choi KH, Park MS, Kim JT, et al. The serum ferritin level is an important predictor of hemorrhagic transformation in acute ischemic stroke[J]. Eur J Neurol, 2011, 19:570-577.
14 Arnould MC, GrandinCB, Peeters A, et al. Comparison of CT and three MR sequences for detecting and categorizing early (48 hours) hemorrhagic transformation in hyperacuter ischemic stroke[J]. AJNR Am J Neuroradiol, 2004, 25:939-944.
15 朱成方, 潘林华, 刘丰春. 磁敏感加权成像在脑梗死出血性转化及预后中的应用价值[J]. 实用医技杂志, 2012,19:271-272.
16 Lu J, Li YH, Li YD, et al. The clinical value of antiplatelet therapy for patients with hemorrhage after thrombolysis based on susceptibility-weighted imaging:a prospective pilot study[J]. Euro J Radiol,2012, 81:4094-4098.
17 Wycliffe ND, Chee J, Hoishouser B, et al. Reliability in detection of hemorrhage in acute stroke by a new three-dimensional gradient recalled echo susceptibilityweighted imaging technique compared to computed tomography:a retrospective study[J]. J Magn Reson Imaging, 2004, 20:372-377.
18 杨飞, 崔书君, 刘怀军, 等. 脑梗死后出现转变的CT、MRI比较[J]. 实用放射学杂志, 2011, 27:1632-1635.

