氟甲喹在罗非鱼肌肉组织的消除规律
廖治锋,段新华
(深圳市南山区动物防疫监督所,广东深圳518051)
氟甲喹属第2代喹诺酮类抗菌药,结构上属于萘啶酸类药物,最早由Rinker实验室研制成功。其主要作用机制在于抑制细胞复制所必须的DNA旋转酶,从而阻断细菌DNA的复制而呈快速杀菌功效[1]。随着具有更广杀菌谱和更广的组织分布性的第3代喹诺酮类药物的出现,氟甲喹已经在人医上停止使用。但由于其治疗成本较低而且对各种大肠埃希菌、沙门菌和巴氏杆菌等细菌感染所致的疾病具有良好的疗效,故仍然广泛用于治疗畜禽和水产动物全身感染的疾病[2-3]。欧盟EMEA推荐其在动物的治疗剂量为每周6mg/kg~18mg/kg体重[4]。我国也在20世纪90年代末逐渐在兽医临床上推广应用。
我国是世界上主要的罗非鱼生产大国,氟甲喹广泛应用于罗非鱼细菌性疾病,如弧菌病、疖病和肠炎等的防治。然而,尽管氟甲喹在水产中使用广泛,国内外对其在水产上的消除规律和残留的研究较少[5-6],在罗非鱼体内的研究尚没有报道。鉴于此,本文采用高效液相色谱法研究单次口服给药后的氟甲喹在罗非鱼体内的残留消除规律研究,期望能为合理用药,制定合理的休药期提供科学的依据,并为氟甲喹在罗非鱼体内的残留监控提供科学的手段。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 氟甲喹标准品(含量100%),为Sigma公司产品;氟甲喹原料药,由华南农业大学实验兽药厂提供(含量为98.3%);乙腈、水均为色谱级;正己烷、无水硫酸钠、乙酸乙酯,磷酸等为均分析纯级。
1.1.2 主要仪器 1100型高效液相色谱仪(配备荧光检测器)为美国Agilent公司产品;FJ-200型高速分散均质机为上海标本模具厂产品;Eppendorf 5804超速离心机、AB204-N型电子分析天平为梅特勒集团产品;旋转蒸发仪、MS2型微型混合器、HS250Basic型多功能振荡器为马来西亚IKA公司产品。
1.1.3 试验用动物 试验用健康罗非鱼由广州白云区江高渔场提供。体重293g/尾±37.5g/尾,试验前放置在塑料养殖桶中饲养,每桶房置健康罗非鱼6尾,连续通气,循环用水,水温为29℃~31℃,盐度为28~29,暂养1周适应试验环境,试验前24h限饲,给药后12h后每天按体重的0.5%投喂饲料2次。试验期间按体重的1%投喂不含药物的饲料。
1.2 方法
1.2.1 试验设计及组织样品的采集 试验前随机抽取空白鱼的带皮肌肉组织检测,确认鱼体内不含氟甲喹后进行试验。按照10mg/kg剂量,用前端钝圆的细塑料导管插入试验鱼前肠灌服,无回吐的放回桶内。分别于给药后3、6、9、12、24、48、72、96、120、144、168h采集罗非鱼的带皮肌肉组织,置于-20℃冰箱保存至测定。每个时间点采样6尾。
1.2.2 罗非鱼皮肤和肌肉混合组织样品的预处理称取2g±0.05g搅碎的皮肤和肌肉混合组织,置于50mL塑料离心管中。加干燥的乙酸乙酯12mL,无水硫酸钠2g,10 000r/min匀浆1min。振荡混合5min,3 000r/min离心10min,上清液转入茄形瓶中。残渣重复提取1次,上清液合并于茄形瓶中,50℃~55℃旋转蒸发至干,用2mL的流动相、2mL的正己烷溶解残余物,转入15mL的离心管中,3 000r/min离心10min,取下层清液,作为试样溶液,供高效液相色谱分析[7]。
1.2.3 色谱条件的选择 色谱柱为大连 HypersilBDS-C18(250mm×4.6mm i.d,粒径5μm,大连伊利特公司)。柱温30℃。流动相0.02mol/L磷酸溶液∶乙腈∶四氢呋喃=69∶16∶15,用前过0.45μm 滤膜。流速:1.0mL/min。检测波长,激发波长325nm;发射波长369nm。进样量20μL。1.2.4 标准曲线和最低检测限检测限 准确称量0.01g干燥恒重的氟甲喹对照品于10mL容量瓶中,用甲醇定容配制成1mg/mL的标准储备液,于4℃保存备用。在空白组织中加入浓度为0.02、0.05、0.1、0.2、0.5、1.0、2.0μg/mL的系列标准工作液后,按1.2.1的方法处理后,供 HPLC分析。将氟甲喹的色谱峰面积(纵坐标)与组织中加入标准液浓度(横坐标)进行回归分析,求出回归方程及相关系数。以3倍信噪比作为药物浓度的最低检测限。
1.2.5 回收率与变异系数 分别在空白组织中加入氟甲喹,制得终浓度为0.02、0.2、2.0μg/mL的氟甲喹添加样品。按1.2.1的方法处理后,供HPLC分析。每个浓度做6个重复,共做3个批次。将其峰面积和标准工作液峰面积之比计算回收率,并通过添加样品的实测浓度计算批内和批间变异系数。
1.2.6 数据处理及休药期的计算 计算每个时间点6尾鱼带皮肌肉组织的药物浓度的平均值和标准差,得到各个时间点的平均药物浓度。药物的消除方程C=Me-βt可通过浓度的对数转换和最少二乘法回归求得。休药期的计算通过欧洲兽药委员会制定的专业软件WT1.4求得。
2 结果
2.1 氟甲喹的色谱行为
用本试验建立的色谱条件测定组织中的氟甲喹准确度高、分离度好。在设定的色谱条件下,峰形良好,基线平稳,无干扰峰出现,氟甲喹的保留时间约为11.4min(图1)。

图1 氟甲喹的液相色谱图色谱图Fig.1 HPLC chromatogram of flumequine test sample after 96hadministration
2.2 检测方法的验证结果
在本试验的样品预处理和色谱条件下,该标准曲线在0.02μg/mL~2.0μg/mL浓度范围内呈现较好的线性关系(R2=0.999 8,图2),检测限为8ng/g。在0.02、0.2、2.0μg/mL 3个添加浓度下,回收率的范围在73%~83%,批内变异系数为3.61%~5.91%,批间变异系数为4.26%~5.49%。
2.3 药物在组织中的分布和消除
罗非鱼带皮肌肉组织给药后3h迅速到达较高水平,在9h的时候达到观测峰浓度,并以较为缓慢的速率消除,药物的药动学参数见表1。药物在组织中的吸收和消除过程如图3所示。氟甲喹在罗非鱼体内的药物浓度经过对数变换和线性回归得到消除方程LnC=-βt+LnM 的截距a=6.861 5,斜率b=-0.015 2。相关系数r=0.906 6。并得到其消除半半衰期为45.59h。

图2 氟甲喹标样浓度与峰面积的线性关系Fig.2 Linear calibration of flumequine standard samples and peak areas.

表1 罗非鱼单剂量口服氟甲喹(10mg/kg)后肌肉和皮肤的药动学参数Table 1 The pharmacokinetic parameters of fumequine in tilapia muscle plus skin after single oral administration at a dose of 10mg/kg
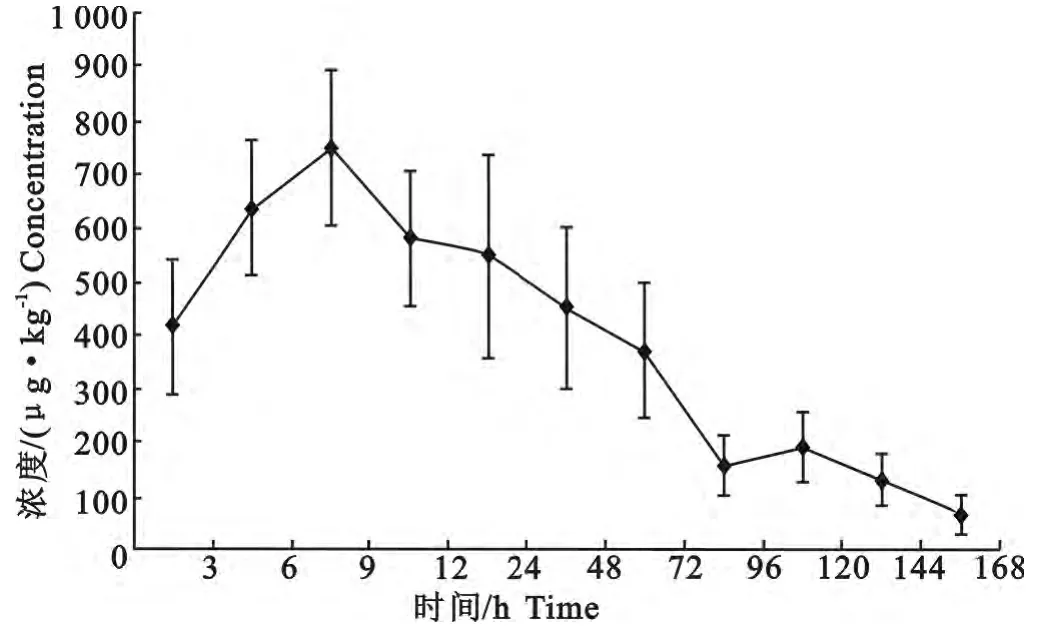
图3 氟甲喹在罗非鱼体内(肌肉和皮肤)的残留和消除曲线Fig.3 Mean concentration-time profiles of fumequine in tilapia muscle plus skin after oral administration of 10mg/kg(n=6)
2.4 休药期的计算
根据农业部第235号公告规定的氟甲喹在鱼类中的带皮肌肉组织的残留限量为500μg/kg,本试验按照欧洲兽药委员会制定休药期的专业软件WT 1.4求出氟甲喹在罗非鱼体内残留的休药期是95h。分析结果如图4所示。
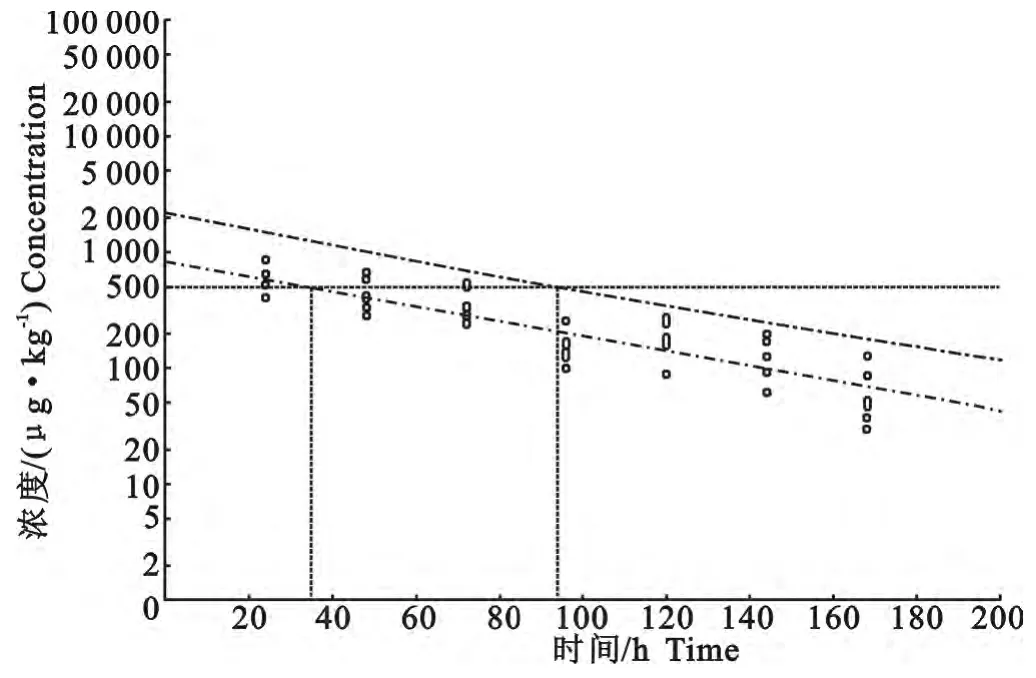
图4 氟甲喹在罗非鱼体内残留的休药期计算结果Fig.4 Plot of withdrawal period calculation for muscle plus skin of tilapia
3 讨论
3.1 氟甲喹在罗非鱼体内的消除规律
目前尚没有氟甲喹在罗非鱼体内药动学与残留的研究报道。已有的研究报道表明,氟甲喹在不同种鱼类体内的消除过程并不一样,而且非生物因素,如水温的变化,对药物在鱼体内的吸收、代谢存在较明显的影响。van der Heijden M H T等[8]比较了在同一水温下氟甲喹在鲤(Cyprinus carpio)、非洲鲇(Clarias gariepinus)和欧洲鳗鲡(Anguilla anguilla)体内的消除规律,其半衰期分别为104.3、59.5、451.2h,差异显著。Tyrpenou A E等[9]研究了在不同水温下Gilthead seabream对氟甲喹的消除规律,发现24℃时氟甲喹的休药期为75.84h,而18℃时氟甲喹的休药期为106.08h。
本试验单次给药10mg/kg给药后氟甲喹在肌肉和皮肤组织中的达峰时间为9h,表明该药在罗非鱼体内迅速吸收和分布。最高浓度为750.9μg/kg±148.4μg/kg。于给药96h后,全部观察浓度都低于500μg/kg,表明氟甲喹在罗非鱼体内的蓄积较小。这与氟甲喹在日本真鲈(Japanese seabass)、鳗鱼和鲤鱼的数据一致。Hu L L等[6]报道了氟甲喹在日本真鲈肌肉消除极快,以20mg/kg口服给药4d后,肌肉中药物浓度仅有0.020μg/g。梁增辉等[10]报道了10mg/kg氟甲喹尾静脉给药72h后,药物在鳗鱼可食用组织肌肉中的残留量21.8ng/g。Steinhof U等[11]以10mg/kg的给药剂量连续口服给药3d,停药36h后,鲤鱼肌肉组织中氟甲喹浓度低于600μg/kg,停药48h后,肝脏中氟甲喹浓度也低于600μg/kg。
3.2 氟甲喹的休药期
药物的休药期对不同的养殖动物是不同的,这是因为药物在不同的组织中的消除规律不同所致。另外药物的休药期也与该药物在养殖对象可食用组织的最高残留限量有关。根据我国农业部第235号公告,氟甲喹在鱼类可食用的肌肉和皮肤中的最高残留限量为500μg/kg。据此,本试验得出在水温为29℃~31℃时单剂量口灌10mg/kg剂量氟甲喹的休药期是95h。
由于水生生物属于变温动物,停药期与水温的变化密切相关,通常水温每升高1℃,药物的代谢与消除速度将提高10%[12-13]。本试验的水温较高的29℃~31℃,若在冬天水温显著下降,则氟甲喹对罗非鱼休药期应适当的延长。
[1]扈本荃,廉江平.兽用喹诺酮类药物的分类及其含量测定[J].动物医学进展,1998,19(2):14-16.
[2]刘 鸿,陆新浩,黄建勇,等.氟甲喹临床应用疗效观察[J].浙江畜牧兽医,2013(3):46.
[3]Touraki M,Niopas I,Ladoukakis E,et al.Efficacy of flumequine administered by bath or through medicated nauplii of Artemia fransiscana (L.)in the treatment of vibriosis in sea bass larvae[J].Aquaculture,2010,306(1-4):146-152.
[4]EMEA.Flumequine summary report (2),EMEA/MRL./fi24/99-FINAL.Available at:http://www.ema.europa.eu/docs/en-GB/document-library/Maximum-Residue-Limits-Report/2009/11/WC500014315.pdf.
[5]张海琪,何 欣,钱 鸣,等.氟甲喹在中华鳖日本品系组织中的残留代谢规律研究[J].西南大学学报:自然科学版,2013,35(9):35-42.
[6]Hu L L,Fang W H,Zhou K,et al.Pharmacokinetics,tissue distribution,and elimination of flumequine in japanese seabass(Lateolabrax japonicus)following intraperitoneal injection and oral gavage[J].Israeli J Aquaculture-Bamidgeh,2011,63(3):586-592.
[7]农业部畜牧兽医局.动物性食品中噁喹酸和氟甲喹残留检测方法(鱼)-高效液相色谱法[J].中国兽药杂志,2003,37(10):16-18.
[8]van der Heijden M H T,Keukens H J,van den Nieuwboer W H F X,et al.Plasma disposition of flumequine in common carp(Cyprinus carpio L.,1758),African catfish(Clarias gariepinus Burchell,1822)and European eel(Anguilla anguilla L.,1758)after a single peroral administration[J].Aquaculture,1994,123(1-2):21-30.
[9]Tyrpenou A E,Kotzamanis Y P,Alexis M N.Flumequine depletion from muscle plus skin tissue of gilthead seabream(Sparus aurata L.)fed flumequine medicated feed in seawater at 18 and 24℃[J].Aquaculture,2003,220(1-4):633-642.
[10]梁增辉,林黎明,刘靖靖,等.噁喹酸和氟甲喹在鳗鱼体内的药代动力学研究[J].海洋水产研究,2006,27(3):86-92.
[11]Steinhof U,Ebrecht A,Etzel V,et al.Residue depletion of flumequine in the carp after oral application[J].Arch fur Lebensmittelhygiene,2002,53(2):37-40.
[12]Liang J P,Li J,Zhao F Z,et al.Pharmacokinetics and tissue behavior of enrofl oxacin and its metabolite ciprofl oxacin in turbot Scophthalmus maximus at two water temperatures[J].Chinese J Oceanol Limnol,2012,30(4):644-653.
[13]Bjorklund H,Bylund G.Temperature-related absorption and excretion of oxytetracycline in rainbow trout(Salmo gairdneri R.)[J].Aquaculture,1990,84(3-4):363-372.

