小反刍兽疫病毒Tibet 07株P蛋白的真核表达及鉴定
王清华,赵文年,刘春菊,王淑娟,包静月*,王志亮*
(1.中国动物卫生与流行病学中心,山东青岛,266032;2新疆农业大学动物医学学院,新疆乌鲁木齐830000)
小反刍兽疫(Peste des petits ruminants,PPR)是山羊、绵羊和野生小反刍兽的一种急性病毒病,以发热,眼、鼻有分泌物,胃炎,腹泻和肺炎为特征。PPR是一种地方性流行疫病,先后在非洲、中东和亚洲发生和流行。我国西藏阿里和那曲地区分别于2007年和2008年暴发小反刍兽疫[1];2013年11月~12月,我国新疆暴发小反刍兽疫疫情。通过扑杀、大规模免疫、检疫和移动控制、野生动物控制等综合防控措施,上述疫情得到有效控制。
小反刍兽疫病毒(Peste des petits rumiants virus,PPRV)为单股负链RNA病毒,基因组大小为15 948个核苷酸,基因组3′末端为前导序列,5′末端为尾随序列,6个编码框基因排列顺序为3′-N-P-MF-H-L-5′,依次编码6个结构蛋白,即核衣壳蛋白(N)、磷蛋白(P)、基质蛋白(M)、融合蛋白(F)、血凝蛋白(H)和大蛋白(L),P基因还编码2个非结构蛋白C和V。P基因总长度为1 655个核苷酸,开放阅读框长度为1 530个核苷酸,编码509个氨基酸。P蛋白分子质量约为54.8ku[2],在病毒RNA的转录和复制过程中发挥作用。
本试验利用Bac-to-Bac杆状病毒表达系统,表达小反刍兽疫病毒西藏分离株Tibet 07的P蛋白,为进一步研究其生物学特性,研制特异性单抗奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒及细胞 大肠埃希菌DH10-BacTM、pFastBac/CT-TOPO载体以及昆虫传代细胞系sf 9为Invitrogen公司产品;大肠埃希菌DH 5α为宝生物工程(大连)有限公司产品;pGEM-T载体为Promega公司产品;PPRV Tibet 07株cDNA、PPRV阳性血清由中国动物卫生与流行病学中心外来病研究中心保存。
1.1.2 主要试剂 sf 900TMⅢSFM 培养基、Foetac Bovine Serum为Gibco公司产品;各种工具酶为NEB公司产品;Thermo Scientific PageRuler Prestained Protein Ladder、DAB Substrate为 Thermo公司 产 品;Pent-HisTMAntibody、QIAprep○RSpin Minprep Kit、QIAquick○RGel Extraction Kit 为QIAGEN公司产品;Bac-to-Bac TOPO Cloning Kit、PCR SuperMix、CellfectionⅡ○RReagent、Zy-MAXTMRabbit Anti-Goat IgG(H+L)-HRP、Rabbit Anti-Goat IgG-FITC、Triton X-100、CFM-PBS为Invitrogen公司产品;Genogure Plasmid Mid Kit、Expand High FidelityPlusPCR Stystem为Roche公司产品。
1.2 方法
1.2.1 P基因的PCR扩增及测序 根据Tibet 07毒株基因组序列设计扩增P基因的PCR引物,由上海生工生物工程技术服务有限公司合成,在上、下游引物中分别引入NcoⅠ和NotⅠ酶切位点,上游引物序列为:PF-NcoⅠ-bac 5′-CATGCCATGGCACCGATGGCAGAAGAACAAG-3′(下划线部分为NcoⅠ酶切位点),下游引物序列为:PR-NotⅠ-bac 5′-AAATAT GCGGCCGCCGGGTGCTTGGCGAGAATT-3′(下划线部分为NotⅠ酶切位点)。通过PCR从PPRV Tibet 07毒株cDNA中扩增P基因,扩增片段胶回收纯化后与pGEM-T载体连接,得到重组质粒pGEM-PPRV-P,双酶切鉴定为阳性的克隆,送上海生工生物工程技术服务有限公司测序。
1.2.2 重组穿梭质粒的构建 用NcoⅠ和NotⅠ双酶切pGEM-PPRV-P,补平末端,与pFastBac/CT-TOPO进行平末端连接,连接产物转化感受态大肠埃希菌DH 5α,PCR鉴定为阳性的克隆,送上海生工生物工程技术服务有限公司测序。测序正确的质粒命名为pFastBacCT-PPRV-P。
1.2.3 Bacmid DNA的获得 参考Bac-to-Bac杆状病毒表达系统(Invitrogen公司)技术手册,取测序正确的重组穿梭质粒pFastBacCT-PPRV-P转化MAX Efficiency感受态大肠埃希菌DH10Bac,蓝白斑筛选获得阳性菌落,使用Genogure Plasmid Mid Kit(Roche)提取重组杆状病毒DNA,经PCR鉴定,获得的重组杆粒命名为Bacmid-PPRV-P。
1.2.4 sf 9细胞的培养及转染 用Sf 900ⅡSFM培养基培养sf 9细胞,利用转染试剂CellfectionⅡ用重组杆粒Bacmid-PPRV-P转染sf 9细胞,当细胞出现CPE时,收集细胞,500r/min离心5min,取上清,即为第1代重组杆状病毒(P1),测定病毒滴度。
1.2.5 杆状病毒的扩增 将P1代重组杆状病毒以0.1moi感染sf 9细胞,72h后收获P2代病毒,测定病毒滴度。将P2代病毒传至P3代病毒,测定病毒滴度。
1.2.6 SDS-PAGE和 Western blot检测目的蛋白的表达 将P3代重组杆状病毒以5moi感染sf 9细胞(9×106cell/孔),27℃悬浮培养72h后,收获细胞冻融裂解,离心取细胞裂解液,加上样缓冲液后沸水煮5min,取样以120g/L分离胶进行SDSPAGE分析。将电泳后凝胶上的蛋白采用半干法转至硝酸纤维膜,用50g/L脱脂奶粉4℃封闭过夜。PPR阳性血清(1∶12 000稀释)为一抗,兔抗山羊IgG-HRP(1∶10 000稀释)为二抗,进行 Western blot鉴定,洗膜后用DBA显色。
1.2.7 间接免疫荧光试验 将P3代重组杆状病毒感染sf 9细胞72h后,弃去培养液,PBS洗3次,用40g/L多聚甲醛室温固定30min,PBS洗3次,用1g/L的Triton X-100通透15min,PBS洗3次,用10g/L BSA-PBS封闭30min,PBS洗3次。用抗PPRV阳性血清(1∶12 000稀释)室温孵育1h,PBS洗3次,加入FITC标记的兔抗山羊IgG(1∶70稀释),室温孵育1h,PBS洗3次,封片后在荧光显微镜下进行观察。
2 结果
2.1 P基因的扩增和重组克隆质粒的鉴定
P基因的扩增产物经10g/L琼脂糖凝胶电泳,可见约1 530bp的特异性片段。与预期结果相符,表明成功扩增了PPRV Tibet 07株的P基因。重组克隆质粒pGEMT-PPRV-P经NcoⅠ/NotⅠ双酶切,10g/L琼脂糖凝胶电泳,可见约1 530bp的目的基因片段,与预期结果相符。经测序,发现序列与目的基因序列完全一致,表明成功构建了pGEMPPRV-P载体(图1)。

图1 P基因的PCR扩增和重组克隆质粒pGEM-PPRV-P的酶切鉴定(NcoⅠ/NotⅠ)结果Fig.1 PCR amplification of P gene and enzyme digestion identification of recombinant plasmid pGEM-PPRV-P
2.2 重组穿梭质粒的鉴定
重组穿梭质粒pFastBacCT-PPRV-P用P基因扩增引物进行PCR扩增,可见约1 530bp的特异性片段,结果与预期相符。经测序,挑选方向正确且序列无突变的质粒进行后续试验。表明成功构建了pFastBacCT-PPRV-P载体(图2)。
2.3 重组杆粒的鉴定
重组杆粒Bacmid-PPRV-P用P基因扩增引物进行PCR扩增,可见约1 530bp的特异性片段,结果与预期相符。表明成功构建了重组杆粒Bacmid-PPRV-P(图3)。

图2 pFastBacCT-PPRV-P的PCR鉴定Fig.2 PCR identification of pFastBacCT-PPRV-P

图3 Bacmid-PPRV-P的PCR鉴定Fig.3 PCR identification of Bacmid-PPRV-P
2.4 融合蛋白的SDS-PAGE和Western blot结果
以5moi的P3代重组杆状病毒感染sf 9细胞后的细胞裂解液经120g/L分离胶的SDS-PAGE分析,可见分子质量约54ku的目的条带 (图4A)。经Western blot分析,在54ku处有特异性的印迹条带,在正常的sf 9细胞中没有该印迹条带 (图4B)。表明在昆虫细胞中成功表达了PPRV Tibet 07株的P蛋白。
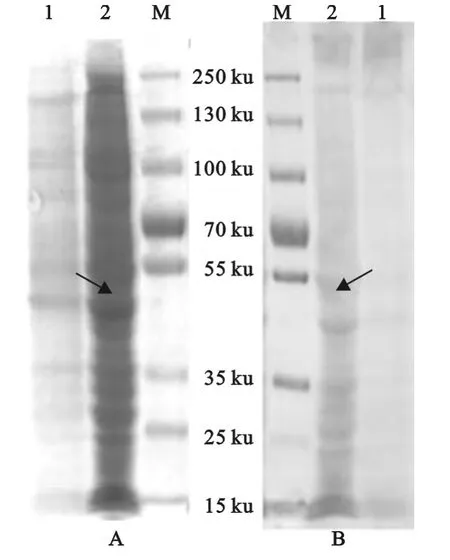
图4 重组P蛋白的SDS-PAGE(A)和 Western blot(B)鉴定Fig.4 SDS-PAGE(A)and Western blot(B)analysis of the recombinant P protein
2.5 间接免疫荧光的结果
使用P3代重组杆状病毒感染sf 9细胞,使用PPRV阳性血清做间接免疫荧光鉴定。由试验结果可见(图5),表达P蛋白的细胞具有特异性荧光信号,表明在昆虫细胞中表达的目的蛋白具有抗原性,能与PPRV阳性血清特异性反应。

图5 重组P蛋白的间接免疫荧光鉴定Fig.5 Indirect immunofluorescence analysis of the recombinant P protein
3 讨论
小反刍兽疫最早于1942年发生于西非。1970年-1972年,PPR首次在东非国家苏丹发生,1983年传至阿拉伯半岛,1987年传至印度南部。在非洲,PPR流行于中部和北部。在亚洲,PPR在中东、中亚和南部亚洲的大部分国家流行,对我国西南边境省份形成包围态势[3]。2007年7月~9月,我国西藏首次暴发PPR疫情[4]。该疫情涉及西藏阿里地区革吉县、日土县、扎达县和改则县4个县、10个乡镇、13个村,共出现20个疫点,羊发病6 122只,死亡1 888只[5]。流行病学调查结果表明,2005年PPR可能就曾经传入与印度接壤的日土县热角村,但未被确诊。PPR可能从印度传入,在阿里境内缓慢向东扩散[4]。2008年西藏阿里地区革吉县文布当桑乡罗玛村发生野生岩羊小反刍兽疫疫情,未见家畜发病[6]。2008年6月初,在那曲地区尼玛县双湖区嘎措乡发生PPR疫情。2010年5月,阿里地区日土县多玛乡乌江村斯亚点发生PPR疫情。此后,西藏再无新的疫情报道。2013年11月~12月,新疆暴发PPR疫情,疫情确诊后,被迅速扑灭。小反刍兽疫频频传入我国,对我国西南边境省份的养羊业构成严重威胁,迫切需要在我国开展PPR相关的研究。
已有研究表明,PPRV的P蛋白在病毒RNA的转录和复制过程中发挥作用。副黏病毒P蛋白能与不同形式的N蛋白结合,也能单独与N蛋白-RNA模板复合物结合激活转录[7]。P蛋白与L蛋白相结合形成依赖于RNA的RNA聚合酶,然后与N蛋白-RNA模板结合形成核糖核蛋白复合体,进行病毒RNA的转录和复制[8]。已有研究表明,麻疹病毒P蛋白在阻断宿主干扰素反应通路中发挥重要作用[9]。P蛋白主要通过阻断Janus激酶1(JAK1)对信号传导及转录激活因子1(STAT1)的磷酸化而干扰宿主的JAK/STAT通路,从而阻断干扰素反应。我国目前对小反刍兽疫病毒结构蛋白的研究主要集中于H、N、M和F蛋白[10-13],对P基因开展了毒株序列特性分析[2],但是,还没有关于P蛋白表达特性的研究报道。利用真核表达系统表达具有生物活性的PPRV P蛋白,对于进一步研制特异性单克隆抗体和研究其生物学特性具有重要意义。
杆状病毒表达系统利用杆状病毒作为载体,在昆虫细胞中表达外源蛋白,其表达产物为有生物活性的可溶性蛋白。该系统对外源基因克隆容量大,重组病毒易于筛选,具有完备的翻译后加工修饰系统,被广泛应用于病毒外源基因的高效表达,为研制亚单位疫苗和制备特异性抗原奠定了基础[14-15]。本研究采用杆状病毒表达系统表达小反刍兽疫病毒西藏流行株P蛋白,通过Western blot和间接免疫荧光反应证明得到的重组蛋白能与PPRV阳性血清发生特异性的免疫反应,表明成功表达了P蛋白。在本研究中,由于目前没有小反刍兽疫病毒P蛋白的特异性单克隆抗体,因此使用小反刍兽疫病毒阳性羊血清对重组P蛋白进行Western blot分析,结果除了目的条带以外,可观察到其他的印迹条带,可能是羊血清中的一些成分与细胞蛋白发生了免疫反应。本研究为进一步研究PPRV的P蛋白生物学特性,研制其单克隆抗体奠定了基础。
[1]王志亮,包静月,吴晓东,等.我国首例小反刍兽疫诊断报告[J].中国动物检疫,2007,24(8):24-26.
[2]包静月,赵文姬,李 林,等.中国西藏小反刍兽疫病毒China/Tib/Gei/07磷蛋白基因的分子特征及其编码蛋白特性分析[J].病毒学报,2011,27(1):26-33.
[3]Banyard A C,Parida S,Batten C,et al.Global distribution of peste des petits ruminants virus and prospects for improved diagnosis and control[J].J Gen Virol,2010,91(12):2885-2897.
[4]Wang Z,Bao J,Wu X,et al.Peste des petits ruminants virus in Tibet,China[J].Emerg Infect Dis,2009,15(2):299-301.
[5]王乐元,次 真,吴国珍,等.中国西藏小反刍兽疫的发生状况与防控[J].畜牧兽医学报,2011,42(5):717-720.
[6]Bao J,Wang Z,Li L,et al.Detection and genetic characterization of peste des petits ruminants virus in free-living bharals(Pseudois nayaur)in Tibet,China[J].Res Vet Sci,2011,90(2):238-240.
[7]Curran J.Reexamination of the Sendai virus P protein domains required for RNA synthesis:apossible supplemental role for the P protein[J].Virology,1996,221(1):130-140.
[8]Karlin D,Ferron F,Canard B,et al.Structural disorder and modular organization in Paramyxoviridae N and P[J].J Gen Virol,2003,84(12):3239-3252.
[9]Devaux P,Priniski L,Cattaneo R.The measles virus phosphoprotein interacts with the linker domain of STAT1[J].Virology,2013,444(1-2):250-256.
[10]高华峰,信爱国,高 林,等.小反刍兽疫病毒H基因在杆状病毒中的表达[J].中国动物传染病学报,2012,20(1):43-46.
[11]黄华欣,李 刚,史利军,等.小反刍兽疫病毒M蛋白主要抗原表位区的原核表达及鉴定[J].中国兽医科学,2013,43(3):266-270.
[12]龙云凤,祝 贺,杨建明,等.小反刍兽疫病毒N基因在昆虫细胞中的表达[J].动物医学进展,2011,32(12):1-5.
[13]田康乐,李 刚,邱文英,等.小反刍兽疫病毒F蛋白的原核表达及其多克隆抗体的制备[J].中国生物制品学杂志,2012,25(9):1185-1189.
[14]曾少灵,廖立珊,唐金明,等.非洲猪瘟病毒VP73蛋白在昆虫细胞中的表达与间接ELISA方法的建立[J].动物医学进展,2013,34(1):1-6.
[15]范 晴,谢芝勋,刘加波,等.牛病毒性腹泻病毒E2基因在昆虫细胞中的表达[J].动物医学进展,2013,34(4):9-12.

