酵母双杂交系统筛选与狂犬病病毒M蛋白相互作用的宿主蛋白
张欢欢,王甲慧,段 铭,张茂林,关振宏*
(1.吉林大学人兽共患病教育部重点实验室人兽共患病研究所,吉林长春130062;2.吉林大学动物医学学院,吉林长春130062)
狂犬病是由高度嗜神经性的狂犬病病毒(Rabies virus,RABV)引起的一种重要的人兽共患病,目前尚无有效的治疗方法,一旦发病,病死率高达100%。狂犬病病毒基因组全长12kb,分别编码糖蛋白(G)、核蛋白(N)、基质蛋白(M)、磷蛋白(P)和大蛋白(L)5种结构蛋白。
M蛋白由202个氨基酸残基组成,分子质量为25ku,是RABV结构蛋白中长度最小、变异最大的一种蛋白[1]。有研究表明,M蛋白在病毒的装配和出芽过程中起着重要的作用[2],将RABV的M蛋白替换为欧洲蝙蝠狂犬病毒的M蛋白后,发现重组病毒在内质网膜的装配方式发生了改变,以致影响了病毒的宿主范围和致病力。在病毒体中,核蛋白复合体RNP是由N、P和L蛋白组成,并且由含有跨膜的G蛋白和表面覆盖M蛋白的脂质双分子层包裹的一种复合物,M蛋白可能参与了RNP的转运过程[3]。在RABV感染细胞中 M蛋白能够抑制eIF3进而影响宿主mRNA的翻译[4]。尽管看似M蛋白在多种负链病毒的复制、转录过程中起着至关重要的作用,但是目前尚无直接的试验数据可以证明M蛋白具有上述功能。此外,M蛋白能够影响G蛋白在病毒包膜表面的构型,从而影响病毒粒子组成的病毒形态。也有研究表明,弹状病毒的M蛋白可以抑制病毒的转录,并且能够引起神经元细胞的凋亡[5]。基于以上研究成果可以看出,RABV M蛋白能够影响RABV在宿主体内的复制和转录,在RABV侵入宿主体内的过程中起着重要的作用。同时RABV M蛋白还能够通过与宿主体内的某些蛋白相互作用,在宿主抵抗病毒的侵袭过程中发挥重要作用。
综上所述,RABV M蛋白是一个多功能结构蛋白,无论是对RABV本身还是对宿主都是至关重要的,但是RABV M蛋白是通过与宿主体内的哪些蛋白相互作用,及其相互作用的机制尚不明确。本研究拟采用酵母双杂交系统筛选出与RABV M基因编码蛋白相互作用的宿主蛋白,为进一步了解M蛋白的功能及狂犬病病毒的致病机制研究提供基础。
1 材料与方法
1.1 材料
大肠埃希菌DH5α由吉林大学人兽共患病研究所病毒室保存;MatchmakerTMGoldYeast Two-Hybrid System酵母双杂交系统、人工合成缺陷型培养基 SD/-Ade/-His/-Leu/-Trp(Quadruple Dropout,QDO)、SD/-Leu/-Trp(Double Dropout,DDO)、X-α-半乳糖苷酶(X-α-gal)、短梗霉素 A(AbA)等为Clontech公司产品;T4DNA Ligase、各种限制性内切酶、E×TaqDNA聚合酶、及DNA标准DL 2 000等为宝生物工程(大连)有限公司产品;大肠埃希菌质粒抽提试剂盒、酵母质粒抽提试剂盒为天根生化科技(北京)有限公司产品;兔源抗Myc标签单克隆抗体、HRP标记羊抗兔二抗为Santa Cruz Biotechnology公司产品。
1.2 方法
1.2.1 诱饵质粒的构建与鉴定 取接种狂犬病病毒CVS11株后发病小鼠1只,提取发病小鼠的脑海马区的总RNA,并将RNA反转后的cDNA作为模板,按常规方法进行PCR扩增。根据GenBank上登录的CVS11株全基因组序列设计引物,用于扩增CVS11-M的基因全长。上游引物M1:(含有NcoⅠ酶切位点)5′-CATGCCATGGAGATGAACGTTCTACGCAAGAT-3′;下游引物 M2:(含有BamH Ⅰ酶 切 位 点 )5′-CGGGATCCTTATTCTAGAAGCAGAGAAGAG-3′。将PCR扩增片段和pGBKT7载体用NcoⅠ和BamHⅠ进行双酶切后,用T4连接酶连接,将连接产物转化入大肠埃希菌DH5α感受态细胞,抽提随机挑选的转化后单菌落的质粒进行PCR和双酶切鉴定,并送生物公司测序。
1.2.2 诱饵质粒对酵母细胞的毒性作用检测 M蛋白酵母表达载体pGBKT7-CVS11-M构建成功后,将其用醋酸锂法[6]转化入感受态酵母菌Y2HGold中,然后涂布于SD/-Trp平板,检测M蛋白是否有毒性。用空载体pGBKT7作为阴性对照。
1.2.3 诱饵质粒的自激活检测 将上述转化子分别 涂 于 SD/-Trp、SD/-Trp/X、SD/-Trp/X-α-gal/AbA、DDO/X-α-gal/AbA(以下简写为 DDO/X/A)平板,观察是否能长出菌落及长出菌落的颜色。用pGBKT7-53作为阳性对照质粒。
1.2.4 诱饵质粒的转化与表达 将转化子Y2HGold-pGBKT7、Y2HGold-pGBKT7-CVS11-M和Y2HGold未转化菌分别涂于SD/-Trp平板上,长出菌落后,挑取一个直径2mm~3mm的新鲜菌落于SD/-Trp液体培养基,30℃摇床培养12h~16h,收集菌后提取酵母总蛋白。利用Western blot,并使用C-Myc抗体检测融合表达了C-Myc蛋白的M蛋白,以验证M基因在酵母中的表达。
1.2.5 酵母双杂交筛选 按照Clontech公司的Matchmaker system说明书进行。挑取SD/-Trp平板上长出的含有pGBKT7-CVS11-M的Y2HGold酵母单个菌落,接种于SD/-Trp液体培养基,30℃摇床培养16h~24h,紫外分光光度计检测波长600nm OD值为0.8时,与1mL的含有人脑cDNA的文库菌Y187在2L的锥形瓶中温和的混合均匀,加入45mL 2×YPDA液体培养基(50μg/mL ka-namycin),30℃ 缓慢摇床培养24h;1 000r/min离心10min后,用10mL 0.5×YPDA/Kan液体培养基重悬,将上述杂交菌液涂于DDO/X/A平板上,30℃培养3d~5d后,挑取变蓝的菌落,划线于QDO/X/A平板上,30℃ 培养3d~7d。
1.2.6 阳性克隆的鉴定与生物信息学分析 抽提QDO/X/A平板上长出的明显变蓝的酵母克隆质粒,电转化入DH5α电转感受态中,在LB/(Amp+)培养基上筛选阳性克隆,提取质粒,即为初步筛选得到的含有与M蛋白相互作用蛋白质基因的捕获质粒。以pGADT7载体引物对筛选到的阳性质粒进行PCR扩增,经10g/L琼脂糖凝胶电泳鉴定后送Invitrogen公司测序,测序结果与NCBI GenBank数据库进行Blast分析。
1.2.7 回转杂交验证 按照以上方法得到的候选阳性质粒1∶1与诱饵质粒重新共转化感受态Y2HGold酵母菌,转化步骤如前所述,最后分别涂到DDO/X/A 平板上,于30℃培养3d~5d;在DDO和QDO/X/A平板能够生长且菌落呈现明显蓝色的为阳性。共转化试验中,分别设立空白对照pGBKT7+pGADT7、阴性对照pGBK-Lam+pGAD-T和阳性对照pGBK-p53+pGAD-T。初步验证其相互作用,去除假阳性。
2 结果
2.1 诱饵质粒的构建及鉴定
诱饵质粒经PCR和双酶切鉴定所得目的片段正确(图1),鉴定结果为阳性的质粒送测序,结果显示插入的片段序列与M基因序列完全一致,没有发生突变,表明成功构建了诱饵质粒的酵母表达载体pGBKT7-CVS11-M。

图1 诱饵质粒pGBKT7-CVS11-M的PCR及酶切鉴定Fig.1 Identification of pGBKT7-CVS11-M bait plasmid by PCR and enzyme digestion
2.2 诱饵质粒的毒性检测
SD/-Trp平板上,酵母转化子Y2HGold-pGBKT7和Y2HGold-pGBKT7-CVS11-M的生长速度和长出菌落的大小基本没有差别,证明M蛋白对Y2HGold酵母细胞无毒性作用。
2.3 诱饵质粒的自激活性检测
Y2HGold-pGBKT7-CVS11-M酵母转化子在SD/-Trp平板上生长2d后出现白色菌落;在SD/-Trp/X平板上生长2d后出现灰蓝色菌落;在SD/-Trp/X/A平板上生长5d后无菌落出现;在DDO/X/A平板上生长5d后无菌落出现。而阳性质粒对照组既能在SD/-Trp/X/A生长而且在 DDO/X/A平板上长出蓝色菌落。证明在未转入人脑cDNA文库时,pGBKT7-CVS11-M自身不能激活Y2HGold酵母菌内报告基因的表达。
2.4 Western blot验证诱饵蛋白在酵母中的表达
结果显示,未转化质粒的阴性对照组没有条带;转化pGBKT7质粒组在分子质量20ku左右有一个特异表达条带;转化pGBKT7-CVS11-M质粒的酵母提取物于45ku左右有一个明显条带,其分子质量大小与理论值相符合(图2)。说明CVS11-M基因在酵母菌内成功表达。
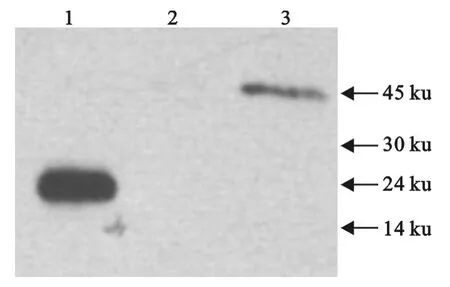
图2 Western blot检测Gal4BD-CVS11-M融合蛋白在Y2HGold中的表达Fig.2 Western blot analysis of the Gal4BD-CVS11-M fusion protein expressed in Y2HGold
2.5 酵母双杂交文库的筛选
文库菌和诱饵菌配合后,能在DDO/X/A平板上生长并且变蓝的假定阳性克隆共90个,将上述假定阳性克隆划线于QDO/X/A平板上仍能生长且明显变蓝的阳性克隆54个(图3)。

图3 四缺培养基筛选阳性克隆(部分)Fig.3 Screening of the positive clones using QDO/X plates(part)
2.6 PCR鉴定结果
将上述阳性酵母质粒用电穿孔法转入感受态DH5α后,提取长出菌落的质粒即为阳性质粒。用pGADT7载体引物对筛选到的质粒进行PCR扩增后共获得12个阳性质粒(图4)。

图4 猎物质粒的PCR鉴定(部分)Fig.4 Identification of prey clones by PCR (part)
2.7 测序结果
将阳性克隆质粒送测序,测序结果在NCBI GenBank数据库进行Blast分析,得到3个编码与M蛋白具有相互作用蛋白的基因(表1)。

表1 以CVS11-M为诱饵蛋白筛选人脑cDNA文库获得的阳性克隆的Blast结果Table 1 The Blast results of positive clones obtained from the screening of human brain cDNA library using CVS11-M as bait protein
2.8 回转杂交验证结果
将3个候选阳性质粒(P4HA2、TAB2和RCN1)与诱饵质粒pGBKT7-CVS11-M按1∶1重新共转化感受态Y2HGold酵母菌,转化步骤如前所述,涂于QDO和QDO/X/A平板,生长3d~5d后长出明显变蓝的阳性菌落。阳性对照组生长出明显变蓝的阳性菌落,而空白对照组和阴性对照组没有出现变蓝的菌落(图5)。结果表明,M蛋白与人脑中的P4HA2、TAB2和RCN1蛋白具有相互作用。

图5 回转杂交试验结果Fig.5 The results of yeast retransformation assay
3 讨论
酵母双杂交系统是1989年由Fields S和Song O K建立的,以酵母的遗传分析为基础,研究反式作用因子两种结构域之间的相互作用对真核基因转录调控影响的一种分子生物学方法[7]。这项技术对诱饵基因的要求特别低,cDNA、目的基因的全长或部分片段都可以构建成诱饵质粒与文库质粒进行配合。而传统的研究蛋白质相互作用的试验技术,往往需要高度纯化的蛋白或者特异性好的抗体[8],增加了试验成本。酵母双杂交技术不仅可以验证与目的蛋白具有相互作用的已知蛋白,而且能够筛选出与目的蛋白具有相互作用的未知蛋白。例如Aelst L等[9]发现了能与癌基因蛋白Ras相互作用的2种蛋白-癌基因蛋白Raf和一种蛋白激酶byra。酵母双杂交技术以其快速有效的优点,在诸多领域得到了广泛应用。
本试验通过酵母双杂交系统筛选到3个不同的与M蛋白具有相互作用的人脑蛋白的编码基因,分别为 TAB2、P4HA2、RCN1。研究表明,TAB2(TAK1-binding protein 2)在 NF-kB、JNK 和TRAF6等信号通路中起着重要作用。例如,TAB2与miR-155结合,通过TLR/IL-1信号级联反应负向调节树突细胞产生炎性细胞因子。TAB2、TAB1、MAP3K7还参与了 NF-κB的受体激活剂TNFSF11/RANK诱导的信号转导,其中TAB2是MAP3K7/TAK1的活化剂,这个过程可能参与了调节破骨细胞的发育和功能。TAK1通过与TAB1、TAB2和TAB3结合后发出信号能提高癌细胞表达TAB2和TAB3的mRNA的水平。这些研究表明,TAK1-TAB2可作为一个潜在的治疗癌症诱导的骨损伤后骨的新陈代谢的靶向[10]。还有研究显示,TAK1信号通路的成员使TAB2沉默,也可促使MAD-MB-231和HCT-116细胞对抗肿瘤药物敏感[11]。以上结果表明,TAB2主要参与调节免疫反应和炎症。P4HA2是一种胶原蛋白羟基化酶,主要起保护血管的作用并且参与了乳腺癌细胞的入侵和转移过程[12]。RCN1即内质网钙结合蛋白,它在很多疾病例如癌症、心血管疾病、神经肌肉疾病中发挥着重要作用[13]。Kramann N 等[14]研究发现,RCN1是一个潜在的心肌肥大的负向调节剂,主要通过抑制RAF/MEK信号通路而发挥调节作用。Cooper C R等[15]研究发现在出现心力衰竭时,存在过量表达的TNF-α,则细胞膜表面的RCN1的蛋白表达量会升高。Giuliana G等[16]研究表明,RCN1可以作为一个潜在的临床标记物质,以上结果说明RCN1在细胞肿瘤及炎症发生等生命过程中发挥重要的作用。因此,M蛋白与这些蛋白的相互作用的生物学功能可能与病毒毒力、病毒调控细胞凋亡信号等过程相关。因为TAB2在NF-κB信号通路中发挥重要作用,在后续的研究中我们将定位于TAB2与RABV引起的脑炎之间的具体机制进行探索。
[1]Mebatsion T,Weiland F,Conzelmann K K.Matrix protein of rabies virus is responsible for the assembly and budding of bullet-shaped particles and interacts with the transmembrane spike glycoprotein G[J].J Virol,1999,73(1):242-250.
[2]Garoff H,Hewson R,Opstelten D J.Virus maturation by budding[J].MMBR,1998,62(4):1171-1190.
[3]Timmins J,Ruigrok R W H,Weissenhorn W.Structural studies on the Ebola virus matrix protein VP40indicate that matrix proteins of enveloped RNA viruses are analogues but not homologues[J].FEMS Microbiol Lett,2004,233(2):179-186.
[4]Finke S,Granzow H,Hurst J,et al.Intergenotypic replacement of lyssavirus matrix proteins demonstrates the role of lyssavirus M proteins in intracellular virus accumulation[J].J Virol,2010,84(4):1816-1827.
[5]Ito Y,Nishizono A,Mannen K,et al.Rabies virus M protein expressed in Escherichia coli and its regulatory role in virionassociated transcriptase activity[J].Arch Virol,1996,141(3-4):671-683.
[6]崔雨明,侯佩莉,张茂林,等.酵母双杂交筛选人白细胞文库中与A型流感病毒PB1-F2相互作用的蛋白[J].动物医学进展,2012,33(3):1-5.
[7]Fields S,Song O K.A novel genetic system to detect proteinprotein interactions[J].Nature,1989,340(6230):245-246.
[8]Estojak J,Brent R,Golemis E A.Correlation of two-hybrid affinity data with in vitro measurements[J].Mol Cell Biol,1995,15(10):5820-5829.
[9]Van Aelst L,Barr M,Marcus S,et al.Complex formation between RAS and RAF and other protein kinases[J].Proce Nat Aca Sci U S A,1993,90(13):6213-6217.
[10]Greenblatt M B,Shim J H,Zou W,et al.The p38MAPK pathway is essential for skeletogenesis and bone homeostasis in mice[J].J Clin Invest,2010,120(7):2457-2473.
[11]Safina A,Sotomayor P,Limoge M,et al.TAK1-TAB2signaling contributes to bone destruction by breast carcinoma cells[J].Mol Cancer Res,2011,9(8):1042-1053.
[12]Gilkes D M,Bajpai S,Chaturvedi P,et al.Hypoxia-inducible factor 1 (HIF-1)promotes extracellular matrix remodeling under hypoxic conditions by inducing P4HA1,P4HA2and PLOD2expression in fibroblasts[J].J Biol Chem,2013,288(15):10819-10829.
[13]Zhang Y,Ye J,Chen D,et al.Different expression profiling between the relative normal and dystrophic muscle tissues from the same LGMD patient[J].J Trans Med,2006,4(1):53.
[14]Kramann N,Hasenfub G,Seidler T.B-RAF and its novel negative regulator reticulocalbin 1(RCN1)modulates cardiomyocyte hypertrophy[J].Cardiovas Res,2014,10:1-9.
[15]Cooper C R,Graves B,Pruitt F,et al.Novel surface expression of reticulocalbin 1on bone endothelial cells and human prostate cancer cells is regulated by TNF-α[J].J Cell Biochem,2008,104(6):2298-2309.
[16]Giribaldi G,Barbero G,Mandili G,et al.Proteomic identification of Reticulocalbin 1as potential tumor marker in renal cell carcinoma[J].J Proteomics,2013,91:385-392.

