猪流行性腹泻病毒分离鉴定与实时荧光定量RT-PCR检测方法的建立
唐金明,陈书琨,林庆燕,黄新亚,卢体康,孙 洁,阮周曦,曾少灵,祁振强,吕建强,杨俊兴,曹琛福,张彩虹,刘建利,廖立珊,花群义,秦智锋*
(1.深圳出入境检验检疫局,广东深圳518045;2.华南农业大学,广东广州510642;3.湖南农业大学,湖南长沙410000;4.深圳市宝舜泰生物医药股份有限公司,广东深圳市518001)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种急性、高度接触性肠道传染病,主要临床表现为腹泻、呕吐、脱水和哺乳仔猪高致死率。PED呈世界范围性流行,1971年在英国和比利首次报道,此后加拿大、匈牙利、德国、日本及韩国等多个国家都报道了该病的发生。中国于1976年首次报道PED[1]。最近几年,PED危害性进一步加大,流行呈明显上升趋势[2-3]。从2010年春季至今,我国的很多省份、泰国、菲律宾、韩国及美国等国家的规模化猪场暴发严重的猪流行性腹泻疫情。2013年,猪流行性腹泻病毒已蔓延美国13个州,造成了严重的经济损失。PEDV与猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)、轮状病毒A(Rotavirus group A,Rota-A)感染后所引起的临床症状相似,临床难以鉴别诊断,给疾病的确诊、治疗和防控带来了很大困难,给养猪业造成严重经济损失。
2013年,从规模化养猪场采集20多份临床样品,采用Vero-76细胞系分离出了1株PEDV,并通过RT-PCR方法和测序对其进了鉴定。为建立PEDV的快速检测方法,采用实时荧光定量RTPCR(real-time RT-PCR,rRT-PCR)技术建立一种能快速、灵敏、准确检测PEDV的实时荧光定量RT-PCR检测方法(PEDV-rRT-PCR),以达到提高检测灵敏度、降低检测成本、缩短检验周期的目的。
1 材料与方法
1.1 材料
1.1.1 试验用病料及分组 来自广东某猪场发生腹泻、濒临死亡仔猪的小肠及内容物、粪便,哺乳母猪的乳汁;猪传染性胃肠炎华南毒株和猪流行性腹泻PEDV-CV777毒株(为猪传染性胃肠炎、猪流行性腹泻二联弱毒疫苗),由哈尔滨兽医研究所保存;Vero-76传代细胞系(ATCC#CRL-1587)为深圳出入境检验检疫局动检实验室保存;DMEM营养液为GIBCO公司产品;胰蛋白酶(Trypsin)为Invitrogen公司产品。
1.1.2 试剂盒与仪器 One Step RNA PCR Kit为TaKaRa公司产品;AgPath-IDTMOne-Step RTPCR Kit为ABI公司产品;Qiagen Viral RNA Mini Kit为Qiagen公司产品;ABI 96孔普通PCR仪,ABI 7500HT荧光定量PCR仪,Qiagen EZ1advanced全自动核酸抽提工作站,BIO-RAD Hood II全自动凝胶成像分析系统。
1.2 方法
1.2.1 病毒鉴定引物 参照文献[4]合成。P1:5′-TCGTTTTGGGTGGTTACCTAC-3′,P2:5'-AGTGGCAAATACATTGGCAGCG-3′,由宝生物工程(大连)有限公司合成。
1.2.2 PEDV-rRT-PCR引物与探针的设计 参照GenBank中登录的PEDV膜蛋白基因(M基因)进行序列比对分析,以Clusta 1方式进行比对,以M基因中最保守的寡核苷酸序列作为探针,在探针两侧保守区域设计特异性的、上下游引物,并在上游引物处设计了简并引物,以避免漏检。实时荧光定量RT-PCR引物探针,探针Pb:HEX-5′-TGTGGCGCAGGACAC-3′-BHQ,上 游 引 物 Fp:5′-GCATCCTTATGGC(T/C)TGCATCAC-3′,下游引物Rp:5′-TTCAGGATTGAAAGACCACCAAGAAT-3′,由上海基康生物技术有限公司合成。
1.2.3 病毒分离鉴定
1.2.3.1 样品处理 取发病小猪的小肠内容物,用生理盐水制成1∶10的悬浮液,于4℃以4000r/min离心20min,小心移去上层乳脂,取上清液经0.22μm微孔滤膜过滤,滤液分装,置-80℃保存。
1.2.3.2 临床样品RT-PCR鉴定 参照 Qiagen Viral RNA Mini Kit操作说明书,于全自动核酸抽提工作站中抽提小肠内容物等临床样品、阳性对照PEDV-CV777疫苗株和阴性对照(VERO-76细胞系)的核酸。采用文献报道的P1和P2引物,参照TaKaRa公司一步法RT-PCR试剂盒说明书进行RT-PCR检测。50μL RT-PCR反应体系包含10×RT-PCR母液5μL、MgCl2(25mmol/L)10μL,dNTP Mixture(各10mmol/L)5μL,RNase Inhibitor(40U/μL)1μL,AMV RTase XL(5U/μL)1μL,AMV-Optimized Taq (5U/μL)1μL,P1(20μmol/L)1μL,P2(20μmol/L)1μL,样品8μL,RNase Free dH2O 17μL。于ABI PCR仪进行扩增,反应程序为:42℃50min,94℃10min,94℃1min,56℃50s,72℃1min,共35个循环;72℃10min。取10μL RT-PCR产物进行凝胶电泳检测,于BIO-RAD HoodⅡ全自动凝胶成像分析系统分析结果。
1.2.3.3 病毒分离 按常规方法复苏VERO-76细胞系,培养至单层,每瓶接种经RT-PCR鉴定为阳性的可疑病料滤液1mL。同时接种经TGEV标准阳性血清高浓度中和30min后的猪传染性胃肠炎、猪流行性腹泻二联活苗。接种病毒后的细胞37℃吸附1h,其间轻摇2次。吸附结束后,加入含有终浓度20μg/mL胰酶和含20mL/L胎牛血清的DMEM维持液,37℃培养72h作为一个传代周期。传代前,将上一次的细胞培养物反复冻融3次,按上述方法进行盲传,显微镜观察细胞病变。每次细胞传代后的病毒上清液,再次进行病毒RT-PCR鉴定。
1.2.4 PEDV-rRT-PCR检测方法的建立
1.2.4.1 实时荧光 RT-PCR方法的建立 以PEDV-CV777毒株经VERO-76细胞系培养传代后的第3代细胞培养液为阳性对照,对小肠内容物、第1代病毒细胞培养上清液和第3代病毒细胞上清液抽提核酸,核酸抽提见1.2.3.3。参照 ABI公司AgPath-IDK ht-Step RT-PCR Kit操作说明书建立PEDV荧光定量RT-PCR反应体系:每个25μL的反应体系中包含2×RT-PCR母液12.5μL,酶混合物1μL,10μmol/L FP1μL,10μmol/L RP1μL,5μmol/L Pb1μL,无核酸酶的水3.5μL,RNA模板5μL,空白对照管中RNA模板用无RNase水代替。于ABI 7 500荧光PCR仪进行rRT-PCR扩增。反应程序如下:50℃30min;95℃10min,95℃35s,60℃40s,共40个循环;60℃延伸时,收集荧光信号Hex。
将实时荧光定量RT-PCR扩增产物直接送宝生物工程(大连)有限公司进行克隆测序,将测序结果与GenBank公布序列进行比对分析。
1.2.4.2 PEDV-rRT-PCR检测方法灵敏度试验采用FP和RP引物,对PEDV-CV777毒株经VERO-76细胞系培养传代后的第3代细胞培养液抽提核酸,参照1.2.1.3进行RT-PCR扩增。用胶回收试剂盒回收电泳后的目的片段,再按照pMDTM19-T Vector Cloning Kit说明书与载体连接转化。提取重组质粒,通过测定质粒DNA浓度来确定其拷贝数。将已知拷贝数的质粒DNA 10倍系列稀释成10-3~10-86个稀释度,按照1.2.4.1所建立的PEDV-rRT-PCR检测方法进行灵敏度试验,确定PEDV-rRT-PCR检测方法的灵敏度。
1.2.4.3 PEDV-rRT-PCR检测方法特异性试验用所建立PEDV-rRT-PCR检测方法,对病毒分离株第3代细胞培养上清液、PEDV-CV777毒株第3代细胞培养上清液等2份含PEDV的样品和猪传染性胃肠炎病毒、轮状病毒、猪细小病毒、伪狂犬病病毒、猪繁殖与呼吸综合征病毒、猪肉组织、猪阴性血清样品、大肠埃希菌、Vero-76细胞系等9份其他样品进行检测,进一步确定所建立方法的特异性。
1.2.4.4 PEDV-rRT-PCR检测方法重复性试验采用所建立的PEDV-rRT-PCR检测方法,对PEDV第3代细胞培养物上清液原液和10-1稀释液,分别抽提核酸后进行3次重复检测,确定所建立方法的组内差异。
1.2.4.5 田间小样试验 对自2012年开始,从3个大型猪场采集粪便、小肠和乳汁样品共20份储存样品,用建立的方法进行PEDV的检测,对所建立的方法进行田间小样试验。
2 结果
2.1 病毒分离结果
将处理的样品接种VERO-76细胞系,连续盲传3代,显微镜下观察每代细胞培养状况。发现样品接种细胞后,第1、2、3代均未出现细胞病变(Cytopathic Efect,CPE)。
2.2 PEDV RT-PCR检测结果
以小肠内容物、第3代PEDV细胞培养上清液、阳性对照PEDV-CV777疫苗株和阴性对照(VERO-76细胞系)为检测对象,参照文献建立的RT-PCR检测方法,于PCR仪上进行PEDV的RT-PCR检测。在阴性、阳性对照成立的情况下,2个样品均出现特异性扩增条带,条带大小为584 bp,与预期大小一致(图1)。

图1 RT-PCR检测PEDV结果Fig.1 The results of RT-PCR for PEDV detection
2.3 PEDV-rRT-PCR检测结果
采用自行设计的PEDV特异性引物和探针,在25μL反应体系中,于设定的反应条件下进行实时荧光定量RT-PCR检测。在阴性、阳性对照成立的情况下,小肠内容物、第1代病毒细胞培养上清液和第3代病毒细胞上清液,均出现特异性实时扩增曲线,结果为阳性。检测结果见图2。

图2 PEDV-rRT-PCR检测结果Fig.2 The detection results of PEDV-rRT-PCR
测序结果片段全长103bp,与GenBank中序列进行Blast比对分析表明,同源性达到98%。表明所建立的实时荧光定量RT-PCR扩增的目的片段为PEDV的M基因片段(测序图略)。
2.4 PEDV-rRT-PCR检测方法灵敏度试验结果
将10倍系列稀释的重组质粒进行PEDV实时荧光定量RT-PCR检测灵敏度测定。测定结果显示,所建立的PEDV-rRT-PCR检测方法的灵敏度为10-8(图3),通过计算,相当于20个基因拷贝。
2.5 PEDV-rRT-PCR检测方法特异性试验结果
对2份PEDV第3代细胞培养上清液和9份非PEDV样品进行PEDV-rRT-PCR检测。结果显示,2份PEDV样品有阳性扩增曲线,其他9份非PEDV样品没有扩增曲线(图4)。表明该方法特异性强,与其他检测对象无交叉反应。
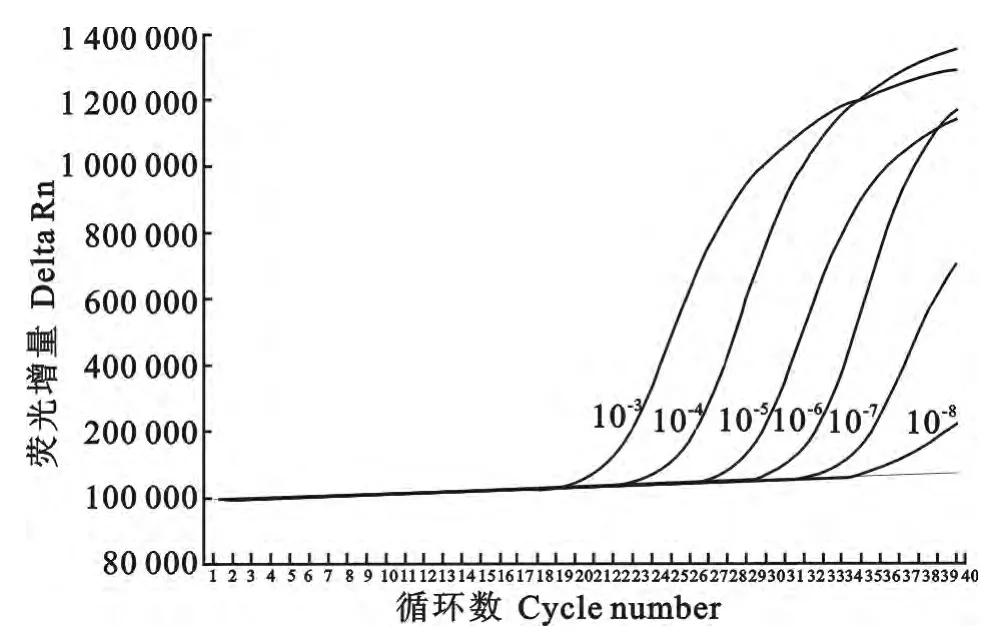
图3 PEDV-rRT-PCR检测方法灵敏度结果Fig.3 Sensitivity of PEDV-rRT-PCR assay
2.6 PEDV-rRT-PCR检测方法重复性试验结果
用所建立的PEDV实时荧光定量RT-PCR检测方法测定PEDV第3代细胞培养上清液原液和10-1稀释液,3次重复度的组内变异系数不大,在0.21~0.33,即组内变异系数≤0.26%,符合检测方法的要求。
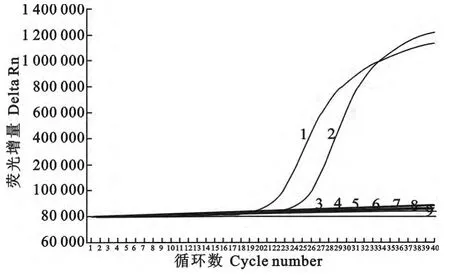
图4 PEDV-rRT-PCR检测方法特异性结果Fig.4 Specificity of PEDV-rRT-PCR assay
2.7 田间试验
对采集自2012年的3个大型猪场的猪粪便、小肠和乳汁等20份样品,进行PEDV-rRT-PCR检测。共筛选出17例阳性样本。挑选其中4例样本进行病毒的分离鉴定,再次进行检测,检测结果全部为PEDV。
3 讨论
流行性腹泻在多个国家流行,并有愈演愈烈的趋势,各国都加强了对流行性腹泻的监控。但传统的鉴别诊断方法,如病毒的抗原检测、病毒的免疫电镜观察、病毒的分离与鉴定等,都需要十分烦琐的病料前处理,工作量大、耗时长、操作复杂、诊断成本高。因此,建立一个操作简单、灵敏度高、特异性强、检测周期短的能够广泛运用的诊断方法显得尤为迫切。实时荧光定量RT-PCR具有高灵敏度、高特异性、快速的特点,被国内外广泛应运于人医的临床检测和兽医的临床诊断[5-6],并且很多病毒的荧光PCR检测方法都被列为了检测标准,在猪流行性腹泻方面也有相关研究[7-8]。针对此次突发的猪流行性腹泻病毒危害极大的情况,本研究采用目前实验室通用的实时荧光定量RT-PCR检测技术,建立了猪流行性腹泻病毒实时荧光定量RT-PCR检测方法,为猪流行性腹泻的实验室快速诊断奠定了基础。
本研究通过对小肠内容物、病毒第1代细胞培养上清、病毒第3代细胞培养上清进行RT-PCR检测,证实了从猪的小肠内容物中分离到了一株流行性腹泻病毒。据文献报道[4],猪流行性腹泻具有一定的细胞毒性,很难在细胞系上传代培养。本研究分离PEDV时,采用了Vero-76细胞系,加入了终浓度为20μg/mL胰酶,初步分离到了猪流行性腹泻病毒。但在采用Vero-76细胞系进行第4代传代培养后,发现出现病毒丢失现象。无论采用普通RT-PCR方法,还是采用所建立的PEDV-rRT-PCR检测方法,均较难检出PEDV。如何将PEDV进一步传代,是需要进一步研究,进而为疫苗的快速制备提供前提和基础。
自从1983年Mullis发明PCR技术以来,由于其具有灵敏度高、特异性强的特点,PCR技术很快成为科研、临床诊断、食品安全等各个领域的热点技术。随后各种核酸扩增技术不断涌现,包括支链DNA检测技术、环介导的等温扩增技术、连接酶链技术和链置换扩增等核酸检测技术也进行了一定程度的应用。实时荧光定量PCR技术应用最为广泛,目前发展成为国际标准中新的“黄金标准”,主要用于各种病原体的诊断、病毒滴度监测以及疗效评估。本研究中所建立的PEDV实时荧光定量RT-PCR检测方法灵敏度可以达到10-8,相当于20拷贝基因。与猪传染性胃肠炎病毒、轮状病毒等9份非PEDV样品无任何交叉反应,保证了检测的特异性,有效解决了流行性腹泻和猪传染性胃肠炎难以鉴别诊断的问题。本研究中所建立的检测方法灵敏度高,特异性好,且检测周期短,适合用于猪流行性腹泻病毒的分子生物学检测和大规模的流行病学调查。
[1]魏海芳,王鸿忠.青海省部分地区PEDV、TGEV和RV感染情况调查与分析[J].动物医学进展,2013,34(9):133-136.
[2]张 志,李 岚,董雅琴,等.猪流行性腹泻病毒PCR检测及其M基因的遗传变异分析[J].动物医学进展,2013,34(8):13-18.
[3]焦 洋,姜 焱,王凯民,等.猪传染性胃肠炎病毒、猪流行性腹泻病毒和猪博卡病毒多重PCR检测方法的建立[J].动物医学进展,2013,34(8):71-75
[4]赵雯雯,李敬双,赵晓岚,等.猪传染性胃肠炎病毒和猪流行性腹泻病毒二联RT-PCR检测方法的建立[J].黑龙江畜牧兽医,2010(2):109-110.
[5]Mackay I M,Arden K E,Nitsche.Real-time PCR in virology[J].Nucleic Acids Res,2002,30:1292-1305.
[6]修金生,周伦江,陈如敬,等.猪流行性腹泻病毒SYBRⅠ实时荧光定量RT-PCR检测方法的建立[J].中国兽医科学,2012,42(2):160-165.
[7]Kim S,Kim I,Pyo H,et al.Multiolex real-time RT-PCR for the simultaneous detection and quantification of transmissible gastroenteritis virus and porcine epidemic diarrhea virus[J].Virol Meth,2007,146(1/2):172-177.
[8]刘 邓,袁秀芳,冉多良,等.TaqMan荧光定量PCR检测猪流行性腹泻病毒方法的建立与初步应用[J].中国动物传染病学报,2010,18(1):28-33.

