羊传染性脓疱病毒半套式PCR检测方法的建立及应用
邓 宇
(西昌学院动物科学学院,四川西昌615013)
羊传染性脓疱病毒又称羊口疮病毒(Orf virus,ORFV),能引起人与绵羊、山羊等多种动物共患接触性、嗜上皮性传染病。该病毒可以引起动物的口、唇、舌、鼻、乳房等部位形成丘疹、水疱、脓疱、溃疡和疣状厚痂,并伴有恶臭,羊群发病率可达90%,病死率1%~25%[1],人通过接触患病动物或者病原污染物而感染发病,尤其是牧民、兽医、屠宰工人等,以手指等部位出现亚急性皮肤感染为主[2],其临床症状表现为指间、手背和前臂部出现疱疹、破溃。因此,羊传染性脓疱病毒的流行严重危害羊的健康,同时也威胁到人的健康,是一种较为严重的人兽共患传染病病毒。
羊传染性脓疱的临床特征与绵羊痘、山羊痘较相似,血清学上存在交叉反应,因此采用血清学方法不容易将ORFV与绵羊痘病毒、山羊痘病毒鉴别[1-2]。目前,PCR检测方法是一种常用的鉴别诊断技术,本研究旨在建立一种能鉴别诊断羊传染性脓疱病毒与绵羊痘病毒、山羊痘病毒的半套式PCR方法,为羊传染性脓疱病毒检测提供快速、特异、敏感的有效检测手段。
1 材料与方法
1.1 材料
1.1.1 样品及毒株 ORF疑似病料30份,采自西昌市、会理县、德昌县、攀枝花市、汉源县等地发病山羊口唇部痂皮;羊传染性脓疱病毒XC13株,由攀西动物疫病检测与防控四川省高校重点实验室分离鉴定保存;山羊痘病毒疫苗株(GPV)、绵羊痘病毒疫苗株(SPV)、禽痘病毒疫苗株(APV),为某疫苗生物公司产品。
1.1.2 主要试剂 动物病毒DNA提取试剂盒、pGM-T载体、质粒抽提试剂盒为天根生物科技(北京)有限公司产品;2×Power Taq PCR Master Mix、多功能DNA纯化回收试剂盒为BIOTEKE生物科技有限公司产品;DNA Marker DL 2 000为上海捷瑞生物科技有限公司产品;羊传染性脓疱抗原检测ELISA试剂盒为上海恒远生物科技有限公司产品。
这里需指出的是,fmax和采用哪两个位置的粒子速度信号直接相关,fmin是较为粗略的估计,总体上看式(11)只是对有效频段的近似估计,便于工程上参考使用。
1.2 方法
1.2.3.3 PCR产物鉴定 第2轮PCR产物琼脂糖凝胶电泳后,切胶,按多功能DNA纯化回收试剂盒说明书回收纯化PCR产物,纯化PCR产物克隆至pGM-T克隆载体,采用质粒抽提试剂盒抽提质粒,酶切鉴定为阳性克隆送上海Invitrogen公司测序。
1.2.5 半套式PCR方法敏感性试验 以ORFV XC13株DNA为模板,采用半套式PCR扩增,将PCR产物回收纯化后构建重组质粒,阳性质粒采用核酸蛋白分析测定其OD 260nm值,计算其拷贝数,将重组质粒10倍倍比稀释,以各稀释度重组质粒为模板进行半套式PCR扩增,以检测所建立的PCR方法敏感性。
网络安全包括黑客的攻击和病毒的破坏等,但是这些来自网络外部的威胁,在现有的常规安全防御理念里已经进行了严密的监控。比如在网关级别、网络边界(防火墙、漏洞扫描、防病毒、IDS)等方面的防御,将重要的安全设施集中于机房或网络入口处,设置防火墙、入侵检测系统和VPN等,这些举措使得来自网络之外的威胁大大降低了。在外网安全的威胁假设中内部网络都是安全可信的,威胁都来自于外部网络,其途径主要是内外网边界的出口[2],所以只要将网络边界处的安全控制措施做好,就可以确保整个网络的安全。
1.2.2 DNA提取 取ORFV XC13株细胞毒株、疫苗毒株在-30℃反复冻融3次,1 200r/min离心5min,取上清备用。用生理盐水清洗临床组织病料,用灭菌剪刀剪碎后,放入组织匀浆机中充分匀浆,收集匀浆液,-30℃反复冻融2次,1 200r/min离心5min,取上清置-30℃冻存备用。取上清按动物病毒DNA提取试剂盒操作方法提取病毒DNA。
1.2.6 半套式PCR方法重复性试验 选择不同稀释度的同一DNA模板进行4次重复PCR扩增,再选取4个不同稀释度DNA模板进行4次重复PCR扩增,以验证建立的半套式PCR方法的稳定性。
1.2.3.1 第1轮PCR扩增 以抽提的 ORFV XC13株DNA为模板,建立25μL PCR反应体系:2×Power Taq PCR Master Mix 12.5μL,上游引物ORF-P1(10μmol/L)0.5μL,下游引物 ORF-P2(10μmol/L)0.5μL,DNA 2.0μL,ddH2O 9.5μL。反应程序:94℃10min;94℃50s,60℃50s,72℃1min,共36个循环;72℃10min。取PCR产物5μL在10g/L琼脂糖凝胶中电泳,于凝胶成像系统中观察结果。
采用半套式PCR方法对7种不同稀释度的DNA样品进行扩增,电泳结果显示,最低能检出3.64×101copies/μL ORFV(图3)。
1.2.1 引物设计与合成 以ORFV(GenBank Accession:JX142183)F1L基因的ORF为靶序列,采用Primer Premier 6.0引物设计3条引物,上游引物 ORF-P1:CGCAAGCCCGAGATGGTAA;下游引物 ORF-P2:CGAGCCCCATGAAGGAAAA;上游引物 ORF-P3:GATGAGGACGAACGGCTGGTA,提交上海捷瑞生物工程有限公司合成,上游引物ORF-P1与下游引物ORF-P2预期扩增465bp,上游引物ORF-P3与下游引物ORF-P2预期扩增DNA片段大小为450bp。
1.2.4 半套式PCR方法特异性试验 采用动物病毒DNA提取试剂盒提取ORFV XC13株细胞培养物、山羊痘病毒疫苗株、绵羊痘病毒疫苗株、禽痘病毒疫苗株等病毒DNA,ddH2O作为PCR扩增阴性对照,应用建立的半套式PCR进行扩增。
上述方法是直接对语句进行翻译,再加上注解,可保留原始语句。但解释过程中需要的时间比较长,也可以选择意译法来进行,直接对语句的含义进行范围,以对方国家的寓意来进行,这样能够节省大量交谈时间,对事物的理解间接达成一致。例如“She was born with a sliver spoon in her mouth,she can do what she likes.”其中“She was born with a sliver spoon in her mouth”直译为她出生时嘴里含着一支银勺子,这样直译就曲解了文章原有的意思,结合英语文化,可以意译为“她出生在富贵之家”。
有学者在《解放区发展民办小学的历史考察》中对解放战争时期小学教育进行了一定的研究。解放区在革命战争激烈的环境里,掀起了发展民办小学的热潮。解放区的民办小学是在 “民办公助”方针的指引下发展起来的。这个方针的提出和当时解放区正在进行的小学教育改革分不开。民办小学的发展加快了在解放区普及小学教育的步伐,体现了普及教育中的群众路线。
1.2.3 半套式PCR方法的建立
1.2.7 半套式PCR方法临床应用 分别采用羊传染性脓疱抗原检测ELISA试剂盒与所建立的半套式PCR方法对30份临床症状疑似ORF山羊组织样品进行检测。
2 结果
2.1 半套式PCR扩增及鉴定
采用所建立的半套式PCR方法,以提取的ORFV XC13株DNA为模板进行扩增,获得大小为450bp特异性扩增片段,与预期扩增DNA片段大小一致(图1)。回收、纯化、克隆至pGM-T载体上,测序后在GenBank中BLAST分析,与ORFV毒株的同源性达98%以上。

图1 半套式PCR扩增结果Fig.1 The amplification result of semi-nested PCR
2.2 特异性试验结果
对ORFV XC13株细胞培养物、山羊痘病毒疫苗株、绵羊痘病毒疫苗株和禽痘病毒疫苗株提取的DNA、ddH2O进行半套式PCR扩增,结果表明,所建立的PCR检测方法能够从ORFV XC13株细胞培养物中特异性扩增出450bp片段,而其余样品均未扩增出450bp片段,呈阴性(图2)。
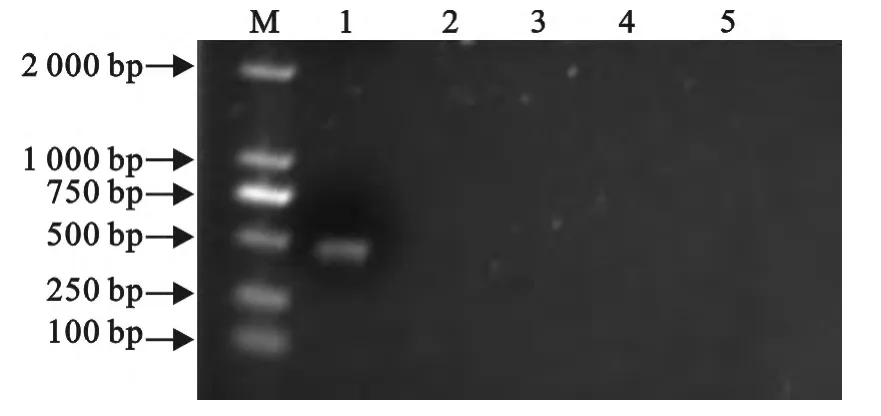
图2 半套式PCR特异性试验结果Fig.2 The specificity test of semi-nested PCR
2.3 敏感性试验结果
1.2.3.2 第2轮PCR扩增 采用50μL反应体系,取第1轮PCR产物1μL,2×Power Taq PCR Master Mix 25μL,上游引物 ORF-P3(10μmol/L)1.25μL,下游引物 ORF-P2(10μmol/L)1.25μL ddH2O 21.5μL。反应程序与第1轮PCR相同。取PCR产物50μL在10g/L琼脂糖凝胶中电泳,于凝胶成像系统中观察结果。

图3 半套式PCR敏感性试验Fig.3 The sensitivity test of semi-nested PCR
2.4 重复性试验结果
对不同稀释度同一DNA模板与4个不同稀释度DNA模板样品用建立的半套式PCR方法进行4次重复扩增,结果均为阳性,表明所建立的PCR检测方法具有良好稳定性。
2.5 半套式PCR检测方法的临床应用
应用ORFV ELISA抗原检测试剂盒对采集的30份临床疑似Orf病料进行检测,结果检出9份阳性,用建立的半套式PCR方法也检出9份阳性,结果与之一致,同时还从ELISA检测呈阴性的病料中检出2份为阳性。结果表明,所建立的PCR检测方法稳定性高、敏感性强。
3 讨论
ORFV属于痘病毒科(Poxviridae)脊椎动物痘病毒亚科(Chordopoxvirinae)副痘病毒属(Parapoxvirus)成员,基因组大小为134kb~139kb。该病毒中间为约130个编码基因组成大的中心编码区,两端为反向末端重复序列(inverted terminal repeat,ITR)[3]。 其 中 嵌 合 表 达 ORFV011 蛋 白 与ORFV059蛋白可以增强该病毒DNA免疫原性[4]。ORFV保守核心区内的F1L和B2L基因,保守性很高,目前根据B2L基因序列设计引物,建立了各种PCR检测方法并得到广泛应用。Modal B等[5]根据该基因建立了半套式PCR方法,能够检出低拷贝病毒粒子。Tsai S M等[6]利用B2L高度保守区,设计合成了6条引物,建立了诊断ORFV的LAMP方法,结果表明,该LAMP检测ORFV具有快捷、准确、敏感特点。Gallina L等[7]建立了Taq Man实时定量PCR方法,用于检测感染细胞、临床样品中的ORFV,检测效率高、重复性好。李前瑞等[8]根据ORFV B2L、F1L和VIR 3个基因设计引物,建立三重PCR方法,结果该方法能特异扩增出3个基因相应片段、特异性好。
在一个汽车维修团队中只有各司其职,通力合作,才能达到目标,成功=信念+智慧+勇敢+奉献。以上内容为笔者的的一些看法,读者朋友们与哪位主角的境遇相同?我想大家心中早已有定数。
本研究根据ORFV保守核心区另外一个保守性很高的F1L基因设计合成引物建立半套式PCR方法,在设计下游引物ORF-P2时,在该引物5′端额外添加碱基G、C,对保证扩增的特异性、敏感性起到了一定作用。经过特异性、敏感性、重复性试验,结果证实,该方法能特异性鉴别ORFV、SPV、GPV,最低检出量为3.64×101copies/μL,表明所建立的半套式PCR方法特异性好、敏感性高,能应用于临床样品检测。
社会意识形态、现代信息技术的不断发展是形成并传播当代大学生流行语的基本条件。当代社会生活节奏、文化交流速度不断加快,政府政策、生活方式不断转变,节奏、交流、政策、方式等方面的变化在大学生流行语中留下了相应的痕迹。大学生流行语的改变体现着现代社会发展的同时,也折射出当代国民社会文化价值观念,透露出社会各个层次的生活心态。可见,当代大学生流行语与现代社会之间相互依赖并相互依存。
ORFV已成为危害山羊健康的主要病毒之一,不可忽视,该病毒正在威胁我国绵羊业[9]。目前暂无有效疫苗对Orf进行预防,一旦发病,为避免与SPV、GPV混淆,应及时鉴别诊断,隔离Orf发病羊,采取相应治疗措施,加强环境消毒。
[1]颜新敏,张 强,吴国华,等.双重PCR快速鉴别羊痘病毒和羊口疮病毒[J].中国人兽共患病学报,2008,24(10):945-948.
[2]Georgiades G,Katsarou A,Dimitroglou K.Human ORF(ecthyma contagiosum)[J].J Hand Surgery(British and European Volume),2005,30(4):409-411.
[3]Delhon G,Tulman E,Afonso C,et al.Genomes of the parapoxviruses ORF virus and bovine papular stomatitis virus[J].J Virol,2004,78(1):168-177.
[4]Zhao K,He W,Gao W,et al.Orf virus DNA vaccines expressing ORFV 011and ORFV 059chimeric protein enhances immunogenicity[J].Virol J,2011,8(1):1-12.
[5]Mondal B,Bera A,Hosamani M T,et al.Detection of orf virus from an outbreak in goats and its genetic relation with other parapoxviruses[J].Vet Res Commun,2006,30(5):531-539.
[6]Tsai S M,Chan K W,Hsu W L,et al.Development of a loopmediated isothermal amplification for rapid detection of orf virus[J].J Virol Meth,2009,157(2):200-204.
[7]Gallina L,Dal Pozzo F,Mc Innes C,et al.A real time PCR assay for the detection and quantification of orf virus[J].J Virol Meth,2006,134(1):140-145.
[8]李前瑞,李 杰,田婷婷,等.羊口疮病毒多重PCR检测方法的建立[J].动物医学进展,2013,34(6):36-38.
[9]Zhao K,Song D,He W,et al.Identification and phylogenetic analysis of an Orf virus isolated from an outbreak in sheep in the Jilin province of China[J].Vet Microbiol,2010,142(3):408-415.

