植物水提液卵表面处理对螟黄赤眼蜂寄生柞蚕卵的影响1)
李天昊 张 波 王秀梅 杜文梅 阮长春
(吉林农业大学,长春,130118)
赤眼蜂是膜翅目,赤眼蜂科,赤眼蜂属的一类卵寄生蜂的统称,国内外广泛应用其防治各种农林鳞翅目害虫。柞蚕(Antheraea pernyi)主产于我国北方地区,是我国的特产,以柞蚕卵繁殖赤眼蜂单卵蜂数高,出蜂雌性比例高,繁蜂量大,繁殖效率高[1],易于实现规模化繁育。螟黄赤眼蜂(Trichogramma chilonis)能够利用柞蚕卵进行人工繁殖,由于其分布区域广泛,寄主种类多样,可用于防治棉铃虫(Helicoverpa armigeraHubner)、大豆食心虫(Leguminivora glycinivorella)、稻纵卷叶螟(Cnaphalocrocis medinalis)、玉米螟(Ostrinia furnacalis)、小菜蛾(Plutella xylostella)、杨二尾舟蛾(Cerura menciana)、银杏大蚕蛾(Dictyoploca japonica)和青刺蛾(Latoia consocia)等多种农林害虫[1-2],故具有很高的应用发展潜力。但目前在柞蚕卵繁育螟黄赤眼蜂的实践中,存在寄生率和羽化率等繁蜂指标偏低、不稳定,连续繁殖效率低等问题[3],导致投入产出比不稳定,繁蜂成本偏高,难以扩大生防应用规模。
目前,围绕柞蚕卵繁育螟黄赤眼蜂的适宜生态条件已开展了一定量研究,基本确定了其繁育的温湿度条件[4-6],并围绕螟黄赤眼 蜂对昆 虫源物质[7-10]、植物源物质[11-15]以及放射性物质[16]的反应开展了一定量探索性研究工作。已有报道显示,多种昆虫源与植物源物质可使螟黄赤眼蜂产生趋避反应,改变其滞留时间[8-14],在寄主卵表面涂覆昆虫源活性物质能够提高螟黄赤眼蜂对寄主卵的寄生效果[9]。万方浩等[9]研究了棉铃虫雌蛾腹部鳞片正己烷提取液的有效成分,认为C12-C36的直链烷烃类物质具有引诱产卵的刺激活性。开展柞蚕卵繁育螟黄赤眼蜂的生防生产,从规模化实施的角度考虑,在目前昆虫源活性物质成分与结构尚未明确,无法人工合成的情况下,由于昆虫源粗提物难以大量获取故而不适合作为规模化生产的原料来源。相对而言,虽然在“植物—植食性昆虫—天敌昆虫”这一生态关系中昆虫源物质对螟黄赤眼蜂繁殖活动的刺激更为直接,但植物源物质同样对螟黄赤眼蜂具备较强吸引作用且易于大量获取,能够符合规模化生防生产需求。基于此,笔者在前人工作的基础上,考察比较相关植物源物质对螟黄赤眼蜂寄生柞蚕卵的影响,并优选形成一种可操作的卵表面处理方法,为推进柞蚕卵繁育螟黄赤眼蜂的规模化应用提供参考。
1 试验材料
昆虫材料:供试螟黄赤眼蜂采自吉林省长春市水稻田与大豆田中,原寄主为水稻二化螟(Chilo suppressalis)卵与大豆食心虫卵,经解剖外生殖器进行分类鉴定,纯化建立试验种群后,在实验室条件下,即(25 ±2)℃、相对湿度(55 ±5)%、光/暗(14 h/10 h)下以柞蚕卵为寄主卵繁育保存。试验前以米蛾(Corcyra cephalonica)卵转繁1 代后,用柞蚕卵连续繁殖1 ~3 代,作为蜂种。供试柞蚕茧购自辽宁省铁岭市西丰县蚕区。在实验室条件下,即(25 ±2)℃、相对湿度(55 ±5)%、光/暗(14 h/10 h)下暖茧发蛾,取新羽化柞蚕蛾剖腹卵供试。
植物材料:以已有报道中对螟黄赤眼蜂具有吸引作用的植物、螟黄赤眼蜂自然种群分布生境中的建群植物为主,以上述两类植物的分类学相关植物和伴生植物为辅,选择其中吉林地区易于获得的部分植物材料作为供试材料,包括6 科14 种植物(表1,表2)。
对照材料:葡萄糖[17](分析纯),北京化工厂。
2 试验方法
2.1 处理液制备
植物水溶液制备:取供试材料鲜体适量,去除外表面部分,将其内部供试部位用榨汁机榨汁(供试部位见表1,表2),经80 目筛网过滤,获得鲜汁作为母液,母液用蒸馏水稀释5、10、15、20、25 倍作为不同浓度的供试溶液。
对照水溶液制备:称取葡萄糖粉末1 g 于烧杯中,加入蒸馏水100 mL,配制获得0.01 g/mL 葡萄糖供试液。
2.2 柞蚕卵准备
取新羽化未交配柞蚕雌蛾经绞肉机破碎获得剖腹卵,经清水漂洗去杂至肉眼观察表面洁净后,晾干,挑除绿卵、杂色卵及形状不规则卵粒,选择色泽均匀、外形饱满、大小一致的健康卵粒作为供试寄主卵。
2.3 生物测定
供试材料初筛:以6 科10 种植物材料(表1)的10 倍稀释供试溶液浸泡柞蚕卵,晾干后作为子代寄主卵接蜂,以葡萄糖供试溶液作为营养对照溶液,以蒸馏水溶液浸泡作为空白对照处理,每处理柞蚕卵15 mL,浸泡时间为4 min。生测时,各处理柞蚕卵分别盛放在无盖培养皿中,随机排列为一圆环,蜂种柞蚕卵9 mL 盛放在无盖培养皿中置于该圆环圆心处,总体接蜂比例为1∶ 20(9 mL∶ (15 mL×12)),将全部培养皿以10 cm 高塑料盖整体严密覆盖,塑料盖上具有100 目纱网通风口保障换气及湿度调节,置于无光环境下接蜂48 h。寄生环节结束后去除蜂种卵及残余活蜂,将各处理柞蚕卵分别置于繁蜂盒中发育至出蜂,出蜂5 d 后调查寄生率、羽化率,每次调查150 粒卵,5 次重复;出蜂前随机抽取20 粒寄生卵,每粒单独装于指形管内,待出蜂结束后调查单卵蜂数、单卵遗留蜂率,5 次重复。寄生环境为(25±2)℃、相对湿度(55 ±5)%、无光;发育环境为(25±2)℃、相对湿度(55 ±5)%、光/暗(14 h/10 h)。
十字花科植物材料复筛:根据初筛结果,对初筛优势材料甘蓝的同科植物进行复筛。选择甘蓝、花椰菜、油菜、白菜、萝卜5 种植物材料,以蒸馏水溶液浸泡作为空白对照处理,浸泡时间为4 min。生测时,蜂种柞蚕卵6 mL,每处理柞蚕卵20 mL,总体接蜂比例为1∶ 20(6 mL∶ (20 mL ×6)),试验方法及数据调查同初筛。
优势材料的处理条件优化:对复筛获得的优势材料花椰菜做进一步分析,考察处理液不同浓度以及不同接蜂比例对螟黄赤眼蜂繁育质量的影响。分别在1∶ 15、1∶ 20、1∶ 25 三个接蜂比例下,以花椰菜母液及5、10、15、20、25 倍稀释液进行寄主卵表面处理,浸泡时间为4 min,各处理单独于繁蜂盒中寄生及发育。待出蜂后调查寄生率、羽化率、单卵蜂数、单卵遗留蜂率。寄生与发育环节的环境条件、数据调查方法同初筛试验。
优选材料的保存期检验:从原植物材料常温保存与处理液低温保存两方面考察了解优选材料的取材与保存方式。将花椰菜供试原材料于20 ℃保存,取保存0、1、2、4、6、8、10 d 植物材料制作20 倍稀释溶液供试;将花椰菜20 倍稀释供试溶液于4 ℃保存,取保存0、1、2、4、6、8、10 d 处理液供试;以蒸馏水溶液浸泡柞蚕卵作为空白对照,浸泡时间为4 min。将各处理在1∶ 20 比例下于繁蜂盒内单独接蜂,48 h 后去除蜂种发育至出蜂,调查寄生率、羽化率、单卵蜂数、单卵遗留蜂率。寄生与发育环节的环境条件、数据调查方法同初筛试验。
2.4 数据处理
使用统计软件DPS v14.10 进行试验数据处理,多重比较采用Tukey 法,寄生率、羽化率、单卵遗留蜂率采用反正弦平方根转换,单卵蜂数采用平方根转换[18]。
3 结果与分析
3.1 螟黄赤眼蜂对不同处理柞蚕卵的自主选择
试验种群对各处理寄主卵表现出较强的选择差异,各处理寄生率普遍高于CK 并与其具有显著性差异,其中甘蓝处理组增幅最高;西红柿、青椒、甘蓝及桃处理组的羽化率显著高于CK;桃与苹果处理组单卵蜂数显著高于CK;各处理组的单卵遗留蜂率与CK 间无显著性差异(表1)。综合各项指标,十字花科的甘蓝处理组繁育效果最佳。桃处理组虽然子代增殖最高,但其单卵蜂数偏高易导致子代蜂摄入营养量偏低,进而降低繁殖质量,故不做选择。
试验种群对十字花科植物处理的寄主卵表现出一定程度的选择差异。花椰菜处理组的寄生率与CK 间存在显著性差异;油菜处理组的羽化率与CK间存在显著性差异,但其寄生率显著低于花椰菜处理组;各处理的单卵蜂数及单卵遗留蜂率与CK 间无显著性差异(表2)。综合各项指标,花椰菜处理组效果最佳。
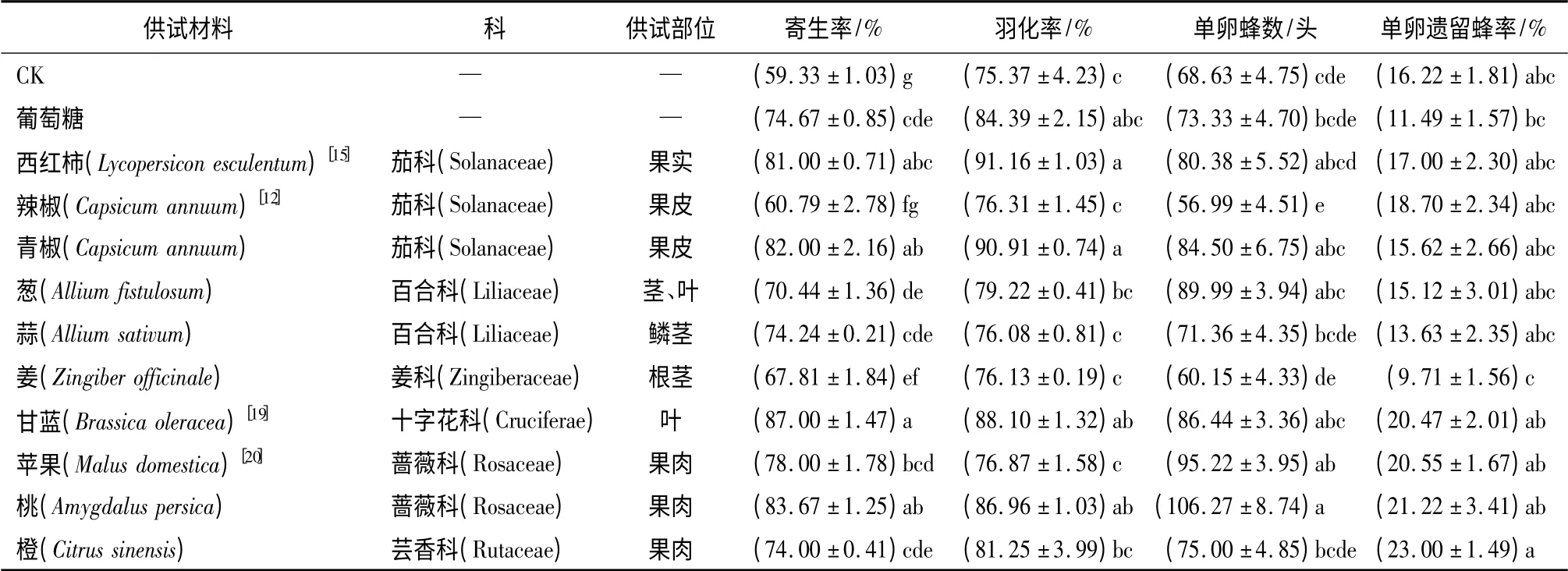
表1 螟黄赤眼蜂对不同卵表面处理柞蚕卵的自主选择(初筛)
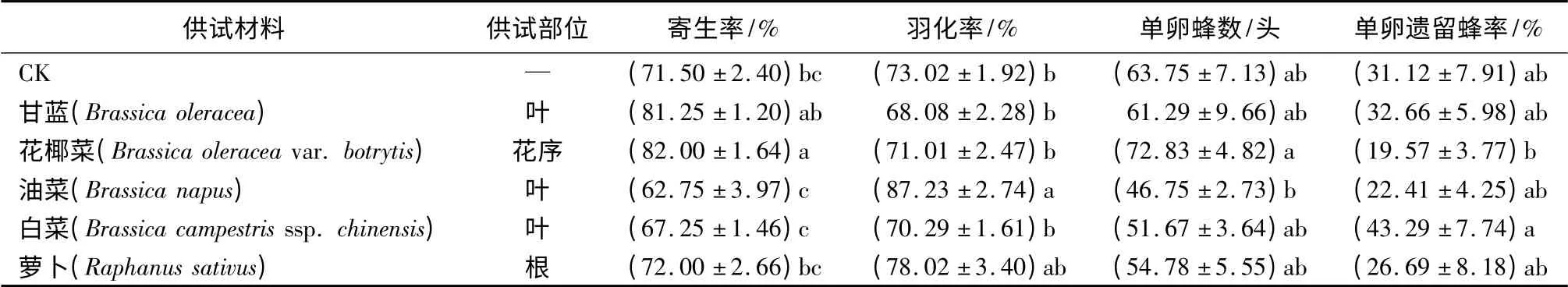
表2 螟黄赤眼蜂对不同卵表面处理柞蚕卵的自主选择(十字花科复筛)
3.2 优势材料处理条件优化
1∶ 15 接蜂比例下各处理组寄生率均处于较高水平;1∶ 20 接蜂比例下各组间寄生率开始出现差异,20 倍稀释液等处理组相对CK 表现出了显著的增效作用;1∶ 25 比例下各处理组寄生率均偏低,但20 倍稀释液处理组与CK 间仍存在显著性差异。各处理对羽化率、单卵蜂数及单卵遗留蜂率的影响均较小(表3)。
3.3 优选材料的保存期与有效性检验
植物材料室温存放6 d 以上出现腐斑,相应处理液组的寄生率显著下降,羽化率、单卵蜂数及单卵遗留蜂率与新鲜植物材料处理组间无显著性差异;处理液低温冷藏对处理组的寄生率、单卵遗留蜂率无显著影响,随冷藏时间延长,处理组的羽化率与单卵蜂数呈下降趋势,冷藏8 d 组羽化率与未冷藏组相比显著下降,冷藏10 d 组单卵蜂数与未冷藏组相比显著减少(表4)。

表3 不同处理液浓度及接蜂比例对柞蚕卵繁育螟黄赤眼蜂的影响

表4 优选材料的保存期与有效性检验
4 结论与讨论
试验结果表明,使用花椰菜、甘蓝、青椒、桃等植物供试溶液进行卵表面处理有利于螟黄赤眼蜂寄生柞蚕卵,其中,花椰菜供试溶液处理效果最佳。在1∶ 20 接蜂比例下,花椰菜鲜榨汁20 倍稀释液卵表面处理后螟黄赤眼蜂对柞蚕卵的寄生率显著提高,羽化率、单卵蜂数、单卵遗留蜂率与CK 间无显著性差异。花椰菜植物材料的保鲜对处理效果有较大影响,出现腐斑后处理组的寄生率会显著下降。花椰菜处理液可于4 ℃保存,在存放4 d 内仍具有较好增效活性。在各接蜂比例下,经花椰菜鲜榨汁20 倍稀释液进行卵表面处理均可将螟黄赤眼蜂对柞蚕卵的寄生率等繁育指标稳定于较高水平,该方法将有助于解决螟黄赤眼蜂生产中繁育效果不稳定的问题。试验中,卵表面处理主要对寄生率产生影响,而羽化率、单卵遗留蜂率等指标由于主要受发育环节的影响,故在各处理组间差异较小;在寄生率显著提升的同时,羽化率等指标未出现显著下降,也证明了新增加的寄生量是有效的,植物源物质对螟黄赤眼蜂产生了实质性有利影响而非欺骗性影响。卵表增效作用一方面可能是引入了外源促进物质,另一方面也可能是引入的外来物质消除或屏蔽了卵表面原有抗性物质的作用,其作用机制还需做进一步的研究。
本研究中,植物材料的选择以已有报道为根据,包括对螟黄赤眼蜂具有吸引作用的西红柿和辣椒,以及螟黄赤眼蜂自然种群分布生境的建群植物甘蓝和苹果。青椒和葱、蒜、姜分别是辣椒的营养与辛辣对照;桃、橙是根据苹果相关报道选择的补充材料。植物材料供试部位的选择以市售易得为基本条件,以便于开展生防生产时能够大量获取,具体使用的部位主要是植物果实、块茎、块根及叶类植物整体,亦与植物体内代谢物质的汇集部位基本一致。葡萄糖是自然界分布最广且最为重要的一种单糖,是生物的主要供能物质,且较蜂蜜等类物质更易于定量,故用其作为单纯补充营养的对照处理。葡萄糖水溶液与供试材料中含糖量较高的苹果、桃、橙等(每100 g 中含碳水化合物8 ~15 g)的10 倍稀释水溶液含糖量相近。与植物供试溶液的处理效果相比,葡萄糖水溶液卵表面处理生测效果偏低,该结果显示单纯补充营养可改善螟黄赤眼蜂繁殖效果,但并不是供试植物材料增效作用的主要来源。初筛、复筛试验中,由于蜂种能够对各处理的寄主卵进行自由选择,故在试验规定时间内各处理间受蜂种选择偏好影响在寄生率上出现了较大差距,但仅依据该结果还不足以确定各低值处理组对螟黄赤眼蜂寄生柞蚕卵存在抑制作用。不同稀释倍数处理液生测试验结果显示,处理液具有类似于植物化感物质的“低促高抑”现象,该现象表明水提液中可能存在有利于螟黄赤眼蜂繁殖活动的化学信号物质,该物质在浓度高于适宜浓度区间后并不有利于受体对象的生理活动,这一趋势也同时反证了营养物质并非供试植物材料增效作用的主要来源。
在利用柞蚕卵繁育赤眼蜂的生产工艺流程中,柞蚕剖腹卵经清水漂洗去杂至肉眼观察表面洁净后,使用水溶性消毒剂进行卵表面消毒,而后晾干作为寄生环节的子代寄主卵使用,依据现有工艺,筛选获得水溶性增效物质与消毒处理合并为“消毒—增效”环节最为经济可行。若使用有机溶剂筛选,一方面,存在有机溶剂破坏卵内生物膜结构进而造成内容物流失破坏的风险,最终难以形成卵表面处理工艺;另一方面,在利用有机溶剂筛选获得了活性物质并成功形成了处理工艺的情况下,与使用水溶液相比也将增加成本,且因其不能与消毒处理同时进行必须增加新的工艺环节,若增效处理在先,后续的消毒处理很可能稀释消除已涂覆的增效物质;反之,若消毒处理在先,后续的增效处理也可能引入新的微生物污染。故本研究中使用水溶液进行活性物质筛选,并根据消毒剂处理时间将水溶液浸泡时间统一为4 min。后续工作中,将以本研究筛选获得的优选材料与消毒剂进行联合使用,并进一步优化形成“消毒—增效”联合处理工艺,供柞蚕卵繁育螟黄赤眼蜂的规模化生防生产参考。
[1] 李丽娟,鲁新,刘宏伟,等.螟黄赤眼蜂人工繁殖与应用技术的研究进展[J].吉林农业科学,2005,30(3):23-28.
[2] 李飞,于洪君.赤眼蜂在林业上的应用[J].吉林林业科技,2004,33(5):31-33.
[3] 郭文超,吐尔逊,何江,等.螟黄赤眼蜂繁蜂质量监测与评价[J].中国生物防治,2005,21(4):227-230.
[4] 鲁新,李丽娟,张国红.温度对螟黄赤眼蜂不同品系的影响[J].吉林农业科学,2003,28(5):18-21.
[5] 孙光芝,阮长春,崔振礼,等.温度对赤眼蜂寄生亚洲玉米螟的影响[J].吉林农业大学学报,2000,22(1):38-40.
[6] 张青文,王立和,杨淑霞,等.螟黄赤眼蜂在棉田的有效扩散距离及其影响因素的研究[J].昆虫学报,1998,41:68-75.
[7] Ananthakrishnan T N,Senrayan R,Murugesan S,et al.Kairomones of Heliothis armigera and Corcyra cephalonica and their influence on the parasitic potential of Trichogramma chilonis (Trichogrammatidae:Hymenoptera)[J].Jouranl of Biosciences,1991,16(3):111-119.
[8] Boo K S,Yang J P.Kairomones used by Trichogramma chilonis to find Helicoverpa assulta Eggs[J].Journal of Chemical Ecology,2000,26(2):359-375.
[9] 万方浩,仝赞华,陶淑霞,等.引诱赤眼蜂产卵的他感化合物活性物质的提取及分析[J].中国农业科学,2001,34(3):277-282.
[10] 吕燕青,陈科伟,何余容,等.四种赤眼蜂对米蛾利他素的嗅觉反应[J].华南农业大学学报,2006,27(4):14-17.
[11] Romeis J,Shanower T G,Zebitz C P W.Volatile plant infochemicals mediate plant preference of Trichogramma chiloni[J].Journal of Chemical Ecology,1997,23(11):2455-2465.
[12] Boo K S,Yang J P.Olfactory response of Trichogramma chilonis to Capsicum annuum[J].J Asia-Pacific Entomol,1998,1(2):123-129.
[13] 郑礼,郑书宏,宋凯.螟黄赤眼蜂与绿豆和棉花植株间协同素研究[J].华北农学报,2003,18(院庆专辑):108-111.
[14] Paul A V N,Srivastava M,Dureja P,et al.Semiochemicals produced by tomato varieties and their role in parasitism of Corcyra cephalonica (Lepidoptera:Pyralidae)by the egg parasitoid Trichogramma chilonis (Hymenoptera:Trichogrammatidae)[J].International Journal of Tropical Insect Science,2008,28(2):108-116.
[15] Thirumurugan A,Joseph M,Sudhagar R,et al.Improving efficacy of Trichogramma chilonis against shoot borer,Chilo infuscatellus (Snellen)in sugarcane ecosystem of tropical India[J].Sugar Tech,2006,8(2/3):155-159.
[16] 王恩东,李咏军,刘晓辉,等.60Coγ 射线低剂量辐照对螟黄赤眼蜂生活力的刺激作用[J].核农学报,2004,18(5):406-410.
[17] 江西大学生物系生物防治科研组.补充营养对赤眼蜂寿命及繁殖力的影响[J].昆虫知识,1977(1):9-10.
[18] Tang Qiyi,Zhang Chuanxi.Data processing system (DPS)software with experimental design,statistical analysis and data mining developed for use in entomological research[J].Insect Science,2013,20(2):254-260.
[19] 连梅力,李唐,张筱秀,等.甘蓝夜蛾卵赤眼蜂种类调查及利用研究[J].中国植保导刊,2010,30(6):5-7,22.
[20] 张金勇,陈汉杰,邱同铎.果园与周围农田间害虫天敌转移规律研究[J].北方果树,1996(4):13-14.

