核糖体蛋白激酶磷酸化程度与人乳头瘤病毒16感染情况的相关性分析
周 越 宁丽峰 侯 丽 辛 玲 王慧萍
国家人口计生委科学技术研究所(北京,100081)
人乳头瘤病毒 (HPV)的持续感染可以诱导正常表皮和黏膜上皮的非典型增生,重者可致肿瘤。目前的研究资料显示,几乎所有宫颈癌的发生都与HPV感染有关,此外在一些上皮性肿瘤组织如肛周、口咽、食管等部位也检测到HPV感染[1]。核糖体S6Ks蛋白激酶是c AMP-cGMP依赖性激酶和PKC激酶超家族成员之一,在细胞生长、繁殖和能量代谢过程中发挥重要作用。激酶的活性调节是通过一系列丝氨酸/苏氨酸位点的磷酸化和去磷酸化作用实现的,细胞因子、激素等细胞外刺激信号可引起激酶的快速活化[2-3]。另一方面,活化的S6Ks将上游信号传导给多种效应底物,比较著名的就是核糖体蛋白S6,后者作为真核细胞中核糖体40S亚基的组成元件,通过增加具有5′末段寡嘧啶序列结构的 mRNA翻译,达到诱导多种蛋白合成的作用[4-5]。以往研究发现,HPV16病毒感染体外细胞系,可以活化PI3K/Akt/m TOR信号通路,使该信号通路上的蛋白激酶S6K磷酸化,活化的S6K又可以进一步激活通路下游因子,从而促进肿瘤细胞生长、增殖等[6]。本研究进一步在体内肿瘤组织中检测S6K及S6的磷酸化水平,研究在肿瘤组织内HPV16病毒感染与S6K及S6蛋白磷酸化水平间的相关性,探讨其临床意义,为了解子宫颈鳞癌发病的分子生物学机制提供新的思路与佐证。
1 材料与方法
1.1 样本来源
收集临床确诊为宫颈鳞状细胞癌的组织样本135例,患者年龄21~78岁;其中高分化鳞癌21例,中分化鳞癌65例,低分化鳞癌49例。所有样本经甲醛固定、石蜡包埋制备组织切片(厚5μm),HE染色病理确诊。
1.2 仪器与试剂
多聚酶链反应(PCR)扩增仪(ABI公司,美国);紫外凝胶成像仪(Bio-RAD公司,美国);光学显微镜(OLYMPUS公司,日本)。HPV16-E7引物合成(上海申能博彩生物科技有限公司);PCR反应相关试剂(Promega公司,美国);抗核糖体蛋白激酶S6K和抗核糖体蛋白激酶S6单克隆抗体(Cell Signaling Technology公司,美国);免疫组化检测试剂盒(北京中杉金桥生物技术有限公司)。
1.3 石蜡组织DNA提取
病理组织切片分别经二甲苯脱蜡、梯度酒精水化、组织裂解液裂解、蛋白酶K消化后,再经酚/氯仿抽提、无水乙醇沉淀,最后溶于去离子水中,-20℃冰箱保存备用。
1.4 HPV16检测
用HPV16-E7特异性引物扩增标本DNA,扩增片段长97 bp,正向引物为5'-GATGAAATAGATGGTCCAGC-3',反向引物为5'-GCTTTGTACGCACAACCGAAGC-3'。常规PCR反应体系及反应条件,引物57℃退火45 s。扩增产物在1.5%琼脂糖凝胶中电泳,EB染色,紫外灯下观察结果,100bp附近出现特异性荧光区带判断为HPV16感染阳性。
1.5 免疫组织化学检测
1.5.1 检测程序 严格按照试剂盒使用说明进行。组织切片经二甲苯脱蜡、梯度酒精水化后,0.01 mol/L枸橼酸钠(p H 6.0)高温抗原修复,过氧化氢室温孵育10 min消除内源性过氧化物酶活性,血清白蛋白(BSA)室温封闭1 h,滴加一抗(S6K 1∶500、S6 1∶100)4℃过夜。后经生物素化二抗孵育、辣根过氧化物酶(HRP)标记、DAB显色、苏木素复染、封片。以PBS液代替一抗作为阴性对照。
1.5.2 结果判定 以肿瘤细胞胞浆、胞核或胞膜上出现棕黄色颗粒为阳性。每张切片随机选取5个高倍镜视野,计数1000个细胞,计算阳性细胞百分数,细胞无显色为0分,<25%为1分,25%~50%为2分,>50%为3分;按切片中细胞着色深浅评分,细胞未着色为0分,浅黄色为1分,黄色或黄褐色为2分,褐色为3分。将细胞着色百分比和着色程度得分乘积,0~1分为阴性(-),>1分为阳性(+)。
1.6 统计方法
采用SPSS 15.0统计软件,运用单因素方差分析和χ2检验进行统计分析,阳性率比较采用χ2检验,阳性率间相关性分析采用Spearman相关分析检验,检验标准以P<0.05为差异具有统计学意义。
2 结果
2.1 HPV16检测结果及病例分组
用特异性HPV16 E7引物对提取的标本组织DNA进行PCR扩增,结果显示宫颈鳞癌组织中HPV16阳性占73.3%(99例)。将阳性样本作为HPV16+组,阴性作为HPV16-组。
2.2 两种蛋白表达的免疫组化结果
2.2.1 磷酸化的S6K蛋白(p-S6K)表达 p-S6K 在宫颈鳞状细胞癌组织中的阳性染色主要位于细胞质(图1),p-S6K蛋白在HPV16感染阳性的宫颈鳞癌组织中表达阳性率为46.5%(46/99),在 HPV16感染阴性的组织中表达阳性率为8.33%(3/36),两者阳性率差异有统计学意义(χ2=14.99,P<0.05)。见表1。
2.2.2 磷酸化的S6蛋白(p-S6)表达 p-S6在宫颈鳞状细胞癌组织中的阳性染色主要位于细胞质(图1)。p-S6蛋白在HPV16感染阳性的宫颈鳞癌组织中表达阳性率为68.7%(68/99),在 HPV16感染阴性的组织中表达阳性率为30.6%(11/36),两者阳性率差异有统计学意义(χ2=14.28,P<0.05)。见表1。
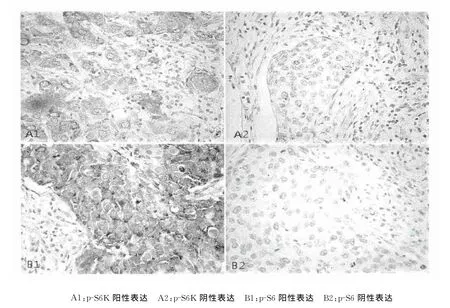
图1 p-S6K及p-S6蛋白在宫颈癌组织中的表达(HRP×400)

表1 两种蛋白在宫颈癌组织中的免疫组化检测结果比较
2.3 p-S6K蛋白表达与p-S6蛋白表达的相关性分析
46例p-S6K蛋白阳性表达的HPV16感染宫颈鳞癌组织中有37例p-S6蛋白呈阳性表达;31例p-S6蛋白阴性表达的HPV16感染宫颈鳞癌组织中有22例p-S6K蛋白亦呈阴性表达,两者的表达呈正相关性(r=0.095,P=0.019)。
3 讨论
HPV病毒作为重要的环境病因在宫颈癌中得到确认,它的存在直接或间接影响到宿主自身细胞正常的生长和繁殖,最终导致细胞恶性突变和肿瘤的发生。有关HPV病毒的具体致病机制人们进行了深入而细致的研究,发现HPV病毒本身并不具备自我复制的能力,需借助宿主细胞的DNA合成系统完成自身繁殖。而在高低危不同型别的HPV病毒中,这种作用机制又存在重大差异,低危型HPV病毒主要感染处于繁殖期的上皮细胞,借助细胞本身的周期循环达到自身复制;而高危型HPV病毒则感染处于分化末期的宿主细胞,这种细胞正常情况下已不具备DNA合成和蛋白翻译的功能,因此病毒要完成自身复制就必须使宿主细胞重新进入细胞周期。目前研究证明病毒编码的早期蛋白中,E6和E7发挥了重要的作用。首先高危型HPV病毒由E7蛋白结合多种细胞周期调控因子,如p Rb、p107和p130等,上调周期循环所需的G1/S转换和DNA合成信号[7-8];另一方面为了阻止宿主细胞针对非程序性繁殖所启动的凋亡破坏,病毒E6蛋白能与一系列具有防御抑癌功能的蛋白如P53形成复合物,经由E6AP泛素依赖性蛋白酶水解系统降解P53,抑制机体正常情况下对病毒的清除功能[9-10]。此外高危型HPV E6蛋白还能与机体多种调控蛋白如转录协调因子p300/CREB、h Mcm7、h-Dlg1、h TERT等相互作用,通过影响它们的活性表达达到控制细胞分化、信号传导、细胞极性以及DNA合成的目的[11-12]。尽管由最初的病毒感染到细胞的永生化乃至最终的肿瘤发生要经历漫长的阶段,期间需要多步骤多因素的协同作用,但人们普遍认为病毒蛋白中E7的作用主要是肿瘤发生初期启动细胞异常增长,而相应的E6蛋白的主要作用为促进肿瘤发展,加速良恶性肿瘤间的转换。
Lu等[13]通过酵母双杂交方法发现了一个新的与HPV16 E6特异性结合的蛋白Tuberin,是一种重要的肿瘤抑制蛋白,作用于m TOR蛋白上游发挥负性调节作用,抑制m TOR蛋白对下游因子S6K的激活。HPV16病毒的E6蛋白可以与Tuberin结合,通过E6AP泛素化途径降解Tuberin蛋白,释放其对下游因子的抑制作用,在没有上游胰岛素信号刺激的情况下磷酸化核糖体蛋白S6K和S6[14]。此后Spangle等[15]在稳定转染HPV16 E6的细胞系中检测到m TOR蛋白和p-S6K蛋白的持续活化,进一步证实HPV16 E6蛋白可能介导S6K的磷酸化,增加5'TOP m RNA的翻译,促进病毒蛋白的复制。
与上述研究结果相似,本研究检测了HPV16病毒感染和未感染的人子宫颈鳞癌样本中p-S6K和p-S6蛋白的阳性表达情况,结果显示感染了HPV16型的宫颈肿瘤组织内,核糖体蛋白S6K和S6的磷酸化比率明显高于未感染16型病毒的宫颈癌组织。两种蛋白相关性分析结果显示,p-S6K与p-S6蛋白在HPV16型病毒感染的宫颈癌组织中表达呈正相关性。
肿瘤的发生与发展是一个多因素多途径作用的结果,以往人们对肿瘤的研究多集中在癌基因和抑癌基因方面,细胞信号转导通路的阐明极大地丰富了人们对细胞癌变机制的认识。随着人们对于肿瘤细胞中PI3K/Akt/S6K信号通路如何控制蛋白翻译和细胞生长等研究的逐步完善,将有利于进一步了解肿瘤发生的生物学行为,为肿瘤的早期诊断和治疗提供一系列新的分子靶点。
1 Crosbie EJ,Einstein MH,Franceschi S,et al.Human papillomavirus and cervical cancer[J].Lancet,2013,382:889-899.
2 Miron M,Lasko P,Sonenberg N.Signaling from Akt to FRAP/TOR targets both 4EBP1 and S6K in Drosophila melanogaster[J].Mol Cell Biol,2003,23:9117-9126.
3 Easley CA,Ben-Yehudah A,Redinger CJ,et al.m TOR-mediated activation of p70 S6K induces differentiation of pluripotent human embryonic stem cells[J].Cell Reprogram,2010,12:263-273.
4 Jefferies HB,Fumagalli S,Dennis PB,et al.Rapamycin suppresses 5'TOP m RNA translation through inhibition of p70s6k[J].EMBO J,1997,16:3693-3704.
5 Schwab MS,Kim SH,Terada N,et al.p70S6K controls selective m RNA translation during oocyte maturation and early embryogenesis in Xenopus laevis[J].Mol Cell Biol,1999,19:2485-2494.
6 Surviladze Z,Sterk RT,De Haro SA,et al.Cellular entry of human papillomavirus type 16 involves activation of the phosphatidylinositol 3-Kinase/Akt/m TOR pathway and inhibition of autophagy[J].J Virol,2013,87(5):2508-2517.
7 Boulenouar S,Weyn C,Van Noppen M,et al.Effects of HPV-16 E5,E6 and E7 proteins on survival,adhesion,migration and invasion of trophoblastic cells[J].Carcinogenesis,2010,31(3):473-480.
8 Banerjee NS,Genovese NJ,Nova F,et al.Conditionally activated E7 proteins of high-risk and low-risk human papillomaviruses induce S phase in postmitotic,differentiated human keratinocytes[J].J Virol,2006,80:6517-6524.
9 Mesplède T,Gagnon D,Bergeron-Labrecque F,et al.P53 degradation activity,expression,and subcellular localization of E6 proteins from 29 human papillomavirus genotypes[J].J Virol,2012,86(1):94-107.
10 Mantovani F,Banks L.The human papillomavirus E6 protein and its contribution to malignant progression[J].Oncogene,2001,20:7874-7887.
11 Cavatorta AL,Fumero G,Chouhy D,et al.Differential expression of the human homologue of Drosophila discs large oncosuppressor in histologic samples from human papilloma virusassociated lesions as marker for progression to malignancy[J].Int J Cancer,2004,111:373-380.
12 Seo EJ,Kim HJ,Lee CJ,et al.The role of HPV oncoproteins and cellular factors in maintenance of h TERT expression in cervical carcinoma cells[J].Gynecologic Oncology,2004,94:40-47.
13 Lu Z,Hu X,Li Y,et al.Human papillomavirus 16 E6 oncoprotein interferences with insulin signaling pathway by binding to tuberin[J].J Biol Chem,2004,279:35664-35670.
14 Zheng L,Ding H,Lu Z,et al.E3 ubiquitin ligase E6AP-mediated TSC2 turnover in the presence and absence of HPV16 E6[J].Genes Cells,2008,13:285-294.
15 Spangle JM,Münger K.The human papillomavirus type 16 E6 oncoprotein activates m TORC1 signaling and increases protein synthesis[J].J Virol,2010,84(18):9398-9407.

