云南半细毛羊毛囊干细胞无血清培养体系的建立
吕春荣,权国波,欧阳依娜,沈 伟,洪琼花
(1.云南省畜牧兽医科学院,昆明 650224;2.青岛农业大学)
繁殖与生理
云南半细毛羊毛囊干细胞无血清培养体系的建立
吕春荣1,权国波1,欧阳依娜1,沈 伟2,洪琼花1
(1.云南省畜牧兽医科学院,昆明 650224;2.青岛农业大学)
试验旨在研究云南半细毛羊毛囊干细胞(hair follicle stem cells,HFSCs)的分离、培养及鉴定方法,为下一步的诱导分化研究奠定基础。方法:采用组织块法原代培养云南半细毛羊HFSCs。并对分离得到的细胞进行免疫组化鉴定。培养结果:HFSCs为贴壁生长细胞,体积小,核质比高,呈典型的铺路石状,在显微镜下折光性强、胞体透亮。免疫组化分析结果表明:细胞表达K14、不表达CD271。证明所培养的细胞为HFSCs。结论:试验采用组织块培养法初步建立了云南半细毛羊无血清培养HFSCs,这对于探讨云南半细毛羊毛囊生长发育调控机制以及成体干细胞增殖分化特性具有非常重要的意义。
云南半细毛羊;毛囊干细胞;分离培养
近年来,随着上皮生物学和组织工程皮肤研究的不断深入,毛囊干细胞(HFSCs)研究已成为国内外学者研究的热点。HFSCs来源丰富,取材方便,又避免了伦理和道德方面的限制。然而,目前HFSCs研究主要集中于人和小鼠,研究重点主要偏向于临床应用。研究发现,位于毛囊隆突部的HFSCs不仅对毛发周期的维持具有重要意义,而且与皮肤损伤修复、组织维持和更新、皮肤肿瘤的发生等都密切相关[1]。
开展云南半细毛羊HFSCs研究对于半细毛产业发展具有非常重要的意义。体外培养半细毛羊HFSCs,对于探讨半细毛羊毛囊生长规律、生长调节机制等研究奠定坚实的理论基础,并最终实现改善羊毛品质,提高羊毛产量和质量。有关绵羊HFSCs的报道,仅有郭婷婷等[2]开展了细毛羊HFSCs分离培养方法比较研究。一些学者开展了山羊HFSCs的研究。史明艳等[3]研究结果表明:组织块法和酶消化法均能分离得到山羊HFSCs并进行传代,但随着传代次数的增加,组织块法获得的细胞免疫组化染色阳性率、克隆形成率以及传代能力均显著
高于酶消化法获得的细胞。此外,也有学者开展了羊驼HFSCs的研究。弓慧敏等[4]分离得到羊驼单个毛囊,再利用0.2%的中性蛋白酶消化获得HFSCs并进行细胞培养。
本试验首次建立了无血清HFSCs培养体系,并进行了形态学和分子标记物鉴定,初步证明培养的细胞为HFSCs。该项研究对于探索半细毛羊毛囊生长发育规律具有非常重要的意义。同时为下一步HFSCs诱导分化研究奠定了坚实的实验基础。
1 材料与方法
1.1 试验动物
云南半细毛羊由云南省畜牧兽医科学院实验基地提供,试验用组织块取自成年羊背部皮肤。
1.2 主要试剂
胰蛋白酶和青链霉素溶液(PS)购自Bioind公司;DMEM/F12和 B27购自 Gibco公司;b-FGF购自 PEPROTECH公司;表皮生长因子(EGF)和K14购自Abcam公司;CD271购自Pierce公司。其余试剂如无特殊说明,均购自Sigma公司。
1.3 试验方法
1.3.1 HFSCs的分离培养 取云南半细毛羊背部皮肤样本0.5 cm×0.5 cm×0.5 cm,75%酒精浸泡2 min,然后用生理盐水+1%PS洗3次,手术刀片刮去皮肤表面污物。手术剪和镊子剔除多余脂肪及结缔组织后,剪成0.1 cm×0.1 cm×0.3 cm的皮肤块。将皮肤块在缓冲液(DMEM-F12+1%PS)中洗3次。体视镜下用眼科镊将毛囊从皮肤真皮层拔出。毛囊收集后在缓冲液中洗3次后,移入12孔板中,每孔4~6根,加入0.5 mL培养液,培养液:DMEM-F12+bFGF 40 ng/mL+EGF 20 ng/mL+B27 20 μL/mL+1%PS。最后放入培养箱(37℃、5%CO2、饱和湿度)中培养。体视显微镜观察、照相、记录细胞迁移和增殖情况。
1.3.2 HFSCs的传代培养 当细胞长至80%时,将培养液弃去,PBS清洗3次,加入0.125%胰酶(含0.01%EDTA)在37℃消化5~8 min后,倒置显微镜下观察,细胞开始变圆时加细胞培养液终止消化,反复吹打细胞使其完全脱落,以1:2的比例进行传代。倒置显微镜下观察传代细胞生长状况,并拍照。
1.3.3 HFSCs的免疫组化鉴定 制备细胞爬片,参照各抗体说明进行K14、CD271免疫荧光检测。步骤如下:细胞爬片用PBS缓冲液(pH值7.2~7.4)清洗3次,每次5 min;4%的多聚甲醛室温固定30 min,PBS缓冲液清洗3次,每次5 min;0.3%TritonX-100处理10 min,PBS缓冲液洗3次,每次5 min;用含10%山羊血清的PBS在37℃,封闭30 min;PBS缓冲液清洗3次,每次5 min;滴加适当稀释的一抗,对照组用PBS代替一抗,置于湿盒内,4℃过夜。PBS缓冲液清洗3次,每次5 min;滴加稀释后的荧光素标记二抗IgG,置于湿盒内,37℃保温1 h。PBS缓冲液PBS洗3次,每次5 min。放置激光共聚焦显微镜下观察并拍照。
2 结果与分析
2.1 HFSCs原代培养
从毛囊迁移出来的上皮样细胞贴壁生长(平均约5 d),细胞呈镶嵌多角形,折光性强,表现为铺路石样;核大而明显,多偏居于细胞一侧(如图1A所示)。2~3 d后,细胞开始汇合,最终形成密集的片状克隆(如图1B所示)。
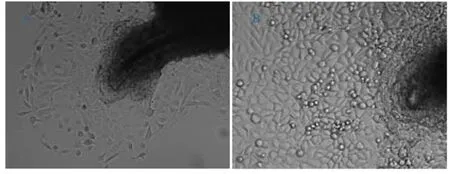
图1 组织块法培养HFSCs形态
2.2 HFSCs传代培养
传代培养的云南半细毛羊HFSCs放大后清晰可见,细胞间界限明显,呈铺路石样,核质比大,多个核仁(如图2A、2B所示)。形态上完全符合HFSCs的基本特征。
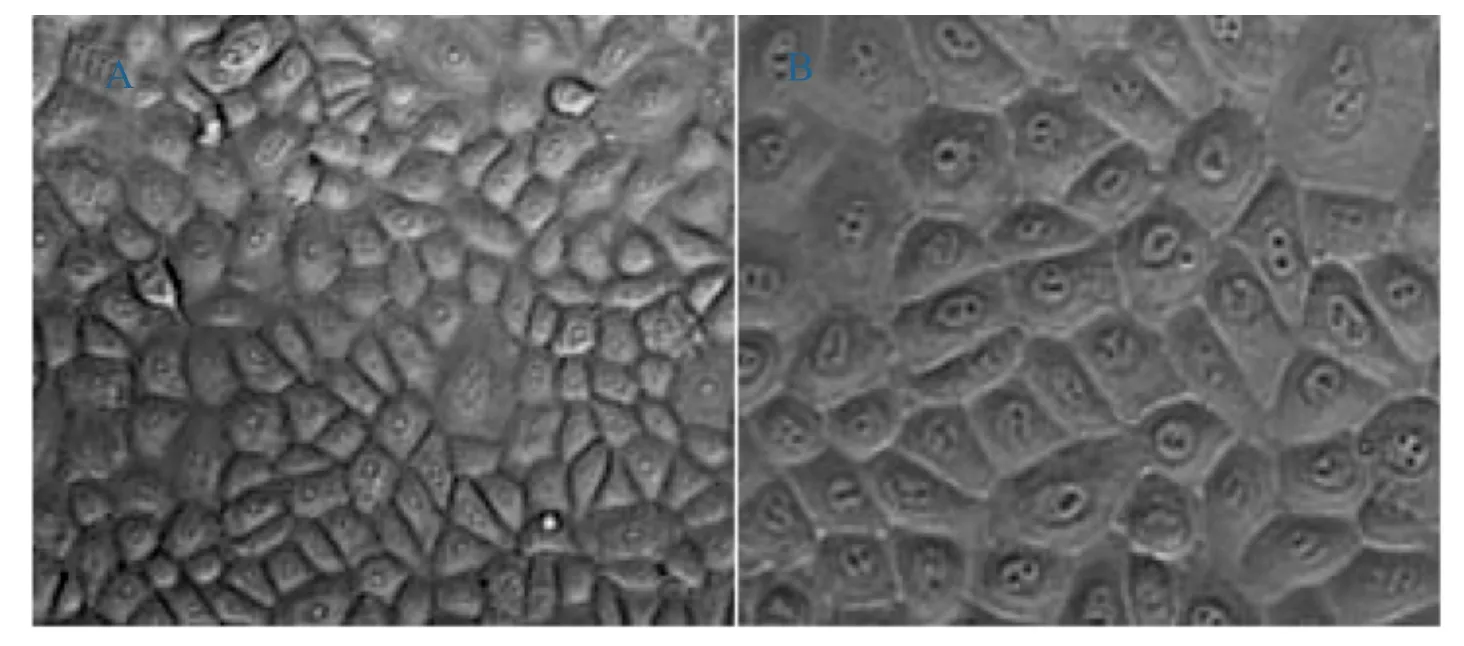
图2 第3代HFSCs形态
2.3 HFSCs的免疫组化鉴定
由于HFSCs尚无高度特异性的表面标志,因此本试验采取K14、CD271对其进行共同鉴定。免疫组化结果表明,HFSCs表达K14(如图3B所示),而不表达CD271(如图3A所示)。通过对原代和第5代细胞进行鉴定后,笔者认为所培养的细胞为HFSCs。

图3 组织块法培养HFSCs形态
3 讨论
目前,HFSCs研究多集中于人和小鼠。实验室研究多以鼠触须为模型,从中分离隆突部干细胞。由于鼠触须不仅毛囊体积大,而且隆突部位明显,易于显微操作。在显微镜下分离、切取毛囊后,用酶直接消化隆突部,获得单个细胞。还有报道从人头枕部毛发分离干细胞,主要采取拔毛法,从枕部皮肤中拔出完整毛囊,然后用胰酶消化获得干细胞。根据目前报道,国内外尚未见到绵羊HFSCs体外无血清培养体系。本试验组用DMEM-F12+bFGF 40 ng/mL+EGF 20 ng/mL+B27 20 μL/mL+1%PS无血清培养液,首次建立了绵羊HFSCs体外无血清培养体系,并对获得的HFSCs进行了形态学和分子标志物鉴定,初步证实培养的细胞为HFSCs。
3.1 HFSCs体外无血清培养
体外培养HFSCs所用培养液根据是否添加有血清,分为有血清培养体系和无血清培养体系。传统的细胞培养方法必须在培养液中加入一定比例的血清以利其生长,但各血清间所含的生长因子和激素以及其他一些因素随批次的变化非常大,这就影响了对细胞生长的调节机制。杨婷等[5]比较无血清及含胎牛血清培养基培养的人脐带间充质干细胞(UC-MSC)生物学特性,寻求无血清的UC-MSC培养方法。结果表明:无血清培养基培养的UC-MSC细胞较小、传代增殖潜能较强、无异种蛋白,而且抑制T细胞增殖作用更明显。体外培养和扩增大鼠
毛囊Bulge细胞,无血清的K-SFM培养基较有血清DMEM-Fl2培养基更有利于Bulge细胞的扩增和表型的维持[6]。
很多试验研究证实,无血清培养基更有利于毛囊的生长。张兆远[7]通过对济宁青山羊皮肤毛囊体外培养研究得出:对于山羊游离毛囊的体外培养,无血清的Williams E培养基、DMEM培养基均是适宜的,但在Williams E培养基中的生长速度更快,说明Williams E培养基更适合山羊游离毛囊的培养。崔志峰等[8]建立了适宜山羊毛囊体外培养的无血清培养基,通过添加谷氨酰胺、氢化可的松、胰岛素、转铁蛋白、亚硒酸钠等成分,在31℃、95%空气和5%CO2条件下,可将山羊毛囊培养到30d以上,并确定添加血管内皮生长因子和表皮生长因子可促进毛囊的生长。
国内学者对细毛羊和山羊HFSCs进行了研究,并初步建立了HFSCs的分离和培养技术体系,但他们采用的培养体系并不是无血清培养体系[2-3]。在体外培养状态下,如何长期保持干细胞的生物学特性至今仍是个难题。成分复杂的培养基中血清是个难以去除的干扰因素。本试验首次使用无血清的DMEM-F12培养基培养云南半细毛羊HFSCs,并使其在体外培养条件下能较好地保持其生物学特性。从而为体外稳定培养HFSCs及进一步研究其分化提供了坚实的实验基础。
3.2 HFSCs的鉴定
不同种类的干细胞都具有各自的形态特征。这也是鉴定干细胞的传统方法之一。从细胞的形态上来说,本试验分离培养的细胞呈立方形,细胞体积小,细胞大小一致,核大而明显且多偏居于细胞一侧,核浆比大,表面多隆起,皱折少,可初步判定为HFSCs。
体内HFSCs用标记滞留法鉴定,而体外分离培养的HFSCs则用特异性标记来鉴定。Ma等[9]报道潜在的HFSCs特异性标记主要包括:β1-integrin、K15、K19、转铁蛋白、受体CD71、CD34及转录因子P63等。Kaur等[10]的试验结果表明,HFSCs表达高水平的β1-integrin。目前比较公认HFSCs标志主要有K19[10]、β1-integrin[11]、CD34[12],和K15等[13]。
本研究免疫组化结果发现,所分离的HFSCs高表达K14,表达率92%,而不表达CD271。本试验结果与史明艳等[14]、Inoue等[15]的报道相符。
4 结论
本研究对绵羊HFSCs的培养进行了尝试,首次建立了云南半细毛羊HFSCs无血清培养体系,并进行了初步验证。然而,鉴于目前国内外绵羊HFSCs的研究报道相对较少,因此应采用更有利的技术手段,如流式鉴定、诱导分化,来证明所培养的细胞是HFSCs。该项研究对于探讨半细毛生长发育规律以及成体干细胞增殖分化特性研究具有非常重要的意义。
[1]Paus R,Cotsarelis G.The biology of hair follicles[J].N Eng J Med,1999,341(7):491-497.
[2]郭婷婷,张世栋.细毛羊毛囊干细胞分离培养方法比较研究[J].中国畜牧兽医,2013,40(7):148-152.
[3]史明艳,杨学义,窦忠英.山羊HFSCs分离培养方法研究[J].畜牧兽医学报,2006,37(5):436-440.
[4]弓慧敏,庞全海.羊驼毛囊干细胞分离培养的研究[C]//中国畜牧兽医学会兽医产科学分会第五届全体会议第十次学术研讨会论文集.2009:131-134.
[5]杨婷,陈广华.无血清和含胎牛血清培养基培养的脐带间充质干细胞生物学特性比较研究[J].中华血液学杂志,2012,33(9):715-719.
[6]符刚,高国强.无血清K-SFM培养条件下大鼠毛囊Bulge细胞生物学特性的研究[J].第三军医大学学报,2005,27(15):1538-1540.
[7]张兆远.济宁青山羊皮肤毛囊体外培养和基因表达差异研究[D].泰安:山东农业大学,2008.
[8]崔志峰,赵晶,王慧,等.不同培养基对山羊毛囊体外培养的影响研究[J].山东大学学报:理学版,2008,43(5):105-109.
[9]Ma DR,YangE N,Lee ST.Areview:the location,molecular characterisation and multipotencyof hair follicle epidermal stemcell[J].Anim Acad Med Singapore,2004,33:784-788.
[10]Kaur P,Li A.Adhesive properities of human basal epidermal cells:an analysis of keratinocyte stem cells,transit amplifying cells,and postmitotic differentiatingcells[J].Invest Dermatol,2000,114(3):413-420.
[11]Trempus C S,Morris R J,Bortner C D,et al.Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34[J].Invest Dermatol,2003,120(4):501-511.
[12]Clausen F,Potten CS.Heterogeneityofkeratinocytes in the epiidermal basal celllayer[J].Cutan Pathol,1990,17:129-143.
[13]Misago N,Narisaway Y.Cytokeratin 15 expression in apocrine mixed tumors of the skin and other benign neoplasms with apocrine differentiation[J].Dermatol,2006,33(1):2-9.
[14]史明艳,高雪,杨学义,等.山羊毛囊干细胞分离、培养及鉴定[J].畜牧兽医学报,2008,39(12):1679-1683.
[15]Inoue K,Aoi N,SatoT,et al.Differential expression ofstem-cell-associated markers in human hair follicle epithelial cells[J].Laboratory Investigation,2009,89:844-856.
Establishment of Serum Free Culture of Hair Follicle Stem Cell in Yunnan Semi-fine Wool Sheep
LvChun-rong,Quan Guo-bo,HongQiong-hua,et al
(Yunnan AcademyofAnimal and VeterinarySciences,Kunming650224,China)
This experiment was aimed to study the separation,culture and identification methods of hair follicle stem cells(HFSCs):for the development offurther research on cell differentiation.Method:The tissue piece culture method was used to separate and culture HFSCs.Then the cultured cells were identified by immunohistochemistry.Result:The established HFSCs exhibited adherent growth type,small volume,high nucleus/cytoplasmratio,high refractivityand transparent cell appearance.Immunofluorescence assay indicated that Yunnan semi-fine wool sheep HFSCs expressed K14,not expressed CD271.These results further proved that the cultured cells were indeed HFSCs.Conclusion:A serum free culture system of Yunnan semi-fine wool sheep HFSCs was established using the tissue piece culture method.This study is very important for investigation of the regulation mechanismofdevelopment ofwool follicle and the characterstics of proliferation and differentiation ofHFSCs.
Yunnan semi-fine wool sheep;HFSCs;separation and culture
S826
A
2095-3887(2014)05-0022-04
10.3969/j.issn.2095-3887.2014.05.006
2014-06-04
国家现代农业产业技术体系建设(CARS-40);云南省应用基础研究青年项目(2012FD083)
吕春荣(1982-),女,助理研究员,硕士。
洪琼花(1968-),女,白族,研究员,硕士,主要从事绵羊、山羊的育种和高效繁殖新技术研究。

