微波辅助提取北五味子多糖工艺研究
程振玉,杨英杰 ,刘治刚
(1.东北师范大学化学学院,吉林长春130024;2.吉林化工学院化学与制药工程学院,吉林吉林132022)
北 五 味 子 [Schisandra chinensis(Turcz.)Baill]作为一种滋补性、镇静、镇咳、抗衰老的传统中药,广泛应用于我国和日本[1].其主要活性成分五味子多糖,具有保肝、抗疲劳、抗氧化、抗肿瘤、免疫促进等重要作用[2-4].而最常用的传统的天然药物提取方法耗时、耗溶剂,且提取率很低,严重阻碍了五味子药用资
源的充分利用,因此高效率提取五味子多糖的新方法有待于急需开发,最近超声波辅助法[5-7]、酶法[8]、
超临界流体萃取等已被报道.据我们所知,微波辅助提取技术在北五味子多糖提取领域报道较少.
目前微波辅助提取技术已经被广泛应用于天然药物研究领域[9-10],该提取技术具有穿透力强、选择性好、耗能少、加热效率高、成本低、操作简单等优点.本研究我们的目标是充分探索微波与回流有机结合提取北五味子多糖的工艺条件,使多糖的提取率得到显著提高,准确分析北五味子中多糖的含量,为北五味子入药评价和质量控制提供更全面的分析工具和数据支持.
1 材料与方法
1.1 材料与仪器
五味子药材(Schisandra chinensis(Turcz.)Baill.)购买于吉林省通化市,产地为长白山地区,清洗、晾干备用.
葡萄糖(天津大茂化学试剂厂生产,生产批号:20120728),无水乙醇,苯酚,浓硫酸均为分析纯.
微波合成/萃取仪XH-100A(北京祥鹄科技发展有限公司),722可见分光光度计(上海欣茂仪器有限公司),旋转蒸发仪RE-52A(上海亚荣生化仪器厂),离心机 Allegra 64R(BACKMAN),循环水式真空泵SHZ-D(河南省巩义市英峪仪器一厂).
1.2 实验方法
1.2.1 多糖的提取
五味子粉碎,过不同孔径的筛子,于60℃烘干后精确称量10.0 g,放入圆底烧瓶,加入一定量的蒸馏水,以一定功率的微波在恒温下辐射一段时间,完成萃取.然后用传统回流水提的方法,将该烧瓶置于100℃下加热回流提取2 h.提取液经4 000 r/min离心15 min、去沉淀,用旋转蒸发仪浓缩到原体积的五分之一,加入无水乙醇至80%(v/v),沉淀,静置过夜,沉淀物经真空干燥得到五味子粗多糖.
1.2.2 多糖含量的测定
准确称量105℃干燥至恒重的葡萄糖标准样品100.00 mg,加蒸馏水溶解、摇匀,定容到100 mL,制成1.00 mg/mL贮备液,取出25 mL上述贮备液置于250 mL容量瓶中,制成0.1 mg/mL的葡萄糖标准溶液[11-12].
分别精密量取上述葡萄糖标准溶液5、10、15、20、25、30、35 mL,置于 7 个 50 mL 容量瓶中,加蒸馏水摇匀定容.分别取上述标准溶液1 mL,置于7个25 mL的带塞比色管,加入新制5%的苯酚溶液1.0 mL,再迅速加入5 mL浓硫酸,充分摇匀,另取1 mL蒸馏水做空白对照.于恒温25℃放置30 min,在490 nm下用722可见分光光度记测定吸光度,以吸光度(A)为纵坐标,葡萄糖浓度mg/mL为横坐标,绘制标准曲线.
1.2.3 换算因子的测定
精确称量精制干燥的五味子多糖50 mg,蒸馏水溶解后定容到100 mL,制成0.50 mg/mL溶液,取出4 mL上述溶液置于25 mL容量瓶中,制成80 μg/mL的多糖贮备液.精确量取1 mL,按照测定标准曲线的方法测定吸光度值[4,13-15].
按下式计算换算因子:f=W/CD式子中W:多糖质量(mg);D:多糖的稀释因子;C:多糖溶液中葡萄糖的浓度(mg/mL)
1.2.4 正交实验优化设计
在单因素基础之上,选用L16(44)正交表[16],对实验条件进行优化,确定五味子中可溶性多糖提取的最佳工艺参数,拟定因素与水平,见表1.
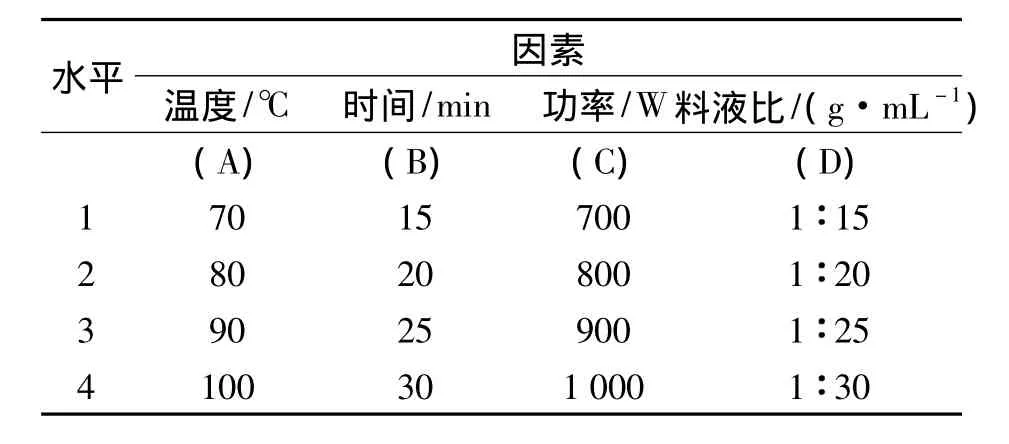
表1 正交试验因素水平表
1.2.5 验证试验
准确称取60℃干燥至恒重的40目五味子,在微波的最佳工艺条件提取,重复试验3次,取平均值,验证试验结果.
2 结果与分析
2.1 葡萄糖标准曲线与换算因子
实验制备葡萄糖标准曲线,回归曲线和直线方程,见图1.
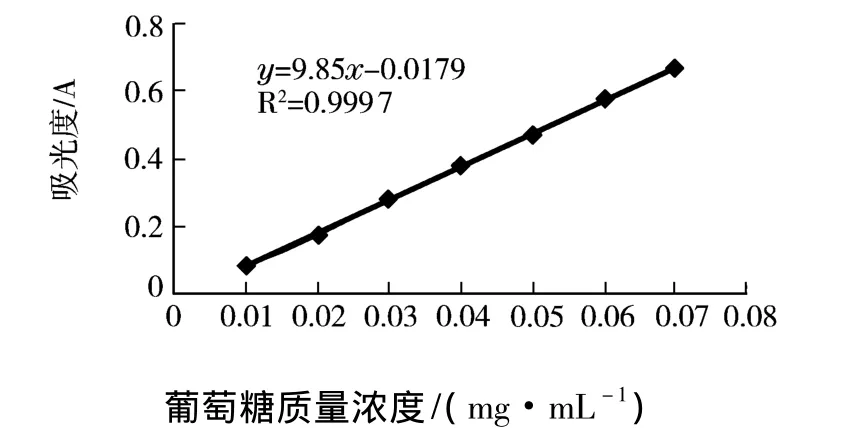
图1 葡萄糖标准曲线
2.2 微波辅助萃取多糖单因素实验结果
2.2.1 微波辅助萃取时间的选择
准确称取60℃干燥至恒重粒径为80目的北五味子10.0 g,加入300 mL蒸馏水,于100℃以700 W 的功率微波分别萃取 5、10、15、20、25、30、35、40 min,用传统加热水提的方法,在100℃下回流提取2 h.实验结果如图2所示.
回归分析表明,在0.01~0.07 mg/mL范围内相关系数良好,葡萄糖含量与吸光度值呈良好的线性关系,实验测得换算因子f=1.76.
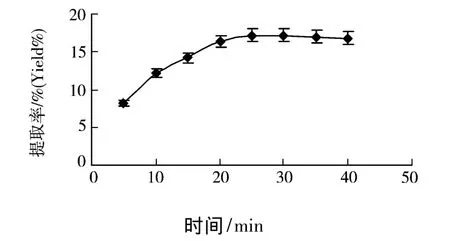
图2 处理时间对提取率的影响
2.2.2 料液比的选择
准确称取60℃干燥至恒重粒径为80目的北五味子 10.0 g,分别加入 50、100、200、300、400、500 mL蒸馏水,在100℃下以700 W的微波功率萃取25 min,用传统加热水提的方法,在100℃下回流提取2 h.实验结果如图3所示.
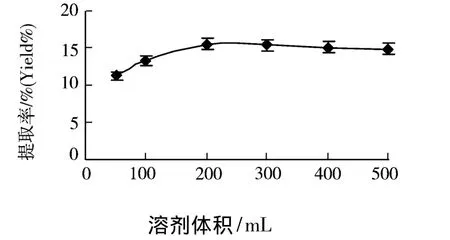
图3 料液比对提取率的影响
2.2.3 温度的选择
准确称取60℃干燥至恒重粒径为80目的北五味子10.0 g,加入200 mL蒸馏水,分别在40、50、60、70、80、90、100 ℃ 下以 700 W 的功率微波辅助萃取25 min,然后用传统加热水提的方法,在100℃下回流提取2 h.实验结果如图4所示.
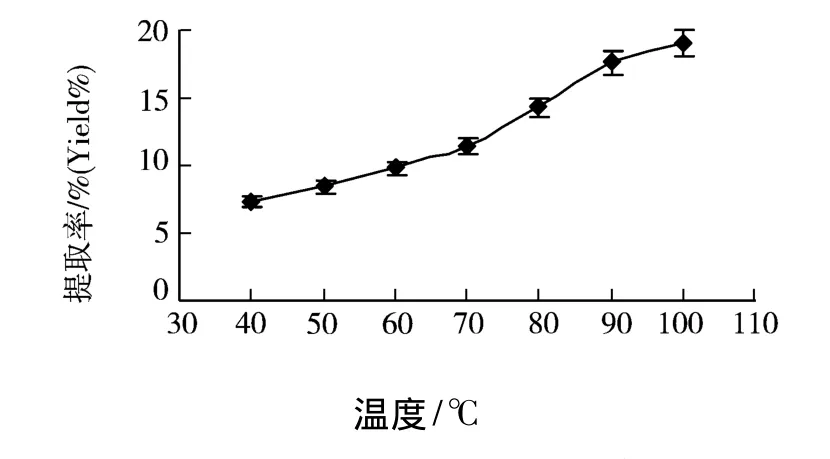
图4 温度对提取率的影响
2.2.4 微波功率的选择
准确称取60℃干燥至恒重粒径为80目的北五味子10.0 g,加入200 mL蒸馏水,于100℃分别以 400、500、600、700、800、900、1000 W 的功率微波辅助萃取25 min,然后用传统加热水提的方法,在100℃下回流提取2 h.实验结果如图5所示.

图5 温度对提取率的影响
2.2.5 药材粒径的选择
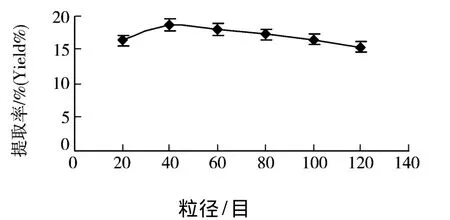
图6 药材粒径对提取率的影响
准确称取60℃干燥至恒重粒径分别为20、40、60、80、100、120 目的北五味子 10.0 g ,加入200 mL蒸馏水,于100℃以800 W的功率微波辅助萃取25 min,然后用传统加热水提的方法,在100℃下回流提取2 h.实验结果如图6所示.时提取率逐渐升高,25 min后,提取率增幅趋缓且逐渐降低,这可能是因为微波处理时电磁波把能量直接传入分子内部,使之瞬时加热,因此在短时间内对细胞膜的破碎作用较大,溶出物较多,所以提取率上升较快.但当达到饱和时,有效成分不再被溶解,而且还有可能引起多糖的降解,因此提取率也就不再提高,故选择15~30 min进行工艺优化.
由图3可以看出,随着料液比逐渐增大多糖含量增加,但当料液比超过130时,五味子多糖提取量逐渐下降后趋于平缓.原因是溶剂体积较小时多糖尚未溶出便达到溶解平衡,致使产率较低,随着溶剂的增加,多糖的溶出量增加.但溶剂过多,杂质的析出也会增多,抑制目标成分多糖的析出,因此选择料液比1 15~1 30进行工艺优化.
由图4可知,随着温度的升高,五味子多糖的提取率急剧增加.100℃的含量几乎是70℃的2倍.这是因为较高的温度一方面有利于植物细胞壁软化,利于破坏组织结构,使有效物质溶出,另一方面可增加提取分子的动能,加快分子的运动,加快扩散,强化传质效果.故选择70~100℃进行工艺优化.
由图5可以看出,多糖在800 W之前随着功率的增加而提高,大于800 W以后则降低,这可能是由于辐射功率越高,物系吸收微波能越多,分子运动加快,固液传质速度亦加快,从而有利于多糖的溶出.然而继续增加功率则使提取率降低,可能是因为微波功率增加到一定程度时,有可能促使多糖链断裂,从而提取率下降,因此选择700~1 000 W进行工艺优化.
由图6可以看出颗粒过小或过大,提取率均呈下降趋势.因为提取包括渗透、溶解、扩散三个过程,物料过细,表面积太大,吸附作用增强,同时,大量细胞破裂致使细胞内大量高分子物质溶入外液,使外部药液粘度增大,影响扩散速率.从整体来看,粒径对多糖提取率影响很不明显,40目效果较好,因此本研究选择40目为最佳粒径.
2.3 正交试验结果
2.3.1 正交实验直观分析结果
微波正交试验结果,见表2.
由图2可以看出,随着提取时间的延长,开始
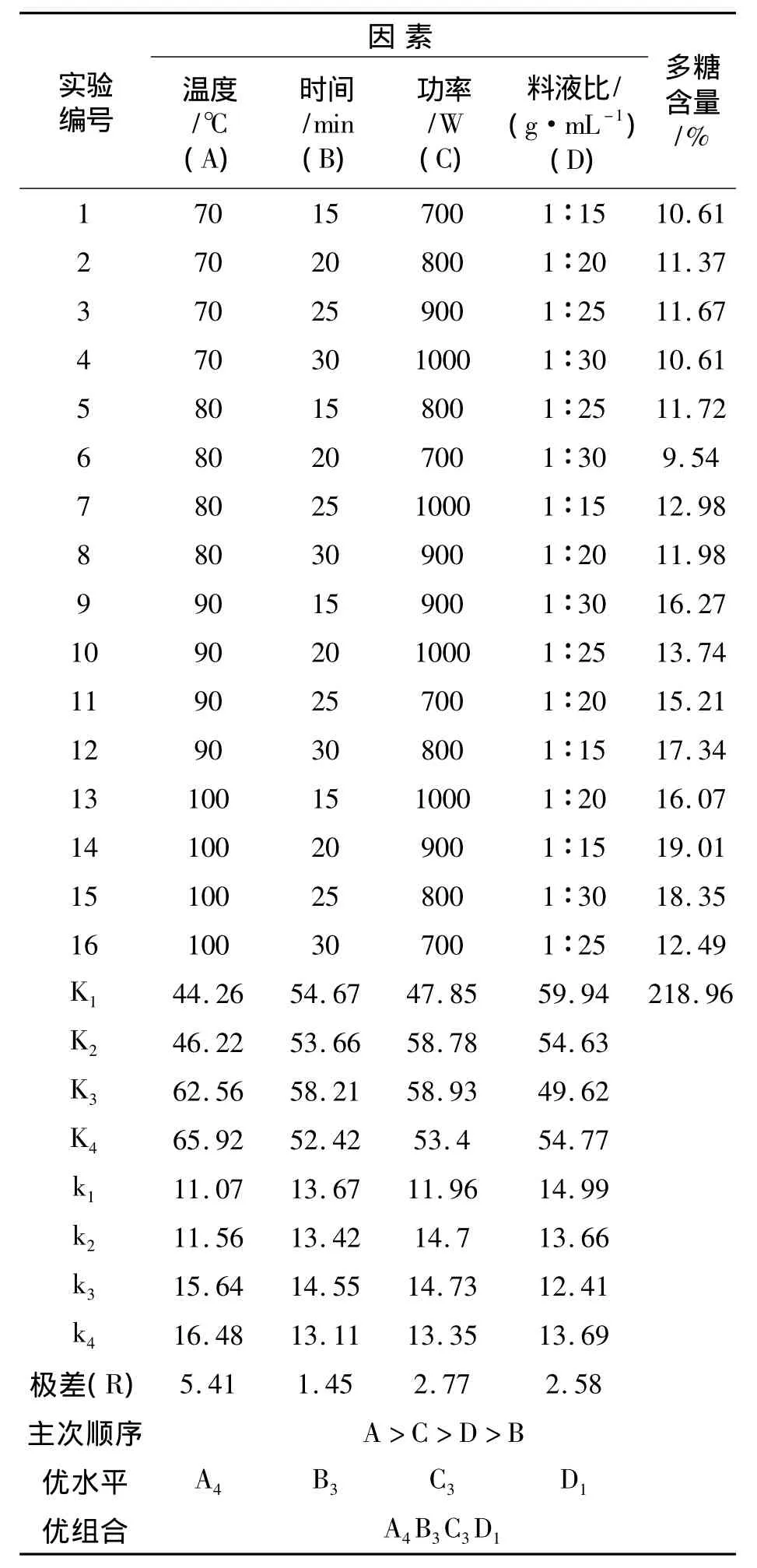
表2 微波正交试验结果
2.3.2 正交试验方差分析
根据正交试验直观分析结果表2,以因素B作为基准对试验结果进行方差分析,结果见表3.
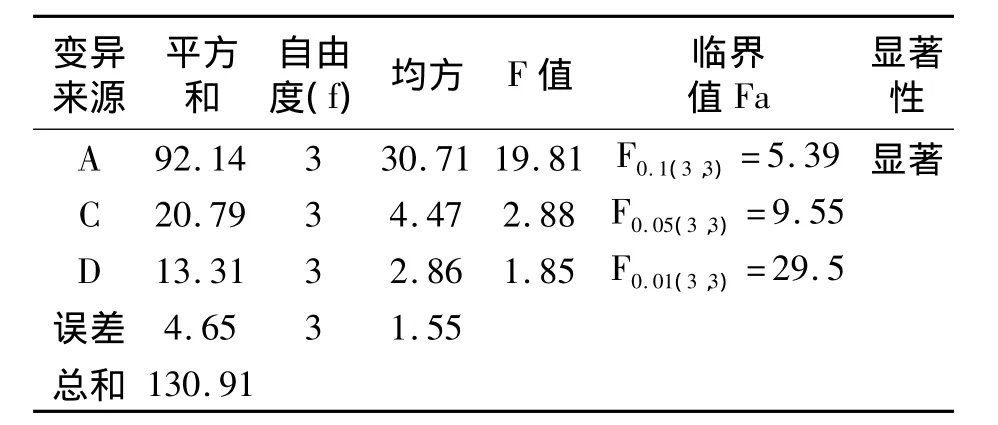
表3 方差分析
由表3可知,在影响北五味子多糖提取率的3个因素中,温度(A)对五味子多糖得率有显著性影响,微波功率(B)和料液比(C)影响较小,3个因素因数的影响顺序依次为:温度(A)>微波功率(C)>料液比(D).由此可以得出:微波辅助萃取北五味子多糖的最佳工艺条件是A4B3C3D1,即料液比为1 15,功率为900 W,提取时间为25 min,提取温度为100℃.
2.4 最佳条件的验证试验
准确称取60℃干燥至恒重的40目五味子,在优化的工艺条件下,重复试验3次取平均值,验证试验结果.五味子多糖提取率为20.08%.
2.5 微波提取与回流提取的比较
回流法:按照文献[17]方法,称取40目的北五味子粉末10.0 g,加入250 mL蒸馏水,100℃提取4 h,测得多糖得率14.27%.微波法:称取40目的北五味子粉末10.0 g,加入150 mL蒸馏水,以900 W的辐射功率于100℃提取25 min,测得多糖得率为11.43%.微波-回流结合法:称取40目北五味子粉末10.0 g,加入150 mL蒸馏水,先以900 W的辐射功率于100℃提取25 min,然后在100℃中水浴回流提取2 h,提取率达到20.08%,比回流提取率增加了约40%,比微波增加了约75%.
3 结 论
通过系统的研究传统回流法与现代微波法提取两种工艺,发现单靠其中某一种方法都不能有效的提取多糖,而两者按照一定的工艺条件有机结合则能使多糖提取率大幅度增加,实现高提取率,达到方法的优化.
长时间和高功率的微波辐射都可能会使多糖糖链断裂,但是这并没有影响微波工艺的优越性,微波的辅助萃取仍为一个好方法.微波与回流有机结合在一起,短时间内微波使植物细胞膜结构破裂,在后续的水提过程中,加速了溶剂分子对基体的渗透和待提取成分的溶剂化,从而大大加快提取速度,提高了多糖的提取率.
微波辅助提取五味子多糖最佳工艺条件为料液比1 15、温度100℃、萃取25 min、微波功率900 W、药材粒径为40目.在此条件下,提取率达到20.08%.表明微波微波辅助萃取五味子多糖耗费时间少,溶剂用量小,且能显著提高多糖的提取率,因此微波辅助法是提取北五味子多糖的一种优先选择方法.
[1] Huang T H,Shen P N,Shen Y J.J.Chromatography A[J].2005,1066:239-242.
[2] 可成友,马春雁,边蔷,等.五味子多糖研究概况分析[J].时珍国医国药,2009,20(7):1729-1731.
[3] Amira M,Gamal-Eldeen,Eman F A h med,et al.In vitro canner chemo-preventive properties of polysaccharide extract from the brown alga,Sargassum latifolium[J].Food and Chemical Toxicology,2009,47(6):1378-1384.
[4] 闫舒,仰榴青,赵婷等.五味子多糖最新研究进展[J].江苏大学学报:医学版,2009,19(4):366-368.
[5] 孟宪军,李冬男,汪艳群等.五味子多糖超声波提取条件的研究[J].食品工业科技,2010,31(4):313-319.
[6] 高晓旭,孟宪军,李继海等.北五味子多糖超声波提取条件的优化[J].食品研究与开发,2008,29(9):27-30.
[7] 高晓旭,李继海,姜贵全等.北五味子多糖超声波提取及对油脂的抗氧化性能[J].东北林业大学学报,2009,37(4):34-36.
[8] 可成友,梁宏斌,吴晓芳等.北五味子多糖的酶法提取工艺研究[J].现代中药研究与实践,2010,24(2):47-50.
[9] 赵晨晨,承 伟,王立冬.微波辅助提取络石藤总黄酮的工艺研究[J].中草药,2012,43(3):718-720.
[10]皱建国,刘飞,刘燕燕等.响应面法优化微波辅助提取枳壳中总黄酮工艺[J].食品科学,2012,33(2):24-28
[11] Dubois M,Gilles K A,Hamilton,J K,et al.colorimetric method for determination ofsugars and related substances[J].Analytical Chemistry.1956,28:350-356.
[12]赵文竹,殷涌光,于志鹏等.玉米须多糖微波提取工艺及其红外光谱结构分析[J].吉林大学:工学版,2012,42(2):515-519.
[13]薛梅,周静.五味子多糖的提取及含量测定[J].陕西中医,2003,24(3):267-268.
[14]谭晓虹,王治宝,李如章.北五味子多糖的提取和含量测 定[J].时 珍 国 医 国 药,2007,18(6):1463-1464.
[15]孟宪军,李冬男,汪艳群等.响应曲面法优化五味子多糖的提取工艺[J].食品科学,2010,31(4):11-115.
[16]李超,王磊,仁遥等.黑木耳多糖的微波提取及含量测定[J].食品工业,2012,33(8):128-131.
[17]李巧云,居红芳,翟春.五味子多糖提取工艺的研究[J].食品科学,2004,25(5):105-109.

