肝切除术治疗合并肝门静脉高压的肝细胞癌患者的疗效与安全性
张培军 钟鉴宏 马良 陈洁 游雪梅 赵伟华
1. 广西医科大学附属肿瘤医院肝胆外科,广西 南宁,530021;2. 保定市第一中心医院普外一科,河北 保定,071051;3. 望都县医院普外科,河北 保定,071051
肝切除术治疗合并肝门静脉高压的肝细胞癌患者的疗效与安全性
张培军1,2 钟鉴宏1 马良1 陈洁1 游雪梅1 赵伟华3
1. 广西医科大学附属肿瘤医院肝胆外科,广西 南宁,530021;2. 保定市第一中心医院普外一科,河北 保定,071051;3. 望都县医院普外科,河北 保定,071051
背景与目的:肝细胞癌(hepatocellular carcinoma,HCC)患者肝硬化伴有肝门静脉高压的比例很高,肝门静脉高压明显增加肝切除术治疗中出血和术后肝功能衰竭的风险。本文旨在评价肝切除术治疗合并肝门静脉高压HCC患者的疗效、安全性,以及肝门静脉高压患者的肝切除术的适应证。方法:回顾性分析2006年1月—2010年12月接受肝切除术治疗的564例肝功能为Child-Pugh A级的HCC患者临床资料,其中486例患者无肝门静脉高压,剩余78例患者合并肝门静脉高压。经倾向性分析校正组间资料平衡后,按1:1比例对患者进行配对。比较两组接受肝切除术患者术后并发症、术后30和90 d死亡率、总生存率和复发率。根据巴塞罗那临床肝癌分期标准(Barcelona Clinic Liver Cancer Staging Classification,BCLC)和手术范围大小行亚组分析。结果:肝门静脉高压组患者的术后并发症、术后30和90 d死亡率均显著高于非肝门静脉高压组(P<0.05)。经随访(平均32.1个月),肝门静脉高压组和非肝门静脉高压组患者术后1、3、5年总生存率分别为75%、45%、32%和90%、66%、48%,差异有统计学意义(P<0.001);复发率分别为31%、57%、73%和26%、53%、67%,差异无统计学意义(P=0.53)。倾向性分析匹配后,两组患者总生存率和复发率相比,差异均无统计学意义(P>0.05)。亚组分析结果显示,在BCLC-A期和接受小范围肝切除术的两组患者中,总生存率的比较差异无统计学意义(P>0.05)。结论:肝门静脉高压并非HCC患者行肝切除术治疗的绝对禁忌证。在合并肝门静脉高压的HCC患者中,BCLC-A期和预计行小范围肝切除术的患者可选择相应肝切除术。
肝细胞癌;肝门静脉高压;肝切除术;总生存率
肝炎、肝硬化是肝细胞癌(hepatocellular carcinoma,HCC)的主要致病因素[1]。我国HCC患者中80%以上伴有肝硬化。其中,又有相当大比例的患者合并肝门静脉高压[2],直接影响了肝切除术在临床上的应用。在HCC的各种临床分期系统中,最受推崇的是巴塞罗那临床肝癌分期标准(Barcelona Clinic Liver Cancer Staging Classification,BCLC)[3-4]。BCLC指出,合并肝门静脉高压的HCC患者术后肝功能衰竭的风险极高,认为肝门静脉高压是肝切除术的禁忌证[3]。然而,这一结论只是基于29例合并肝门静脉高压的HCC手术治疗患者的资料制定的[5],目前已有部分国外的小样本回顾性研究并不认同上述结论[6-8]。本文以广西医科大学附属肿瘤医院收治的患者为基线资料,试图分析和研究部分合并肝门静脉高压的HCC患者是否适合接受肝切除术治疗,同时探讨肝切除术治疗的适应证。
1 材料和方法
1.1 一般资料
回顾性分析2006年1月—2010年12月在广西医科大学附属肿瘤医院行根治性肝切除术(肉眼无瘤,术后1个月经CT或MRI复查未见肝切缘肿瘤残留,术前甲胎蛋白高者在术后1月降至正常)的HCC患者资料。两组患者匹配前后的基线资料见表1。
1.2 方法
观察组(伴有肝门静脉高压)和对照组(未合并肝门静脉高压)分别有78例和486例HCC患者满足以上条件。由于本研究属于回顾性分析,为消除组间基线资料的不均衡导致结果偏倚,我们使用了倾向性分析方法按1:1匹配组间数据,匹配出75对共150例患者。匹配的方法如前所述[2,9]。本研究获我院伦理委员会通过。两组患者均接受HCC根治性切除术,根治性HCC切除术的选择和方法如前所述[2,9-10]并参照卫生部《原发性肝癌诊疗规范(2011版)》[11]。
纳入标准:①开腹HCC根治性切除术;②术后病理提示为HCC;③术前肝功能Child-Pugh评分A级;④术前未行新辅助治疗;⑤无严重心肺疾病;⑥术前5年内及HCC诊断时未合并其他恶性肿瘤。
排除标准:①术后至复发前使用过TACE或其他抗肿瘤治疗;②合并HIV、HCV或HDV感染;③酗酒、吸毒;④怀孕或哺乳的妇女。
肝门静脉高压的定义:观察组患者术前合并肝门静脉高压的任一间接证据,胃镜和(或)CT提示食管和(或)胃底静脉曲张;脾脏>5个肋单元,同时血小板<100 000/μL。对照组患者术前无肝门静脉高压的间接证据[12-13]。
1.3 随访和观察指标
术后半年内每个月复查1次,半年至两年内每3个月复查1次,两年后每6个月复查1次。复查内容包括肝功能、甲胎蛋白、B超和(或)CT。复发的诊断通过两种影像学检查方式或一种影像学检查联合升高的甲胎蛋白确定。复发后治疗措施的选择结合肿瘤复发的部位、数量、肝功能,同时取得患者的知情同意。具体措施包括再次手术、射频消融、经肝动脉化疗栓塞、对症支持治疗等。对出现死亡事件的患者,对死亡原因进行分析,包括肿瘤复发进展及肝功能衰竭。
本研究观察指标包括:并发症、围手术期死亡率、总生存率和复发率。同时,为进一步明确肝切除术治疗合并肝门静脉高压HCC患者的适应证,本研究针对肿瘤BCLC分期和手术切除范围进行了亚组分析。
1.4 统计学处理
数据使用SPSS 19.0统计软件进行处理。正态或近似正态分布的资料用描述,非正态分布的资料用中位数、极大值和极小值描述。组间连续性变量的比较用t检验,连续性变量中位数(M)的比较用Mann-Whitney U检验,分类变量率或构成比的比较用χ2检验。累积生存率用Kaplan-Meier法估计,两组间差异用log-rank检验比较。P<0.05为差异有统计学意义。
2 结 果
2.1 术后并发症和围手术期死亡率
术后并发症的判断参考Clavien-Dindo分级[14],大多数术后并发症为Ⅰ或Ⅱ级。肝门静脉高压组患者的术后并发症发生率(21.3% vs 13.6%,P=0.03)、术后30(2.5% vs 1.0%,P=0.049)和90 d死亡率(10.3% vs 2.3%,P<0.001)均显著高于对照组患者。肝门静脉高压组患者最常见的并发症为肝功能异常。倾向性分析匹配后,肝门静脉高压组患者的并发症发生率和术后90 d死亡率亦显著高于对照组(P<0.05),但术后30 d死亡率相似(表1)。
2.2 总患者数的总生存率和复发率
经平均32.1(1~120.4)个月随访,肝门静脉高压组患者的中位生存期为48.2个月,对照组患者则为69.3个月。肝门静脉高压组患者的1、3、5年总生存率为75%、45%和32%,显著低于对照组患者的1、3和5年总生存率(90%、66%和48%),差异有统计学意义(P<0.001,图1)。在复发率方面,肝门静脉高压组患者的1、3和5年复发率与对照组患者相似,分别为31%、57%、73%和26%、53%、67%,差异无统计学意义(P=0.53)。
2.3 匹配后的总生存率和复发率
倾向性分析匹配出75对患者,组间基线资料可比(表1)。肝门静脉高压组患者的1、3、5年总生存率分别为77%、52%和37%,对照组则为85%、56%和42%,差异无统计学意义(P=0.054)。同时,两组的1、3、5年复发率分别为30%、55%、71%和27%、52%、65%,差异亦无统计学意义(P=0.43)。
2.4 亚组分析
为进一步探讨合并肝门静脉高压的HCC患者中最适合肝切除术治疗的人群,我们根据BCLC肿瘤分期和肝切除术切除范围进行了亚组分析。
在BCLC-A期的147例患者中,观察组和对照组的1、3、5年总生存率分别为94%、77%、51%和98%、85%、60%,差异无统计学意义(P=0.133)。然而,在BCLC-B期的265例患者中,观察组和对照组的1、3、5年总生存率分
别为93%、72%、41%和97%、80%、55%,差异有统计学意义(P=0.041)。而在BCLC-C期的152例患者中,观察组和对照组的1、3、5年总生存率分别为80%、58%、24%和94%、71%、47%,差异亦有统计学意义(P<0.001)。
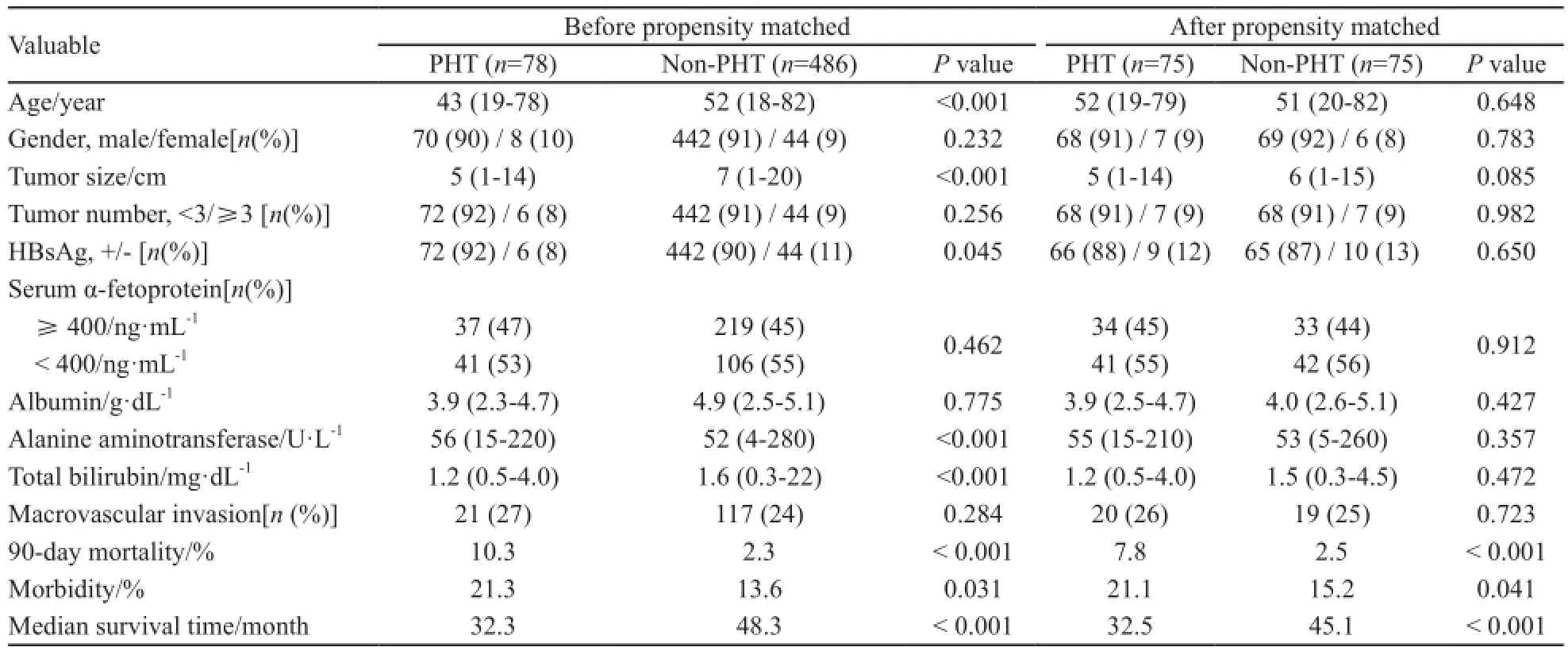
表1 匹配前、后门脉高压组和非门脉高压组患者的基线资料Tab. 1 Baseline data of patients with hepatocellular carcinoma and with or without portal hypertension
由于肝门静脉高压可增加患者肝切除术出血和肝功能衰竭的风险,我们根据肝脏切除肝段的范围大小进行亚组分析。共有395例患者的切除范围≥3段,观察组和对照组的1、3、5年总生存率分别为76%、38%、17%和92%、75%、41%,差异有统计学意义(P<0.001)。而肝脏切除范围<3段的169例患者中,观察组和对照组的1、3、5年总生存率分别为91%、76%、51%和97%、81%、60%,差异无统计学意义(P=0.181)。
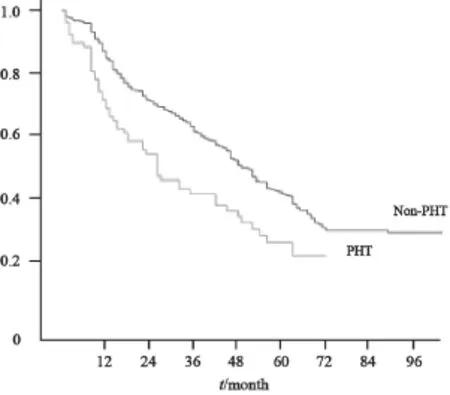
图1 合并门脉高压的肝细胞癌患者78例和未合并门脉高压486例的累积总生存率比较Fig. 1 The overall survival curve of 78 PHT and 486 non-PHT patients.
3 讨 论
近年随着手术技巧和围手术期护理技术的提高,肝切除术治疗合并肝硬化的HCC患者的效果已显著提高,很多国外大型HCC治疗中心报道了肝切除术的良好效果,围手术期死亡率、并发症和肝功能衰竭发生率明显下降[15-16]。这与手术患者的选择有关。但如何选择最佳手术患者仍无明确定论。目前,欧洲肝脏研究协会和美国肝病研究协会指南认为肝门静脉高压是肝切除术的禁忌证,同时推荐这部分患者行其他治疗[3-4]。这个指导意见主要基于Bruix等[5]对29例Child-Pugh A级肝功能HCC患者的研究。研究结果显示,肝门静脉梯度压≥10 mmHg是肝切除术后肝功能衰竭的独立危险因素。然而,这一结果并未被其他研究确认[6-8]。
本研究结果显示,肝门静脉高压组患者倾向性分析匹配前后的并发症发生率和术后90 d死亡率均显著高于对照组患者(P<0.05)。匹配前,肝门静脉高压组患者的总生存率和生存时间显著低于非肝门静脉高压组(P<0.001)。然而,匹配后的总生存率和匹配前后的复发率,两组相比差异无统计学意义(P>0.05)。因此,即使肝功能储备良好,对于存在食管胃底静脉曲张、脾亢和血小板降低的患者,实施肝切除术仍需严格选择患者。亚组分析显示,BCLC-A期和肝切范围<3段的HCC患者在总生存率方面,两组比较差异无统计学意义(P>0.05);但BCLC-B、BCLC-C期和肝切范围≥3段患者差异有统计学意义(P<0.05)。所以,针对术前肝功能存在异常和(或)预计肝脏切除范围较大的患者,肝切除术后肝衰竭的风险显著增加,此时应考虑射频消融或肝移植等治疗方法。
BCLC小组在1999年的研究报道显示,术前肝门静脉高压和高胆红素血症是影响HCC患者术后长期总生存率最重要的两个独立风险因素[17]。然而,近年来的一些研究则不支持这一结论[18-23]。同时正如Jaeck等[24]的系统综述所言,很少研究认为肝门静脉高压是肝切除术的预测因子。目前专门研究合并肝门静脉高压的HCC患者肝切除术安全性和疗效的报道中的患者主要来自意大利、日本和韩国[6-8,18-23]。这些研究结果显示,术后90 d的死亡率为6%~10%,1、3、5年总生存率为75%、60%和40%。而这些研究中的非肝门静脉高压手术组患者的术后90 d死亡率为3%,1、3、5年总生存率为90%、80%和60%。
本研究纳入的患者中乙型肝炎感染率超
过90%,国内HCC高危人群筛查并未完全普及[9]。在HCC患者中,合并肝门静脉高压且肝功能评级为Child-Pugh A级的HCC患者比例占13.8%。我们近期的研究结果显示[2],在治疗合并肝门静脉高压且肝功能达Child-Pugh A级的BCLC-B/C期的HCC患者方面,手术疗效显著优于经肝动脉化疗栓塞治疗,5年总生存率分别为16%和7%。因此,肝门静脉高压本身并不是HCC患者手术的绝对禁忌证。
合并肝门静脉高压的HCC患者肝切除术的主要风险包括食管胃底静脉曲张破裂大出血(2例)、脾亢引起的凝血功能障碍(1例)和术后的肝功能衰竭(4例)。肝门静脉高压组患者的(10.3%)的术后90 d死亡率显著高于对照组(2.3%)。而两组患者的复发率和倾向性分析匹配后的总生存率比较差异无统计学意义(P>0.05)。说明若能降低术后90 d死亡率,即有效控制食管胃底静脉曲张破裂大出血、脾亢导致的凝血功能障碍和肝功能衰竭的风险,合并肝门静脉高压的HCC患者接受肝切除手术治疗与非肝门静脉高压患者的安全性和生存获益是相似的。这就要求严格选择手术患者。而本文的亚组分析则进一步论证了患者选择的重要性。本研究中,肝门静脉高压组患者共有8例在术后90 d内死亡。在这8例患者中,有4例(50%)肝切除范围≥3个肝段,3例(38%)食管胃底静脉曲张达重度。因此,对于存在肝门静脉高压的HCC患者,肝切除手术范围不宜过大;对于食管胃底静脉曲张较严重的患者,施行肝部分切除术须慎重。另外,有研究报道,血小板低于150 000/μL亦是HCC患者肝切除术术后死亡的独立风险因素[25]。
本研究存在一定的局限性。首先,本研究属于回顾性分析,可能存在样本信息的偏倚,虽然使用了倾向性分析最大限度的匹配组间资料,亦可能存在未被纳入倾向性分析的基线信息不均衡,影响两组数据比较的可信度。其次,本研究为单中心研究且样本量较小,可能存在选择性偏倚。再次,两组患者在手术后接受的辅助治疗方式可能不同,可能会影响手术效果的判断[26]。
即便如此,本研究数据表明,肝功能Child-Pugh A级的HCC患者合并肝门静脉高压的间接征象(胃底食管静脉曲张、脾亢和血小板低)并非肝切除术的绝对禁忌证。而对于BCLC-A期和肝切除术范围<3段的HCC患者,合并肝门静脉高压与否并不影响其肝切除术的疗效及安全性。
[1]ZHONG J H, MA L, WU L C, et al. Adoptive immunotherapy for postoperative hepatocellular carcinoma: a systematic review [J]. Int J Clin Pract, 2012, 66(1): 21-27.
[2]ZHONG J H, KE Y, GONG W F, et al. Hepatic resection associated with good survival for selected patients with intermediate and advanced-stage hepatocellular carcinoma[J]. Ann Surg, 2014[E-Pub ahead of print].
[3]BRUIX J, SHERMAN M. Management of hepatocellular carcinoma: an update [J]. Hepatology, 2011, 53(3): 1020-1022.
[4]European Association for the Study of the Liver, European Organisation for Research and Treatment of Cancer. EASLEORTC clinical practice guidelines: management of hepatocellular carcinoma [J]. J Hepatol, 2012, 56(4): 908-943.
[5]BRUIX J, CASTELLS A, BOSCH J, et al. Surgical resection of hepatocellular carcinoma in cirrhotic patients: prognostic value of preoperative portal pressure [J]. Gastroenterology, 1996, 111(4): 1018-1022.
[6]CAPUSSOTTI L, FERRERO A, VIGANO L, et al. Portal hypertension: contraindication to liver surgery? [J]. World J Surg, 2006, 30(6): 992-999.
[7]CHOI G H, PARK J Y, HWANG H K, et al. Predictive factors for long-term survival in patients with clinically significant portal hypertension following resection of hepatocellular carcinoma [J]. Liver Int, 2011, 31(4): 485-493.
[8]CUCCHETTI A, ERCOLANI G, VIVARELLI M, et al. Is portal hypertension a contraindication to hepatic resection?[J]. Ann Surg, 2009, 250(6): 922-928.
[9]ZHONG J H, XIANG B D, GONG W F, et al. Comparison of long-term survival of patients with BCLC stage B hepatocellular carcinoma after liver resection or transarterial chemoembolization[J]. PLoS One, 2013, 8(7): e68193.
[10]柯阳, 钟鉴宏, 游雪梅, 等. 抗病毒治疗对乙型肝炎病毒相关性肝细胞癌患者根治性术后的影响[J]. 中国肿瘤临床, 2013, 40(19): 1184-1188.
[11]中华人民共和国卫生部. 原发性肝癌诊疗规范(2011版)[J]. 临床肝胆病杂志, 2011, 27(11): 1141-1159.
[12]MAITHEL S K, KNEUERTZ P J, KOOBY D A, et al. Importance of low preoperative platelet count in selecting
patients for resection of hepatocellular carcinoma: a multiinstitutional analysis [J]. J Am Coll Surg, 2011, 212: 638-648.
[13]DE FRANCHIS R. Evolving consensus in portal hypertension. Report of the Baveno Ⅳ consensus workshop on methodology of diagnosis and therapy in portal hypertension [J]. J Hepatol, 2005, 43: 167-176.
[14]DINDO D, DEMARTINES N, CLAVIEN P A. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey [J]. Ann Surg, 2004, 240(2): 205-213.
[15]POON R T, FAN S T, LO C M, et al. Improving perioperative outcome expands the role of hepatectomy in management of benign and malignant hepatobiliary diseases: analysis of 1222 consecutive patients from a prospective database [J]. Ann Surg, 2004, 240(4): 698-708.
[16]JARNAGIN W R, GONEN M, FONG Y, et al. Improvement in perioperative outcome after hepatic resection: analysis of 1,803 consecutive cases over the past decade [J]. Ann Surg, 2002, 236(4): 397-406.
[17]LLOVET J M, FUSTER J, BRUIX J. Intention-to-treat analysis of surgical treatment for early hepatocellular carcinoma: resection versus transplantation [J]. Hepatology, 1999, 30(6): 1434-1440.
[18]GIANNINI E G, SAVARINO V, FARINATI F, et al. Influence of clinically significant portal hypertension on survival after hepatic resection for hepatocellular carcinoma in cirrhotic patients [J]. Liver Int, 2013, 33(10): 1594-1600.
[19]HIDAKA M, TAKATSUKI M, SOYAMA A, et al. Intraoperative portal venous pressure and long-term outcome after curative resection for hepatocellular carcinoma [J]. Br J Surg, 2012, 99(9): 1284-1289.
[20]ISHIZAWA T, HASEGAWA K, AOKI T, et al. Neither multiple tumors nor portal hypertension are surgical contraindications for hepatocellular carcinoma [J]. Gastroenterology, 2008, 134(7): 1908-1916.
[21]KAWANO Y, SASAKI A, KAI S, et al. Short- and long-term outcomes after hepatic resection for hepatocellular carcinoma with concomitant esophageal varices in patients with cirrhosis[J]. Ann Surg Oncol, 2008, 15(6): 1670-1676.
[22]RUZZENENTE A, VALDEGAMBERI A, CAMPAGNARO T, et al. Hepatocellular carcinoma in cirrhotic patients with portal hypertension: is liver resection always contraindicated? [J]. World J Gastroenterol, 2011, 17(46): 5083-5088.
[23]SANTAMBROGIO R, KLUGER M D, COSTA M, et al. Hepatic resection for hepatocellular carcinoma in patients with Child-Pugh's A cirrhosis: is clinical evidence of portal hypertension a contraindication? [J]. HPB (Oxford), 2013, 15(1): 78-84.
[24]JAECK D, BACHELLIER P, OUSSOULTZOGLOU E, et al. Surgical resection of hepatocellular carcinoma. Post-operative outcome and long-term results in Europe: an overview [J]. Liver Transpl, 2004, 10(Suppl 1): 58-63.
[25]MAITHEL S K, KNEUERTZ P J, KOOBY D A, et al. Importance of low preoperative platelet count in selecting patients for resection of hepatocellular carcinoma: a multiinstitutional analysis [J]. J Am Coll Surg, 2011, 212(4): 638-648.
[26]ZHONG J H, MA L, LI L Q. Postoperative therapy options for hepatocellular carcinoma [J]. Scand J Gastroenterol, 2014,[E-pub ahead of print].
Liver resection for patients with hepatocellular carcinoma and portal hypertension
ZHANG Peijun1,2, ZHONG Jian-hong1, MA Liang1, CHEN Jie1, YOU Xue-mei1, ZHAO Wei-hua3(1. Department of Hepatobiliary Af fi liated Tumor Hospital, Guangxi Medical University, Nanning Guangxi 530021, China; 2. Department of, General Surgery, the First Central Hospital of Baoding, Baoding Hebei 071051, China; 3. Department of General Surgery, Wangdu County Hospital, Baoding Hebei 071051, China)
Background and purpose:The proportion of hepatocellular carcinoma (HCC) patients with cirrhosis and portal hypertension (PHT) is high. PHT may increase the risk of hemorrhage and liver failure. The aim of this study was to evaluate the safety and ef fi cacy of liver resection (LR) for patients with HCC and PHT.Methods:From 2006 to 2010, a total of 564 HCC patients with Child-Pugh A liver function and with (78) or without PHT (486) were retrospective analyzed. Complications after surgry, 30 and 90-day mortality, overall survival (OS), and recurrence rates were compared between the two groups. Propensity score analysis was also conducted to reduce confounding bias between the groups. Moreover, subgroup analysis based on tumor stage and the range of resection was carried out.Results:The complications after surgry, 30 and 90-day mortality of patients with PHT were signi fi cantly higher than those without PHT, before and after propensity analysis (P<0.05). After an average follow-up of 32.1 months, the 1-, 3-, 5-year OS of patients with PHT (75%, 45% and 32%) were signi fi cantly worse than those without PHT (90%, 66%
Hepatocellular carcinoma; Portal hypertension; Liver resection; Overall survival
10.3969/j.issn.1007-3969.2014.05.007
R735.7
A
1007-3639(2014)05-0361-06
2013-12-30
2014-03-26)
广西卫生厅科研课题(No:Z2012345;Z2011211)。
钟鉴宏 E-mail:zhongjianhong66@163.com
and 48%; P<0.001). However, the 1-, 3-, and 5-year recurrence rates were similar between PHT group (31%, 57%, and 73%) and without PHT group (26%, 53%, and 67%; P=0.53). Moreover, the OS of the two groups were similar after propensity analysis, and for patients with early stage HCC and those who underwent minor hepatectomy (all P>0.05).Conclusion:PHT is not the contraindication of LR for patients with HCC. Those with early stage HCC and who underwent minor hepatectomy are the best candidates to LR therapy.

