Bmi-1-siRNA抑制肺腺癌SPC-A1细胞的增殖及其机制
王艺芳 刘奔 刘纯青 郑翔宇 刘丹丹 朱杰 杨春辉 孟秀香
1.河南省红十字血液中心检验科,河南 郑州 450012;2.大连医科大学检验医学院,辽宁 大连 116044;3.大连医科大学诊断学实验中心,辽宁 大连 116044;4.大连医科大学第二临床学院检验科,辽宁 大连 116027
Bmi-1-siRNA抑制肺腺癌SPC-A1细胞的增殖及其机制
王艺芳1,2 刘奔3 刘纯青2 郑翔宇2 刘丹丹3 朱杰4 杨春辉4 孟秀香2
1.河南省红十字血液中心检验科,河南 郑州 450012;2.大连医科大学检验医学院,辽宁 大连 116044;3.大连医科大学诊断学实验中心,辽宁 大连 116044;4.大连医科大学第二临床学院检验科,辽宁 大连 116027
背景与目的:Bmi-1(B-cell specific moloneymurine leukemiavirus insertion site 1)基因是多梳基因家族的重要成员之一,主要通过调控INK4a/ARF位点来调节细胞的增殖和衰老。本研究旨在探讨Bmi-1-siRNA对具有INK4a/ARF位点的肺腺癌SPC-A1细胞生长和增殖的影响,并探讨其作用机制。方法:①本实验选用已确定有效的siRNA序列进行病毒包装,构建反转录病毒si-Bmi-1 pSUPERretro-neo,然后感染到SPC-A1细胞中,建立稳定表达Bmi-1-siRNA的肺癌细胞株。②利用RT-PCR和蛋白质印迹法(Western blot)技术分析Bmi-1基因在Bmi-1-siRNA转染后SPC-A1细胞中表达情况。③利用台盼蓝拒染法、MTT法、平板克隆形成实验和裸鼠实验,分析Bmi-1-siRNA对SPC-A1细胞体内外增殖能力的影响。④利用流式细胞术分析SPC-A1各组细胞的周期分布。⑤利用Western blot法分析增殖通路相关分子:p16INK4a、p53、Cyclin D1、PTEN和Ser473p-Akt等蛋白表达情况。结果:反转录病毒介导的Bmi-1-siRNA被转染后,有效抑制了SPC-A1细胞中Bmi-1基因的转录和表达,抑制了SPC-A1细胞的体内外增殖能力(P<0.01),并使转染组细胞阻滞在G1期[(64.6±1.2)%,P<0.05]。沉默Bmi-1基因后,与对照组细胞相比,p16INK4a、p53和Akt蛋白表达水平无明显变化(P>0.05),Cyclin D1和Ser473 p-Akt表达水平下降(P<0.01),PTEN表达水平上调(P<0.01)。用PTEN抑制剂处理转染组细胞后,Bmi-1和Ser473 p-Akt蛋白表达得以重塑。结论:Bmi-1-siRNA通过将肺腺癌SPC-A1细胞周期阻滞于G1期来抑制肿瘤细胞增殖,这种抑制作用可能不依赖于p16INK4a来调控Cyclin D1的表达,进而参与调控肿瘤细胞增殖。
Bmi-1基因;肺腺癌;细胞增殖
Bmi-1(B-cell specific moloneymurine leukemiavirus insertion site 1)基因是多疏基因家族(polycomb group gene)的重要调节基因之一。Bmi-1基因调节细胞的增殖和衰老主要是通过其下游经典位点INK4a/ARF来发挥作用[1]。在前期的实验中发现,沉默Bmi-1基因的表达能明显抑制INK4a位点缺失的A549肺腺癌细胞的增殖及体内致瘤能力[2-3]。为进一步明确Bmi-1基因与肺腺癌生长和增殖的关系,我们选用了具有INK4a位点的SPC-A1肺腺癌细胞,分析沉默Bmi-1的表达对具有INK4a/ARF位点的肺腺癌细胞生长和增殖能力的影响,并探讨其作用机制是否和经典靶位有关,是否还有其他靶位?旨在为肺癌的基因治疗提供新的靶点和思路。
1 材料和方法
1.1 细胞培养和稳定转染
本实验室根据GenBank中的Bmi-1 mRNA序列 (NM-005180),设计了4条Bmi-1 siRNA序列和1条阴性对照序列,根据以前的实验结果显示1号序列干扰效果最好,所以本次实验选用1号序列作为siRNA的靶序列。Sh-BMI1 pSUPERretro-neo克隆序列如下,Target:5’-CAAGCAGAAATGCATCGAA-3’; Sh-BMI1顺义链:5’-GATCCCCGCAAGCAGAAATGC ATCGAATTCAAGAGATTCGATGCATT TCTGCTTGCTTTTTA-3’;Sh-5’-AGCTTABMI1反义链:A A A A G C A A G C A G A A A T G C A T C G A A T C T C T T G A A T T C G A T G CATTTCTGCTTGCGGG-3’。Sh-BMI1-ctrpSUPERretro-neo克隆序列如下,Target:5’-CAGAGACTAGACAACATAG-3’;Sh-BMI1顺义链(ctr):5’-GATCCCCG C A G A G A C T A G A C A A C A T A G T T C A A G A G A C T A T G T T G T C T A G T C T C T G C T T T T T A-3’;S h-B M I 1反义链(ctr):5’-AGCTTAAAAAGCAGAGACTA GACAACATAGTCTCTTGAACTATGTT GTCTAGTCTCTGCGGG-3’。选择用BglⅡ和HindⅢ双酶切shRNA表达载体pSUPERretro-neo,载体大小7 641 bp,同时使用EGFP绿色荧光蛋白作为标志蛋白,具有G418抗性。构建重组反转录病毒siRNA表达载体质量组载体及稳定转染细胞的构建交由广州博川公司操作。未转染的细胞命名为SPC-A1-wt,转染pSUPER-retro-neo-Bmi-1和阴性对照序列的分别命名为SPC-A1-Bmi-1-siRNA和SPC-A1-ctr细胞。
1.2 RT-PCR检测
用TRIzol试剂提取细胞总RNA后,按照宝生物工程(大连)有限公司TaKaRa RNA PCR试剂盒说明书进行操作。引物序列如下:Bmi-1基因上游引物5’-TCATCCTTCTGCTGATGCTG-3’;Bmi-1基因
下游引物5’-GCATCACAGTCATTGCTGCT-3’;以GAPDH作为内参照基因,GAPDH上游引物:5’-GAAGGTGAAGGTCGGAGTC-3’;GAPDH下游引物:5’-GAAGATGGTGA TGGGATTTC-3’;PCR反应条件94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环。最后用2%琼脂糖凝胶对扩增产物电泳分析。
1.3 蛋白质印迹法(Western blot)检测
收获SPC-A1细胞提取总蛋白并进行SDSPAGE电泳、转膜和封闭。显影定影后用凝胶成像分析仪扫描胶片上的条带,运用灰度分析软件(Gel-Pro analyzer)读取相对积分光密度作为条带的强度指标并进行分析,用β-actin蛋白进行组间校正。实验重复3次。
1.4 细胞存活率检测
用0.04%台盼蓝分别对3组SPC-A1细胞进行染色,光镜下计数100个细胞中的死亡细胞数(其中着色细胞为死细胞),每个样品计数3次,并计算存活率。存活率(%)=[(100-死细胞数)/100]×100%。
1.5 MTT法检测细胞增殖
按每孔加5×103个细胞将3组细胞分别接种于96孔板培养细胞板,每组设5个平行孔。置37 ℃,CO2体积分数为5%温箱中培养。每天取一块板于酶标仪492 nm处读取各孔吸光度(A)值,绘制细胞生长曲线。连续测5 d,实验重复3次。
1.6 平板克隆法测定细胞的集落形成能力
于6孔板每孔中加入300个细胞,每组细胞平行设3个复孔。培养10 d,待细胞形成克隆后,用10%甲醛固定20 min,再用结晶紫染液染15 min,自来水冲洗干净。风干后用数码相机拍照,计数肉眼可见的集落数目。
1.7 体内成瘤
收获SPC-A1细胞,用磷酸盐缓冲液调整细胞浓度为6×107/mL。将18只裸鼠随机分为3组,每组裸鼠单侧前肢腋窝皮下注射一组SPC-A1细胞悬液150 μL。每天观察裸鼠的一般状况和肿瘤生长情况。4周后颈椎脱臼法处死裸鼠,分离出瘤块称重并拍照。
1.8 流式细胞术检测细胞周期
收集1×106个细胞,用70%乙醇轻轻混匀,4 ℃固定24 h。检测前用冷PBS洗两次,加入RNaseA 37 ℃反应1 h。加入碘化丙啶溶液避光染色1 h后,在流式细胞仪上进行检测,用ModFit LT for Maclntel软件分析。
1.9 统计学处理
本研究相关统计分析由SPSS 13.0软件完成,统计数据用表示。主要方法为单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 Bmi-1基因沉默对SPC-A1细胞表达Bmi-1的影响
反转录病毒载体转染后经筛选的SPC-A1细胞,在荧光显微镜下观察转染效果显示,未转染的细胞无荧光细胞,而转染组几乎全部为荧光细胞。转染Bmi-1-siRNA后,与SPC-A1-ctr (mRNA表达 0.11±0.02;蛋白表达1.29±0.17)和SPC-A1-wt(mRNA表达 0.12±0.01;蛋白表达1.32±0.13)两组细胞相比,SPC-A1-Bmi-1-siRNA细胞中Bmi-1的mRNA(0.02±0.01)和蛋白表达量(0.38±0.26)明显减少,其差异具有统计学意义(P<0.01,图1)。而SPC-A1-ctr和SPC-A1-wt两组细胞相比,差异无统计学意义(P>0.05,图1)。
2.2 Bmi-1基因沉默对SPC-A1细胞体外增殖的影响
用0.04%台盼蓝对SPC-A1细胞进行染色后,计算细胞的存活率(图2A):3组细胞存活率差异无统计学意义(P>0.05)。MTT法检测细胞的增殖活力,细胞生长曲线显示:与SPC-A1-ctr和SPC-A1-wt两组细胞相比,SPC-A1-Bmi-1-siRNA细胞在第3天及以后的时间点A值降低,生长速度明显缓慢(P<0.05,图2B);而后两组细胞的生长数值差异无统计学意义(P>0.05)。细胞培养10 d后形成克隆后,经结晶紫染色,用数码相机拍照。计数肉眼可见的集落数目,
结果显示:接种SPC-A1-Bmi-1-siRNA细胞的集落数目为(9.3±1.5)个/视野,与接种SPCA1-ctr[(343.0±7.0)个/视野]和SPC-A1-wt[(353.7±6.0)个/视野]细胞的集落数目相比显著降低(P<0.01);而SPC-A1-ctr 和SPC-A1-wt2组间细胞集落数目差异无统计学意义(P>0.05,图2C、D)。
2.3 Bmi-1基因沉默对SPC-A1细胞的裸鼠体内成瘤能力的影响
3组SPC-A1细胞分别接种于裸鼠腋窝皮下后,均可在裸鼠体内形成肿瘤。所成瘤块称重结果(图3A、B)显示,接种SPC-A1-Bmi-1-siRNA细胞的瘤块重量为(0.69±0.24)g,与接种SPC-A1-ctr (2.11±0.25)g和SPC-A1-wt(2.29±0.29)g细胞的瘤块重量相比显著降低(P<0.01),而接种SPC-A1-ctr 和SPC-A1-wt细胞的瘤块重量之间差异无统计学意义(P>0.05)。
2.4 Bmi-1基因沉默对SPC-A1细胞周期的影响
流式细胞仪检测细胞周期结果如表1所示,与SPC-A1-ctr[(57.8±1.3)%]和SPCA1-wt[(57.0±1.8)%]两组细胞相比,SPCA1-Bmi-1-siRNA细胞[(64.6±1.2)%]G0/G1期所占比例明显升高。SPC-A1-Bmi-1-siRNA细胞S期所占比例减少[(28.61±0.91)%],与SPC-A1-ctr[(35.69±1.46)%]和SPC-A1-wt[(36.18±0.37)%]两组细胞相比,差异有统计学意义(P均<0.05)。
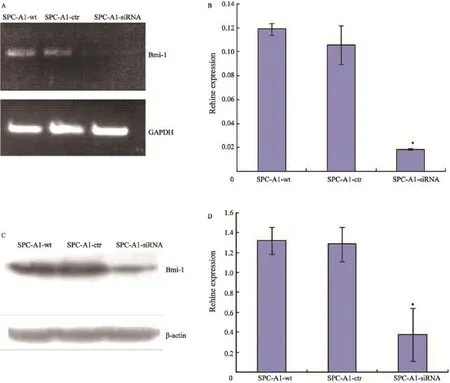
图1 沉默Bmi-1基因对SPC-A1细胞中Bmi-1 mRNA和蛋白的表达Fig. 1 Effects of Bmi-1-siRNA on Bmi-1 mRNA and protein expression in SPC-A1 cells
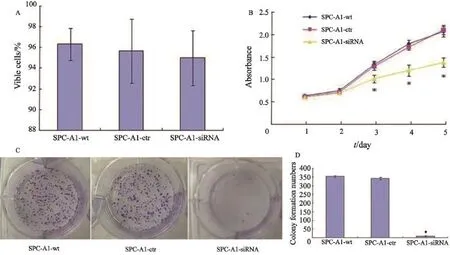
图2 沉默Bmi-1基因对SPC-A1细胞体外增殖能力的影响Fig. 2 Effects of Bmi-1-siRNA on the proliferation of SPC-A1 cells in vitro
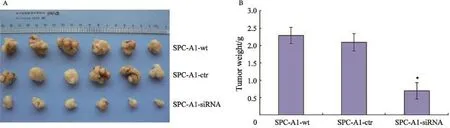
图3 沉默Bmi-1基因对SPC-A1细胞体内增殖能力的影响Fig. 3 Effects of Bmi-1-siRNA on the tumorigenesis of SPC-A1 cells in vitro
表1 三组SPC-A1细胞的细胞周期比较Tab. 1 Flow cytometric analysis of the cell cycle in SPC-A1 cells (n=3,,%)

表1 三组SPC-A1细胞的细胞周期比较Tab. 1 Flow cytometric analysis of the cell cycle in SPC-A1 cells (n=3,,%)
*: Compared with SPC-A1-wt and SPC-A1-ctr groups, P<0.05.
S Group G0/G1G2/M SPC-A1-wt 56.95±1.85 36.18±0.37 6.74±1.45 SPC-A1-ctr 57.76±1.33 35.69±1.46 6.54±0.71 SPC-A1-Bmi-1-siRNA 64.61±1.25* 28.61±0.91* 6.78±0.35
2.5 Bmi-1基因沉默对SPC-A1细胞生长相关通路蛋白表达的影响
采用Western blot法检测SPC-A1细胞生长相关通路蛋白的表达,结果显示,沉默Bmi-1基因后,与SPC-A1-ctr和SPC-A1-wt两组细胞相比,SPC-A1-Bmi-1-siRNA细胞中p16INK4a、p53的蛋白表达并无变化(P>0.05,图4、5),Cyclin D1表达下调(P<0.01),PTEN表达上调(P<0.01), Akt表达无改变(P>0.05,图4、5),Ser473 p-Akt表达下调(P<0.01)。使用不同浓度(0~100 nmol/L) PTEN抑制剂bpv(phen)作用于SPC-A1-Bmi-1-siRNA细胞2 h后,采用Western blot检测Bmi-1、PTEN、Ser473 p-Akt和Akt的蛋白。结果如图6所示,随着抑制剂浓度的升高,PTEN表达下降,而Bmi-1和Ser473 p-Akt表达上升。
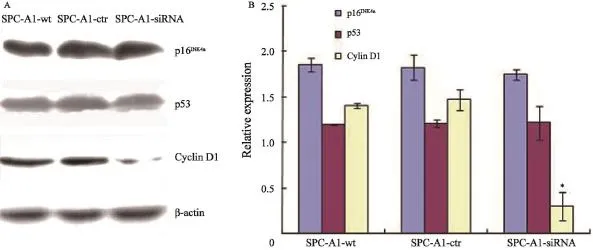
图4 沉默Bmi-1基因对SPC-A1细胞中p16、p53和Cyclin D1蛋白表达的影响Fig. 4 Effects of silencing Bmi-1 expression on p16INK4a, p53 and Cyclin D1 levels in SPC-A1 cells

图5 沉默Bmi-1基因对SPC-A1细胞中PTEN、Akt和Ser473 p-Akt蛋白表达的影响Fig. 5 Effects of Bmi-1-siRNA on Akt activity and PTEN expression

图6 PTEN抑制剂作用于SPC-A1-Bmi-1-siRNA细胞后,用Western blot检测Bmi-1和PTEN等蛋白表达Fig. 6 PTEN inhibitor bpv(phen) rescued p-Akt activity and Bmi-1 expression
3 讨 论
Bmi-1基因是荷兰癌症中心1991年在鼠淋巴瘤细胞中发现的[4]。研究发现,Bmi-1在调控细胞周期、细胞永生化与细胞衰老中发挥着重要作用。Bmi-1基因在多种肿瘤细胞中呈高表达并与肿瘤的预后不良相关,如乳腺癌[5]、非小细胞肺癌[6]、结直肠癌[7]、胃癌[8]及鼻咽癌[9]等。
在前期的实验中发现,沉默Bmi-1基因的表达使INK4a位点缺失的A549细胞周期阻滞在G0/G1期而影响其体内外增殖能力。本次实验选用了具有INK4a位点的SPC-A1肺腺癌细胞,结果显示:沉默Bmi-1基因的表达仍能够抑制SPC-A1细胞体内外增殖能力。台盼蓝拒染实验证实稳定转染后3组细胞的存活率并没有发生变化,说明沉默Bmi-1对SPC-A1细胞的生长抑制并非是由于细胞坏死引起的。分析各组细胞周期结果得出:Bmi-1-siRNA抑制SPC-A1细胞的增殖能力是通过将细胞阻滞在G0/G1期引起的。目前认为,肿瘤细胞的增殖受细胞周期的调节和细胞凋亡水平的调控[10]。p16INK4a和p53是INK4a/ARF的编码蛋白及下游分子[11]。在细胞周期中,p16INK4a的下调导致对Cyclin D1与CDK4 (周期素依赖蛋白激酶4)结合形成复合体的抑制作用减弱,细胞由G1期进入S期,细胞增殖活跃。另外,p53的下调也能使细胞周期和细胞凋亡受到影响。细胞周期的分布变化受到许多基因的调控,其中Cyclin D1是目前研究较多的细胞周期调控基因之一,与肿瘤的发生、发展关系密切[12]。CyclinD1是细胞从G1期到S期转化的一个重要细胞生长调节因子[13]。那么在
SPC-A1细胞中Bmi-1是否也如文献中报道的那样:沉默Bmi-1能通过其经典位点抑制增殖?本次Western blot实验结果显示,沉默Bmi-1基因后p16INK4a和p53的蛋白表达并无变化,而Cyclin D1表达下调。由上可知,沉默Bmi-1的表达并没有上调p16INK4a,但却导致了Cyclin D1的下调,说明Cyclin D1的表达并没有依赖p16INK4a调节,有可能通过其他方式调节使Cyclin D1表达下降。
有文献报道,Bmi-1调控肿瘤增殖的机制并非依赖p16INK4a来发挥作用[14-15],而是通过调节Akt/PKB活性在肿瘤中发挥作用,并与PI3K/Akt通路有关[16-18]。可Bmi-1是一个转录抑制子,是不能直接作用于PI3K/Akt通路的。Song等[19]发现,上调鼻咽癌细胞内Bmi-1的表达能通过抑制PTEN而激活PI3K/pAkt通路,说明PTEN可负性调控PI3K/Akt通路[20-21]。Fan等[22]在对前列腺癌DU145细胞的研究过程中发现,PTEN在细胞核中与Bmi-1有相互作用,这种相互作用可以使PTEN通过抑制Bmi-1的功能,使端粒酶活性降低;也可以使Bmi-1通过对PTEN作用,使 Akt活化受到明显抑制,从而影响肿瘤形成。PI3K/Akt信号通路是近年来发现的真核细胞内调控细胞生长的一条重要的信号通路,Akt是此通路的关键分子之一[23]。我们也在前期研究中发现,沉默Bmi-1基因的表达使A549细胞周期阻滞在G0/G1期同时伴有p-Akt和Cyclin D1的表达的下降,并且可能与PTEN/Akt/Cylin D1通路有关[3]。那么在SPC-A1细胞中Bmi-1是否也存在这样的通路呢?为了进一步证实这一点,本研究又检测了PTEN和p-Akt的表达,发现沉默Bmi-1后p-Akt的表达下调,PTEN表达上调;而使用PTEN抑制剂作用于SPC-A1-Bmi-1-siRNA细胞,却重塑了Bmi-1和p-Akt的表达。我们初步推测在肺腺癌SPC-A1中Bmi-1基因可能通过PI3K/Akt通路调节了Cyclin D1的表达来调控细胞周期,而且Bmi-1和PTEN之间还存在负性调节。
综上所述,Bmi-1参与肺腺癌SPC-A1细胞的增殖有可能通过这样的一条信号通路:Bmi-1→PTEN→PI3K/p-Akt→Cyclin D1,且与PTEN有相互作用。这为研究Bmi-1介导肿瘤细胞的增殖提供了除经典通路之外的另一条通路。这条通路在肺腺癌乃至其他腺癌是否具有普遍性,还需进一步研究。
致谢 本研究得到大连医科大学检验医学院赵宝霞老师的帮助和指导,大连医科大学附属第二医院聂大平、王朝晖老师的友情帮助,谨在此对她们表示衷心感谢。
[1]JACOBS J J, KIEBOOM K, MARINO S, et al. The oncogene and Polycomb-group gene bmi-1 regulates cell proliferation and senescence through the ink4a locus [J]. Nature, 1999, 397(6715): 164-168.
[2]YU Q, SU B L, LIU D, et al. Antisense RNA-mediated suppression of Bmi-1 gene expression inhibits the proliferation of lung cancer cell line A549 [J]. Oligonucleotides, 2007, 17(3): 327-335.
[3]郑翔宇, 朱杰, 王艺芳, 等. Bmi-1-siRNA对肺腺癌A549细胞体内外增殖能力的影响[J]. 中国癌症杂志, 2013, 23(6): 588-594.
[4]VAN LOHUIZEN M, FRASCH M, WIENTJENS E, et al. Sequence similarity between the mammalian bmi-1 protooncogene and the Drosophila regulatory genes Psc and Su (z)2[J]. Nature, 1991, 353 (6342): 353-355.
[5]KIM J H, YOON S Y, JEONG S H, et al. Overexpression of Bmi-1 oncoprotein correlates with axillary lymph node metastases in invasive ductal breast cancer [J]. Breast, 2004, 13 (5): 383-388.
[6]VONLANTHEN S, HEIGHWAY J, ALTERMATT H J, et al. The bmi-1 oncoprotein is differentially expressed in nonsmall cell lung cancer and correlates with INK4A-ARF locus expression [J]. Br J Cancer, 2001, 84 (10): 1372-1376.
[7]LI D W, TANG H M, FAN J W, et al. Expression level of Bmi-1 oncoprotein is associated with progression and prognosis in colon cancer [J]. J Cancer Res Clin Oncol, 2010, 136 (7): 997-1006.
[8]LIN J H, SONG L B, ZHANG X, et al. Bmi-1 expression predicts prognosis for patients with gastric carcinoma [J]. J Surg Oncol, 2008, 97 (3): 267-272.
[9]SONG L B, ZENG M S, LIAO W T, et al. Bmi-1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells [J]. Cancer Res, 2006, 66 (12): 6225-6232.
[10]汪桂华, 卢美红, 王敬春, 等. 结直肠癌细胞增殖诱导配体的异常表达促进肿瘤的生长和转移[J]. 中华肿瘤杂志, 2013, 35(4): 249-255.
[11]SHARPLESS N E, DEPINHO R A. The INK4A/ARF locus and its two gene products [J]. Curr Opin Genet Dev, 1999,
9(1): 22-30.
[12]张采凤, 夏永华, 郑庆芬, 等. siRNA下调星形细胞上调基因1表达对胃癌SGC-7901细胞增殖和细胞周期的影响[J]. 中华肿瘤杂志, 2013, 35(1): 22-27.
[13]GAUTSCHI O, RATSCHILLER D, GUGGER M, et al. Cyclin D1 in non-small cell lung cancer: A key driver of malignant transformation [J]. Lung Cancer, 2007, 55(1): 1-14.
[14]DATTA S, HOENERHOFF M J, BOMMI P, et al. Bmi-1 cooperates with H-Ras to transform human mammary epithelial cells via dysregulation of multiple growth-regulatory pathways [J]. Cancer Res, 2007, 67 (21): 10286-10295.
[15]SONG W, TAO K, LI H, et al. Bmi-1 is related to proliferation, survival and poor prognosis in pancreatic cancer [J]. Cancer Sci, 2010, 101(7): 1754-1760.
[16]GUO W J, ZENG M S, YADAV A, et al. Mel-18 acts as a tumor suppressor by repressing Bmi-1 expression and downregulating Akt activity in breast cancer cells [J]. Cancer Res, 2007, 67 (11): 5083-5089.
[17]LIU Y, YANG Y, XU H, et al. Implication of USP22 in the regulation of BMI-1, c-Myc, p16INK4a, p14ARF, and cyclinD2 expression in primary colorectal carcinomas [J]. Diagn Mol Pathol, 2010, 19 (4):194-200.
[18]LEE J Y, JANG K S, SHIN D H, et al. Mel-18 negatively regulates INK4a/ARF- independent cell cycle progression via Akt inactivation in breast cancer [J]. Cancer Res, 2008, 68 (11): 4201-4209.
[19]SONG L B, LI J, LIAO W T, et al. The polycomb group protein Bmi-1 represses the tumor suppressor PTEN and induces epithelial-mesenchymal transition in human nasopharyngeal epithelial cells [J]. J Clin Invest, 2009, 119(12): 3626-3636.
[20]MYERS M P, STOLAROV J P, ENG C, et al. PTEN, the tumor suppressor from human chromosome 10q23, is a dualspecificity phosphatase [J]. Proc Natl Acad Sci USA, 1997, 94(17): 9052-9057.
[21]TAMURA M, GU J, MATSUMOTO K, et al. Inhibition of cell migration, spreading, and focal adhesions by tumor suppressor PTEN [J]. Science, 1998, 280(5369): 1614-1617.
[22]FAN C, HE L, KAPOOR A, et al. PTEN inhibits BMI1 function independently of its phosphatase activity [J]. Mol Cancer, 2009, 8: 98.
[23]石晓明, 吴胜春, 董军界, 等. AQP-5基因沉默对结肠癌细胞增殖及信号转导通路的影响[J]. 中国癌症杂志, 2013, 23(4): 279-284.
Effects of Bmi-1-siRNA on proliferation of lung adenocarcinoma SPC-A1 cells and its mechanism
WANG Yi-fang1,2, LIU Ben2, LIU Chun-qing2, ZHENG Xiang-yu2, LIU Dan-dan2, ZHU Jie3, YANG Chun-hui3, MENG Xiu-xiang2(1. Department of Laboratory Diagnosis, Henan Red Cross Blood Center, Zhengzhou Henan 450012, China; 2. College of Laboratory Medicine of Dalian Medical University, Dalian Liaoning 116044, China; 3. Laboratory Center for Diagonostics, Dalian Medical University, Dalian Liaoning 116044, China; 4. Department of Laboratory Diagnosis, the Second Af fi liated Hospital of Dalian Medical University, Dalian Liaoning116027, China)
Background and purpose:The human oncogene B-cell-speci fi c moloney murine leukemia virus integration site 1 (Bmi-1) is an important member of the polycomb group family, and it regulates cell proliferation and senescence via INK4a/ARF locus. This study investigated the effects of Bmi-1-siRNA on the proliferation of lung adenocarcinoma cell line SPC-A1 cells with INK4a/ARF locus and clarify the mechanism of Bmi-1-mediated effect on proliferation of lung adenocarcinoma cells.Methods:In this study, we chose the most ef fi cient siRNA chain the pGeneshl-2-Bmi-1 sense-1 and inserted into a pSUPER-retro-neo retroviral vector. The packaged si-Bmi-1 pSUPERretro-neo retroviral vector was stably transfected into lung adenocarcinoma SPC-A1 cell line. The stably transfected cells were cultured and passed. After transfection, the levels of Bmi-1 mRNA and protein expression of SPC-A1 cells were analyzed by RT-PCR and Western blot respectively. Trypan blue, MTT and plate colony forming assay were performed to observe the proliferation capibility of SPC-A1 cells and evaluate the cloning forming ability in vitro. The potency of tumorigenesis was observed in nude mouse through hypodermic inoculation of SPC-A1 cells. Cell cycle distribution was analyzed by fl ow cytometry (FCM) in SPC-A1 cells. The expression levels of proliferation proteins including p16INK4a, p53, Cyclin D1, PTEN, Akt and Ser473p-Akt were analyzed by Western blot.Results:The mRNA and protein expression levels of Bmi-1 were signi fi cantly reduced in SPC-A1-Bmi-1-siRNA cells transfected with pSUPER-retroneo retroviral vector. Knockdown of Bmi-1 could inhibit the growth, colony formation in vitro and tumorigenesis in vivo of SPC-A1 cells (P<0.01). The transfected SPC-A1 cells were arrested in G1phase [(64.6±1.2)%, P<0.05]. Compared with two control groups, p16INK4a, p53 and Akt were not affected (P>0.05), while Cyclin D1 and Ser473p-Akt were downregulated (P<0.01) and PTEN was up-regulated (P<0.01) in the SPC-A1-Bmi-1-siRNA cells. SPC-A1-Bmi-1-siRNA cells were treated with various concentrations of PTEN inhibitor to determine expression levels of PTEN, Bmi-1 and Ser473p-Akt protein. Ablation of PTEN rescued Bmi-1 and Ser473p-Akt expression in SPC-A1-Bmi-1-siRNA cells.Conclusion:Knockdown of Bmi-1 gene can arrest the proliferation of SPC-A1 cells through G0/G1phase arrest by inhibiting Cyclin D1 expression indirectly, which may be not associated with p16INK4asignaling pathway.
Bmi-1 gene; Lung adenocarcinoma; Proliferation
10.3969/j.issn.1007-3969.2014.05.003
R734.2
A
1007-3639(2014)05-0333-09
2013-12-25
2014-03-11)
辽宁省科技厅自然科学基金项目(No:20072169)。
孟秀香 E-mail:xiuxiang_meng@sina.com

