骨髓间充质干细胞延缓大鼠残肾模型肾纤维化的研究
边晓慧,赵桂锋,孙立,刘娜,李德天,冯江敏
(1.中国医科大学附属第一医院肾内科,沈阳110001;2.中国医科大学附属盛京医院肾内科,沈阳110004;3.中国医科大学附属盛京医院先天畸形研究中心实验室,沈阳110004;4.内蒙古鄂尔多斯市中心医院肾内科,内蒙古鄂尔多斯017000)
骨髓间充质干细胞延缓大鼠残肾模型肾纤维化的研究
边晓慧1,2,赵桂锋3,孙立1,刘娜4,李德天2,冯江敏1
(1.中国医科大学附属第一医院肾内科,沈阳110001;2.中国医科大学附属盛京医院肾内科,沈阳110004;3.中国医科大学附属盛京医院先天畸形研究中心实验室,沈阳110004;4.内蒙古鄂尔多斯市中心医院肾内科,内蒙古鄂尔多斯017000)
目的观察骨髓间充质干细胞(MSC)延缓肾纤维化的能力以及可能的机制。方法建立SD大鼠5/6肾切除残肾模型,尾静脉注射绿色荧光蛋白标记的MSC,移植后4周观察肾功能以及肾脏病理的改变,应用免疫组化和免疫印迹方法观察残肾组织中CD44、CD68、TGF-β1和α-SMA的表达。结果MSC能够改善残肾功能和延缓肾纤维化;MSC不仅减少了巨噬细胞的浸润和肌成纤维细胞的堆积,而且抑制了CD44和TGF-β1的表达。结论MSC治疗能够延缓肾纤维化,其主要机制可能与其抗炎作用和免疫抑制有关。
骨髓间充质干细胞;5/6肾切除;慢性肾衰竭;肾纤维化
肾脏纤维化是各种慢性肾脏病进展至终末期肾衰竭的共同通路,因为终末期肾衰竭只能依靠血液净化治疗或肾移植来延缓生命,所以延缓或逆转肾纤维化对阻止进入终末期肾衰竭具有重大意义,但至今尚无特异有效的治疗方法。很多研究都已证实骨髓间充质干细胞(mesenchymal stem cell,MSC)能够通过不同机制改善和逆转急性肾脏损伤:减轻管周毛细血管丛的损失,促进肾小管修复[1~3];减少肾脏细胞凋亡、减少中性粒细胞和巨噬细胞浸润,增加抗炎因子的释放[4~6]。对于MSC是否能够延缓慢性肾脏病的肾纤维化发生发展,因为基础疾病的差别而出现研究结果的差异[7~11]。本课题组前期实验发现大鼠5/6肾切除术后的第8周给予尾静脉注射MSC能够改善残肾功能,故本实验拟进一步研究MSC延缓残肾纤维化可能的机制。
1 材料与方法
1.1 材料
稳定转染绿色荧光蛋白的大鼠骨髓间充质干细胞(MSC/GFP)购自广州赛业生物科技有限公司(RASMX-01101)。成年健康雄性SD大鼠24只,体质量200~250 g。主要试剂包括SD大鼠间质干细胞基础培养基(广州赛业,RASMX-03011-440)、10% MSC专用胎牛血清(广州赛业,RASMX-05001-50)、
小鼠抗大鼠TGF-β1单克隆抗体(美国Santa Cruz公司)、小鼠抗大鼠α-SMA单克隆抗体(博士德试剂有限公司)、兔抗大鼠CD68多克隆抗体(博士德试剂有限公司)、小鼠抗大鼠CD44单克隆抗体(美国Santa Cruz公司)、小鼠抗绿色荧光蛋白标签单克隆抗体(美国Earth OX公司)。
1.2 方法
1.2.1 细胞培养:MSC/GFP分离来自SD大鼠骨髓,通过腺病毒转染将绿色荧光蛋白报告基因稳定整合至细胞染色体,能够持续表达绿色荧光蛋白,而不影响细胞的形态、增殖和分化。MSC/GFP在体外有强烈的增殖和分化能力,可以分化为成骨细胞、软骨细胞和脂肪细胞。MSC/GFP在37℃和5%CO2的恒温箱中进行常规细胞培养。
1.2.2 建立5/6肾切除大鼠模型和实验动物分组:24只成熟雄性SD大鼠经过适应性饲养1周后随机分成3组(每组8只):假手术组(假手术大鼠尾静脉注射MSC)、模型组(5/6肾切除大鼠尾静脉注射PBS)、MSC组(5/6肾切除大鼠尾静脉注射MSC)。根据参考文献[12]通过二步法进行5/6肾切除术,前后间隔1周,假手术组只给予先后2次麻醉和剥离双肾被膜,而不进行肾切除。术后第8周尾静脉注射1 mL PBS或1 mL悬浮1×107MSC的PBS,治疗4周后处死大鼠,留取血标本和残肾组织进行下一步检查。
1.2.3 肾功能测定:酶法测定血清肌酐浓度,尿素酶法测定尿素氮浓度,检测仪器为全自动生化仪。
1.2.4 体内MSC的追踪:应用免疫荧光法进行残肾组织中的MSC/GFP追踪,冰冻切片(10 μm),甲醇浸泡30 min,滴加小鼠抗绿色荧光蛋白标签单克隆抗体(1∶5 000)4℃过夜,避光滴加FITC标记山羊抗小鼠IgG(1∶50),DAPI复染核5 min,共聚焦显微镜观察所有非连续切片的所有绿色荧光蛋白阳性的部位。
1.2.5 组织形态学观察:常规进行HE和Masson染色后,每张切片均观察30个肾小球和20个100倍的皮质视野,根据盲法原则由另外病理医师完成,采用半定量方法计算小球硬化指数[13]和小管间质损伤指数[14],肾小球硬化定义为局灶或球性毛细血管袢的闭塞或玻璃样,肾小管间质损伤的定义为炎性细胞浸润、小管萎缩/代偿性扩张和间质纤维化。
1.2.6 免疫组化:石蜡切片(4 μm),脱蜡,热修复,5%脱脂奶粉封闭,分别加入一抗:小鼠抗大鼠α-SMA抗体(肌成纤维细胞标记,1∶320)、小鼠抗大鼠TGF-β1抗体(1∶200)、兔抗大鼠CD68抗体(巨噬细胞标记,1∶150),小鼠抗大鼠CD44单克隆抗体(1∶200)按ABC法进行免疫组化染色,DAB显色;PBS替代一抗作为阴性对照。每张切片随机取10个高倍视野(×400),计算积分光密度值(integrated optical density,IOD)。
1.2.7 免疫印迹:称取100 mg残肾肾皮质,提取总蛋白,应用BCA法测定蛋白浓度,变性,聚丙烯酰胺凝胶电泳,转膜,封闭,不同的转移膜分别加入不同一抗[小鼠抗大鼠α-SMA单克隆抗体(1∶160)、小鼠抗大鼠TGF-β1单克隆抗体(1∶200)、小鼠抗大鼠CD44单克隆抗体(1∶300)和兔抗大鼠β-actin单克隆抗体(1∶2 000)]4℃过夜,加入相应的二抗,ECL显色发光,图像分析系统测定光密度值。
1.3 统计学处理
结果用x±s表示。应用SPSS 13.0统计软件对数据进行处理。组间数据比较用单因素方差分析,进一步用LSD进行组间两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 MSC的体内追踪
体外培养MSC持续发出绿色荧光,应用MSC治疗4周后,在残肾组织中发现绿色荧光蛋白标记的MSC,主要定位于肾小球内、肾小管上皮细胞,肾间质以及肾小管管周毛细血管丛内。见图1。

图1 肾组织中追踪绿色荧光蛋白标记的MSC×400Fig.1 Tracking of GFP labeled MSC in kidney tissue by immunofluorescence×400
2.2 MSC治疗5/6肾切除后残肾的功能和病理的变化
与假手术组比较,模型组大鼠的血清肌酐和尿素均明显升高(P<0.05),而与模型组比较,MSC治疗组的残肾功能明显改善,HE和Masson染色结果发现,模型组的残肾组织出现广泛的肾小球明显肥大、部分肾小球出现节段性硬化或全球硬化、肾小管上皮细胞浊肿空泡变性,部分肾小管出现明显的
扩张或萎缩;大量的炎性细胞浸润,肾间质灶性间质水肿或纤维化,MSC治疗组的病理改变明显改善。进一步计算发现MSC能够有效减少肾小球硬化指数和肾小管间质损伤指数(P<0.05),见表1,图2、3。
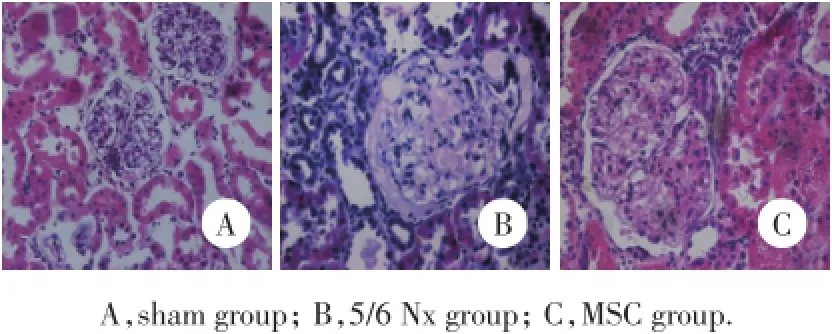
图2 肾组织的HE染色×400Fig.2 HE staining in kidney tissue×400

图3 肾组织的Masson染色×400Fig.3 Masson staining in kidney tissue×400
2.3 MSC治疗后CD44、CD68、TGF-β1和α-SMA的表达变化(图4~7、表2)
2.3.1 免疫组化:与假手术组比较,5/6肾切除术后在残肾组织肾小球和肾间质内有大量的巨噬细胞浸润(CD68阳性细胞)和肌成纤维细胞(α-SMA阳性细胞)堆积,同时肾小球明显表达CD44和TGF-β1。给予MSC治疗4周后不仅CD44、和TGF-β1的表达减少,而且巨噬细胞和肌成纤维细胞也明显减少(P<0.05)。
2.3.2 免疫印记:5/6肾切除术后,残肾组织的CD44、TGF-β1和α-SMA的蛋白表达明显升高,而给
予MSC治疗4周后,TGF-β1、α-SMA和CD44的蛋白表达均减少(P<0.05)。
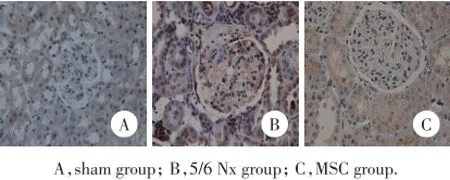
图4 肾组织中CD68的免疫组化染色×400Fig.4 CD68 immunohistochemistry staining in kidney tissue× 400

图5 肾组织中CD44的免疫组化染色(×400,左图)和免疫印迹(右图)Fig.5 CD44 immunohistochemistry staining in kidney tissue(×400,left)and Western blot for CD 68(right)

图6 肾组织中TGF⁃β1的免疫组化染色(×400,左图)和免疫印迹(右图)Fig.6 TGF⁃β1 immunohistochemistry staining in kidney tissue(×400,left)and Western blot for TGF⁃β1(right)

图7 肾组织中α⁃SMA的免疫组化染色(×400,左图)和免疫印迹(右图)Fig.7α⁃SMA immunohistochemistry staining in kidney tissue(×400,left)and Western blot for α⁃SMA(right)
表1 MSC治疗对肾功能和肾脏组织参数的影响Tab.1 Effect of MSC treatment on renal function and histological parameters

表1 MSC治疗对肾功能和肾脏组织参数的影响Tab.1 Effect of MSC treatment on renal function and histological parameters
1)P<0.05 vs sham group;2)P<0.05 vs 5/6 Nx group.
?
表2 各组CD44、CD68、TGF-β1和α-SMA表达的比较Tab.2 Comparisons the expression of CD44,CD68,TGF-β1 andα-SMA in each group(x±s)
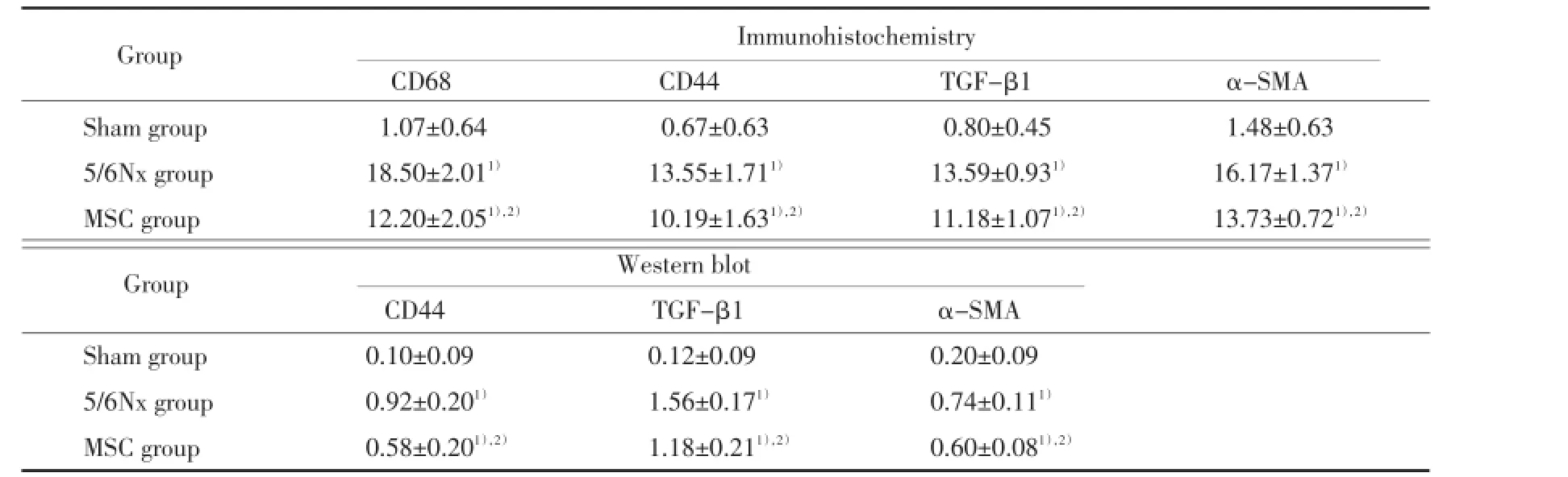
表2 各组CD44、CD68、TGF-β1和α-SMA表达的比较Tab.2 Comparisons the expression of CD44,CD68,TGF-β1 andα-SMA in each group(x±s)
1)P<0.05 vs sham group;2)P<0.05 vs 5/6 Nx group.
?
3 讨论
目前关于MSC治疗各种慢性肾脏病的研究较少,而且研究结果并不一致,众多研究者[7~9]应用MSC治疗慢性马兜铃酸肾病大鼠后,发现管周毛细血管丛得到修复,肾小管萎缩及肾间质纤维化程度明显减轻;Ninichuk等[10]在Col4α3缺乏的大鼠模型中的研究中发现MSC虽然能够减少管周毛细血管丛的丢失,减少纤维化,但并未改善肾脏功能,增加存活率;Kunter等[11]发现MSC虽然改善抗-Thy1.1肾小球肾炎的肾功能,但是发现部分归巢的MSC分化为脂肪细胞,反而促进肾纤维化的发生。分析引起这种现象的可能原因之一是与肾脏病的原发病不同有关。本研究选择大鼠5/6肾切除做为研究模型,是因为其模拟了各种病因引起的大量肾单位的丧失后共同出现的残余肾单位高灌注、高滤过和高压(三高)病理生理改变,所以其最终肾脏纤维化的发生与发展与原发病无关。
与Villanueva等[15]的研究结果相似,本试验发现5/6肾切除术后出现了明显的肾脏病理改变,即残存肾单位的肾小球肥大,肾小管扩张,炎性细胞浸润,局灶性的肾小球硬化和肾间质纤维化,而给予MSC治疗4周后,不仅肾功能得到改善,而且上述病理改变也明显减轻。定量指标肾小球硬化指数和肾小管间质损伤指数的明显降低也进一步支持MSC能够延缓残肾组织的纤维化。
目前大部分研究证实MSC能够修复受损肾脏的机制可能包括转分化、融合或旁分泌机制。体内外研究证实MSC可以分化为血管内皮细胞[8]、肾小管上皮细胞[16]和足细胞[17],我们的实验结果提示,绿色荧光蛋白在部分肾小管上皮细胞和肾小球球内细胞表达,那么推测归巢的MSC可能融合或转分化为肾脏固有细胞,但是与目前大多数研究的结果相似,本研究在给予尾静脉注射1×107MSC治疗4周后,归巢的MSC比例较少,那么推测MSC可能主要是通过旁分泌机制来延缓肾纤维化。各种原因导致的慢性肾脏病,即使病因去除,健存肾单位仍会进一步丧失功能,其主要原因是残存肾单位肾小球出现“三高”引起炎性细胞浸润,分泌炎症相关因子和致纤维化因子,肾脏固有细胞的表型转化,大量细胞外基质的堆积,最终导致肾纤维化的发生。本研究中,我们发现在残肾组织中大量巨噬细胞(CD68阳性细胞)的浸润,致纤维化因子TGF-β1的明显表达以及肌成纤维细胞(α-SMA阳性细胞)的大量出现,给予MSC治疗后,与既往的研究结果类似[18,19],CD68、TGF-β1和α-SMA的表达均明显减少,
同时肾小球硬化指数和肾小管间质损伤指数明显降低,这提示MSC可能通过抗炎和免疫抑制等旁分泌机制来延缓肾纤维化。
本研究还发现残肾组织中CD44的表达也明显增加,既往认为CD44在急慢性肾脏损伤中是导致炎性细胞浸润的重要原因[20,21],因为敲除CD44基因的小鼠在甘油诱导和缺血再灌注损伤导致的急性肾衰竭模型中均能通过减少早期炎性细胞浸润从而减轻肾脏损伤[1]。本研究中,模型组大鼠的肾小球内CD68和CD44表达均明显增加,提示CD44与肾小球内的巨噬细胞浸润可能有关。本次研究发现给予MSC治疗后,残肾组织的CD44表达也减少,那么推测MSC有可能通过减少CD44的表达而减轻巨噬细胞的浸润,但MSC减少CD44的机制并不明确,需要进一步研究。
综上所述,我们的研究表明MSC能够延缓5/6肾切除术后残肾组织的纤维化,改善肾功能,其主要的机制可能是通过旁分泌机制减轻炎性细胞(如巨噬细胞)浸润,减少致纤维化因子(如TGF-β1)表达,从而减轻上皮细胞转分化为肌成纤维细胞,最终延缓肾纤维化的发生和发展。
[1]Herrera MB,Bussolati B,Bruno S,et al.Exogenous mesenchymal stem cells localize to the kidney by means of CD44 following acute tubular injury[J].Kidney Int,2007,72(4):430-441.
[2]Morigi M,Introna M,Imberti B,et al.Human bone marrow mesenchymal stem cells accelerate recovery of acute renal injury and prolong survival in mice[J].Stem Cells,2008,26(8):2075-2082.
[3]Imberti B,Morigi M,Tomasoni S,et al.Insulin-like growth factor-1 sustains stem cell mediated renal repair[J].J Am Soc Nephrol,2007,18(11):2921-2928.
[4]Togel F,Weiss K,Yang Y,et al.Vasculotropic,paracrine actions of infused mesenchymal stem cells are important to the recovery from acute kidney injury[J].Am J Physiol Renal Physiol,2007,292(5):F1626-1635.
[5]Semedo P,Wang PM,Andreucci TH,et al.Mesenchymal stem cells ameliorate tissue damages triggered by renal ischemia and reperfusion injury[J].Transpl Proc,2007,39(2):421-423.
[6]Togel F,Yang Y,Zhang P,et al.Bioluminescence imaging to monitor the in vivo distribution of administered mesenchymal stem cells in acute kidney injury[J].Am J Physiol Renal Physiol,2008,295(1):F315-321.
[7]邹杰,冯江敏,李维,等.同种异体骨髓间充质干细胞对肾小管周毛细血管丛修复影响的研究[J].中国中西医结合杂志,2008,28(2):146-151.
[8]马俊伟,常楚,战杰,等.血管内皮细胞生长因子165在诱导骨髓间充质干细胞内皮化中的作用[J].中国医科大学学报,2010,39(10):812-814.
[9]李维,冯江敏,邹杰,等.骨髓干细胞移植治疗慢性马兜铃酸肾病大鼠的实验研究[J].中国医科大学学报,2007,36(3):300-302.
[10]Ninichuk V,Gross O,Segerer S,et al.Multipotent mesenchymal stem cells reduce interstitial fibrosis but do not delay progression of chronic kidney disease in collagen4α3-deficient mice[J].Kidney Int,2006,70(1):121-129.
[11]Kunter U,Rong S,Djuric Z,et al.Transplanted mesenchymal stem cells accelerate glomerular healing in experimental glomerulonephritis[J].J Am Soc Nephrol,2006,17(8):2202-2212.
[12]Schaefer F,Chen Y,Tsao T,et al.Impaired JAK-STAT signal transduction contributes to growth hormone resistance in chronic uremia[J].J Clin Investigation,2001,108(3):467-475.
[13]Aoyama I,Shimokata K,Niwa T.Combination therapy with benazepril and oral adsorbent ameliorates progressive renal fibrosis in uremic rats[J].Nephron,2002,90(3):297-312.
[14]Tanaka T,Kojima I,Ohse T,et al.Cobalt promotes angiogenesis via hypoxia-inducible factor and protects tubulointerstitium in the remnant kidney model[J].Lab Investigation,2005,85(10):1292-1307.
[15]Villanueva S,Cespedes C,Gonzalez A,et al.bFGF induces an earlier expression of nephrogenic proteins after ischemic acute renal failure[J].Am J Physiol Regul Integr Comp Physiol,2006,291(6):1677-1687.
[16]Qian H,Yang H,Xu W,et al.Bone marrow mesenchymal stem cells ameliorate rat acute renal failure by differentiation into renal tubular epithelial-like cells[J].Int J Mol Med,2008,22(3):325-332.
[17]Prodromidi EI,Poulsom R,Jeffery R,et al.Bone marrow derivedcells contribute to podocyte regeneration and amelioration of renal disease in a mouse model of alport syndrome[J].Stem Cells,2006,24(11):2448-2455.
[18]Villanueva S,Ewertz E,Carrión F,et al.Mesenchymal stem cell injection ameliorates chronic renal failure in a rat model[J].Clin Sci,2011,121(11):489-499.
[19]Semedo P,Correa-Costa M,Antonio Cenedeze M,et al.Mesenchymal stem cells attenuate renal fibrosis through immune modulation and remodeling properties in a rat remnant kidney model[J].Stem Cells,2009,27(12):3063-3073.
[20]Declèves AE,Caron N,Nonclercq D,et al.Dynamics of hyaluronan,CD44,and inflammatory cells in the rat kidney after ischemia/reperfusion injury[J].Int J Mol Med,2006,18(1):83-94.
[21]Jun Z,Hill PA,Lan HY.CD44 and hyaluronan expression in the development of experimental crescentic glomerulonephritis[J]. Clin Exp Immunol,1997,108(1):69-77.
(编辑 武玉欣)
MesenchymalStem CellAttenuate RenalFibrosisin RatRemnant Kidney Model
BIANXiao-hui1,2,ZHAOGui-feng3,SUNLi1,LIUNa4;LIDe-tian2;FENGJiang-min1
(1.DepartmentofNephrology,The FirstHospital,China MedicalUniversity,Shenyang 110001,China;2.DepartmentofNephrology,Shengjing Hospital,China Medical University,Shenyang 110004,China;3.Key Laboratory of Health Ministry for Congential Malformation,Shengjing Hospital,China Medical University,Shenyang 110004,China;4.Departmentof Nephrology,The CentralHospitalofOrdos City,Ordos017000,China)
ObjectiveTo investigate the role of mesenchymal stem cells(MSC)therapy in renal fibrosis and explore the mechanism.MethodsRemnant kidney model was established by 5/6 nephrectomy in Sprague-Dawley rats,and the animals received MSC treatment via tail vein injection. Renal function and histological analysis were performed 4 weeks after cell transplantation.Immunohistochemistry and Western blot were used to detect the expression of CD44,CD68,TGF-β1 and α-SMA.ResultsThe functional benefits of MSC treatment were demonstrated by improved clinical signs and reduced fibrosis formation.The infiltration of macrophages and the accumulation of myofibroblasts were reduced after MSC treatment. The levels of TGF-β1 and CD44 were also decreased in MSC treated groups.ConclusionMSC therapy can attenuate fibrosis progression in remnantkidney model.Moreover,the anti-inflammatory and immunosuppressive potentialofMSCmay be involved in the decreased fibrosis in kidney.
mesenchymal stem cell;5/6 nephrectomy;chronic renal failure;kidney fibrosis
R692.5;R457.7
A
0258-4646(2014)02-0131-05
辽宁省自然科学基金(20072095);辽宁省社会发展攻关计划(201225094)
边晓慧(1976-),女,讲师,硕士.
冯江敏,E-mail:fengjiangmin@hotmail.com
2013-11-27
网络出版时间:

