促红细胞生成素对难愈创面患者康复的影响
钟顺平,李景铧,李前进
(重庆长安医院外二科,重庆400020)
在各种因素影响下创面经久不愈,易引起炎症病理变化,影响创面的愈合而形成恶性循环,如创伤、糖尿病足、褥疮、静脉性溃疡及动脉闭塞性溃疡等。难愈创面往往引起较高的致残率,是困扰临床外科医生的一个治疗难题,随着研究的不断深入,皮肤替代物、生长因子、创面负压等新的治疗措施出现并展现出广泛的应用前景[1~3]。本研究在难愈创面患者常规治疗的同时应用促红细胞生成素(erythropoietin,EPO)取得较好效果,现报告如下。
1 资料与方法
1.1 临床资料 本研究中60例难愈溃疡(创面)患者均选自2011年9月~2012年12月医院烧伤、整形外科收治的患者,主要包括创伤、糖尿病足、褥疮、静脉性溃疡、术后切口裂开和动脉闭塞性溃疡等因素引起的难愈创面。其中男性36例,女性24例;年龄39~81岁,平均(58.4±8.1)岁;溃疡病程2~11个月,平均(4.29±1.72)个月。排除高血压、恶性肿瘤、溃疡恶变、严重并发症、低蛋白血症及肢体坏死需截肢的患者。所有患者均知情同意。两组患者在性别、年龄、创面面积、创面深度以及病因方面比较,均无显著性差异(P>0.05),见表1。
1.2 分组与评估方法 按随机数字表法将60例患者分成两组,对照组和EPO治疗组各30例。两组患者均进行常规换药处理。EPO治疗组患者皮下注射重组人促红细胞生成素(成都地奥九泓制药厂,国药准字S19991005,3000IU/支)3000IU,每周两次,患者局部和系统性治疗保持不变。两组患者治疗前后采取静脉血3ml,离心后分离血清,-80℃保存备用。双抗体夹心ELISA法检测血清血管内皮生长因子(vascular endothelial growth factor,VEGF)和 EPO水平。试剂盒均购自美国RD公司,严格按照试剂盒说明书操作,采用Bio-Rad 680酶标仪检测吸光度。治疗前后采用计算机图像分析软件扫描创面面积、创面肉芽组织生长情况,采用新生肉芽覆盖创面面积与原始创面面积的比值来表示,上皮组织生长情况,以上皮化创面与原始创面面积的比值来评估。

表1 两组患者一般资料比较Table 1 The general data
1.3 统计学方法 所有数据采用SPSS 19.0统计学软件进行分析,计量资料用均数±标准差(±s)表示,计数资料用百分比表示。计量资料比较采用t检验,计数资料比较采用卡方检验。P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者疗效比较 两组患者治疗1周后创面肉芽组织生长和上皮化程度无明显差异(P>0.05),治疗2周后EPO治疗组患者创面肉芽组织生长情况和上皮化程度均显著增加与对照组比较(P<0.05),见表2。
表2 两组患者不同治疗周期疗效比较(×10-2,±s)Table 2 The therapeutic effect
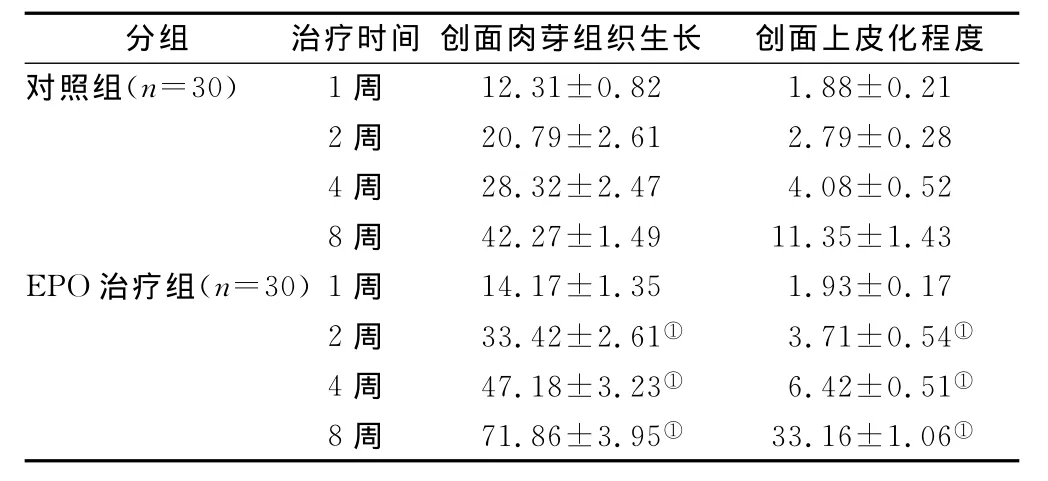
表2 两组患者不同治疗周期疗效比较(×10-2,±s)Table 2 The therapeutic effect
注:与对照组同期比较,①P<0.05
?
2.2 两组患者治疗前后血清EPO和VEGF水平检测 与治疗前相比,EPO治疗后血清促红细胞生成素浓度和VEGF水平随着治疗时间的延长逐渐增加(P<0.05),见表3,4。
表3 两组患者治疗前后血清促红细胞生成素浓度(μmol/L,±s)Table 3 Serum hemopoietin before and after treatment

表3 两组患者治疗前后血清促红细胞生成素浓度(μmol/L,±s)Table 3 Serum hemopoietin before and after treatment
注:与治疗前比较,①P<0.05;与对照组同期比较,②P<0.05
组别 n 治疗前 治疗后1周 治疗后2周 治疗后4周 治疗后8周对照组 30 14.27±3.62 15.13±4.51 14.92±3.26 15.07±4.13 15.22±3.84 EPO治疗组 30 14.45±4.09 16.21±5.22① 16.72±3.82①② 17.94±4.10①② 19.32±4.29①②
表4 两组患者治疗前后血清VEGF水平变化(pg/mL,±s)Table 4 Serum VEGF before and after treatment

表4 两组患者治疗前后血清VEGF水平变化(pg/mL,±s)Table 4 Serum VEGF before and after treatment
注:与治疗前比较,①P<0.05;与对照组同期比较,②P<0.05
组别 n 治疗前 治疗后1周 治疗后2周 治疗后4周 治疗后8周对照组 30 88.53±7.18 91.33±10.27 87.32±8.93 85.21±7.76 97.71±9.18①EPO治疗组 30 90.13±8.54 88.52±9.06 102.31±8.62①② 114.21±10.43①② 121.17±11.37①②
3 讨论
皮肤能够保护机体免受外部因素的影响,如辐射、脱水、和病原微生物的入侵[4]。皮肤遭到损伤以后,快速而充分的修复是保证机体组织完整性和稳态的首要任务。皮肤伤口愈合是真皮和表皮组织再生的生理过程,生长因子通过介导细胞与细胞间、细胞与胞外基质的相互作用,从而增强趋化作用、细胞增殖、血管生成、胞外基质沉积和重塑。糖尿病、免疫抑制等多种因素可影响正常的生理愈合过程,导致创面经久不愈,严重影响患者的生活质量。
近年来,一些生长因子已经被证明能够调节皮肤伤口修复,如表皮生长因子(epidermal growth factor,EGF)、成纤维细胞生长因子(fibroblast growth factor,FGF)[5,6]。促红细胞生成素是一种能够促进红系细胞增殖、分化和成熟的生长因子,目前主要用于治疗各种因素引起的贫血和肾功能衰竭。除了其造血作用,EPO已被证明在中枢神经和心血管系统,以及肾脏和肝脏具有如促进血管生成、细胞保护作用、抗炎、抗凋亡作用[7,8]。动物实验和临床研究均发现EPO能够抑制干扰素(IFN)、肿瘤坏死因子-α(TNF-α)等炎症因子的释放,减轻炎性细胞的浸润和中性粒细胞的激活[9,10]。此外,Nikolai[11]等人发现 EPO 可激活Smad依赖的TGF-β信号通路,促进成纤维细胞的分化,加速小鼠皮肤伤口愈合。最近Ferri[12]等人也报道了利用重组人红细胞生成素成功治疗系统性硬化症(Systemic sclerosis,SSc)的病例,经过6个月的治疗,上皮祖细胞数量显著增加,凋亡率明显降低。鉴于重组促红细胞生成素较好的临床安全性和加速伤口愈合的能力,本研究将EPO用于对难愈创面的治疗研究,结果显示EPO治疗2周至8周患者创面肉芽组织生长情况和上皮化程度均显著增加(P<0.05),同时VEGF水平显著增加,表明EPO能够促进血管生成,加速伤面上皮细胞的生长,进一步证明了EPO对组织细胞的保护性作用。血清中高水平的EPO也可能通过抑制创面的炎症反应,促进创面的愈合。
4 结论
本研究表明,EPO可促进难愈创面的肉芽组织形成和创面愈合,为难愈创面的治疗提供了新的思路。使用低剂量EPO进行辅助治疗,未发现任何副作用和并发症,但高剂量的使用及其对合并高血压、严重贫血患者的效果还需进一步探索。
[1] E.Bovill,P.E.Banwell,L.Teot,et al.Topical negative pressure wound therapy:a review of its role and guidelines for its use in the management of acute wounds[J].Int Wound J,2008,5(4):511-529.
[2] N.Itoh and D.M.Ornitz.Fibroblast growth factors:from molecular evolution to roles in development,metabolism and disease[J].J Biochem,2011,149(2):121-130.
[3] R.A.Clark,K.Ghosh,and M.G.Tonnesen.Tissue engineering for cutaneous wounds [J].J Invest Dermatol,2007,127(5):1018-1029.
[4] 牟 斌,王成刚,李宗瑜,等.持续负压封闭引流在深度难愈创面上的应用与探讨[J].创伤外科杂志,2010,12(4):371.
[5] M.Abe,Y.Yokoyama,and O.Ishikawa.A possible mechanism of basic fibroblast growth factor-promoted scarless wound healing:the induction of myofibroblast apoptosis [J].Eur J Dermatol,2012,22(1):46-53.
[6] 张兆新,吕 磊,刘小龙,等.重组人表皮生长因子凝胶在慢性难愈性溃疡创面中的应用研究[J].中华临床医师杂志,2011,5(8):2186-2190.
[7] W.Jelkmann and K.Wagner.Beneficial and ominous aspects of the pleiotropic action of erythropoietin [J].Ann Hematol,2004,83(11):673-686.
[8] K.Le Minh,K.Klemm,K.Abshagen,et al.Attenuation of inflammation and apoptosis by pre-and posttreatment of darbepoetin-alpha in acute liver failure of mice [J].Am J Pathol,2007,170(6):1954-1963.
[9] R.Shurtz-Swirski,B.Kristal,S.M.Shasha,et al.Interaction between erythropoietin and peripheral polymorphonuclear leukocytes in continuous ambulatory dialysis patients [J].Nephron,2002,91(4):759-761.
[10] M.Nairz,T.Sonnweber,A.Schroll,et al.The pleiotropic effects of erythropoietin in infection and inflammation [J].Microbes Infect,2012,14(3):238-246.
[11] N.Siebert,W.Xu,E.Grambow,et al.Erythropoietin improves skin wound healing and activates the TGF-beta signaling pathway[J].Lab Invest,2011,91(12):1753-1765.
[12] C.Ferri,D.Giuggioli,A.Manfredi,et al.Recombinant human erythropoietin stimulates vasculogenesis and wound healing in a patient with systemic sclerosis complicated by severe skin ulcers[J].Clin Exp Dermatol,2010,35(8):885-887.

