miR-34在小鼠心脏组织中的表达和功能研究*
陈锡峰,陈 飞,肖 波,2,黄安庆,
(1.苏州大学基础医学与生物科学学院,江苏 苏州215123;2.盐城工学院环境科学与工程学院,江苏 盐城224051)
microRNA(miRNA)是一类约22个碱基组成的非编码RNA,它主要与信使RNA(mRNA)的3′端非翻译区结合,使基因“沉默”,达到调控下游基因的目的[1]。在细胞核内miRNA也是由RNA聚合酶Ⅱ从基因组起始转录的[2],形成约300~1000bp左右的初始转录本,随后经过Drosha酶的切割产生约100bp的miRNA前体[3]。此时由核孔运输蛋白将前体miRNA运输到细胞质中,再经过Dicer酶的切割成为一条约22个碱基对组成的双链。这条双链会被整合到RNA诱导的沉默复合物中(RISC),其中一条链会最终降解,另外一条指引沉默复合物到靶基因的mRNA 3′UTR中行使功能[4]。
心脏组织是机体重要器官,为机体承担着输送血液的重要功能。随着年龄的增长,心脏细胞的纤维化程度会越来越高,心脏组织的供血能力和各项生理指标都会下降,同时各种心脏疾病的发生概率越来越大,如心肌梗死等。所以如何判断心脏的年龄,如何对心脏疾病进行预警或者预防,都需要有一个快速而准确的检测指标,这对临床检测具有重要意义。
哺乳动物miR-34基因经转录及切割后,最终形成 miR-34a、miR-34b、miR-34c三种成熟体 microRNA。有报道称miR-34家族与肿瘤细胞因子p53通路有关,参与肿瘤、癌症调控。并且在果蝇中的研究证明miR-34与果蝇寿命、神经元退化有关[5]。本研究旨在探讨miR-34家族在小鼠心脏细胞中的作用及表达情况,以其作为心脏衰老的一个检测指标。
1 材料和方法
1.1 材料 TRlzol试剂购自ambion公司,反转录试剂购 自 Vazyme公 司,qPCR SYBR GREEN 购自TaKaRa公司,DEPC水购自Sigma公司,琼脂糖凝胶购自上海基因公司,PCR反应管购自Fisher公司,其它试剂均为国产分析纯。C57BL/6小鼠购自斯莱克公司。
1.2 方法
1.2.1 RNA提取 采用TRlzol法提取总RNA。将组织研磨碎加入适量TRlzol(1mg组织/1ml Trizol溶液),然后室温放置,加入1/5体积的氯仿并震荡离心。此时试管中会分三层,用移液器小心将上层清液转移到新试管中。随后加入异丙醇,室温放置10分钟左右再离心。此时将会在试管底部看到白色沉淀,将异丙醇移除,加入70%的用DEPC水稀释的酒精,离心后吸出酒精,将试管放置在通风厨中,将酒精尽量吹干,最后加入DEPC水溶解。
1.2.2 mRNA反转成cDNA 按下列组分别依次加入试剂:RNA 2~4μg,oligo(dT),dNTP,DTT,RNA酶抑制剂,逆转录酶,37℃90分钟。
1.2.3 miRNA的反转 由于microRNA的特殊性,它的成熟体只有大约22个碱基,而且无ploy A尾,无法用普通的反转方式将其反转成cDNA。首先加入ploy A加尾酶,然后用特殊的比较长的下游引物和逆转录酶进行反转(同mRNA反转),保证microRNA反转后的长度在100~200bp左右,使其可以被PCR检测出来。RT-PCR反应程序:95℃2min、95℃30s、60℃30s、72℃30s、72℃8min;4℃保存。
1.2.4 实时荧光定量PCR 反应体系的配制:SYBR GREEN 10μl,正向引物和反向引物各0.4μl,cDNA模板2μl,用双蒸水补齐到20μl。使用Roche公司的荧光定量PCR仪,荧光定量PCR扩增条件的设置:94℃30s、94℃20s、60℃20s,循环40次,60℃单点检测信号。用相对定量的方式检测基因表达量,即目的基因相对于管家基因的量为2-△△Ct。miR-34a的引物序列:正向 TGGCAGTGTCTTAGCTGGTTGT,miR-34b的引物序列:正向AGGCAGTGTCATTAGCTGATTGT,miR-34c的引物序列:正向AGGCAGTGTAGTTAGCTGATTGC。下游引物为试剂盒自带引物,内参基因为 U6:正向CTCGCTTCGGCAGCACA,反向AACGCTTCACGAATTTGCGT。
1.3 统计学处理 实验数据采用SPSS软件进行统计分析,用t检验分析实验结果。P<0.05表示有显著性差异,P<0.001时,表示有极显著差异。
2 结果
2.1 总RNA质量检测 提取组织总RNA后,取1~2μl经琼脂糖凝胶电泳检测,EB染色后可以清楚看到三条带。最上面的两条带清晰而且比较亮,分别是28S、18SRNA,RNA基本没有降解。紫外分光光度计检测OD260/OD280也在1.8左右,说明RNA提取的质量很好,可以进行下游实验,见图1。

图1 心脏总RNA检测Figure 1 Detection of total RNA
2.2 检测microRNA引物特异性 引物的特异性直接关系着后续实验的可靠性。使用miRNA反转的cDNA为模板,分别用miR-34家族的三种引物和通用下游引物检测其特异性。在RT-PCR完成后,用3%的琼脂糖凝胶检测产物。miR-34a、miR-34b、miR-34c三个microRNA的反转录PCR产物都非常单一,说明引物特异性很好,见图2。
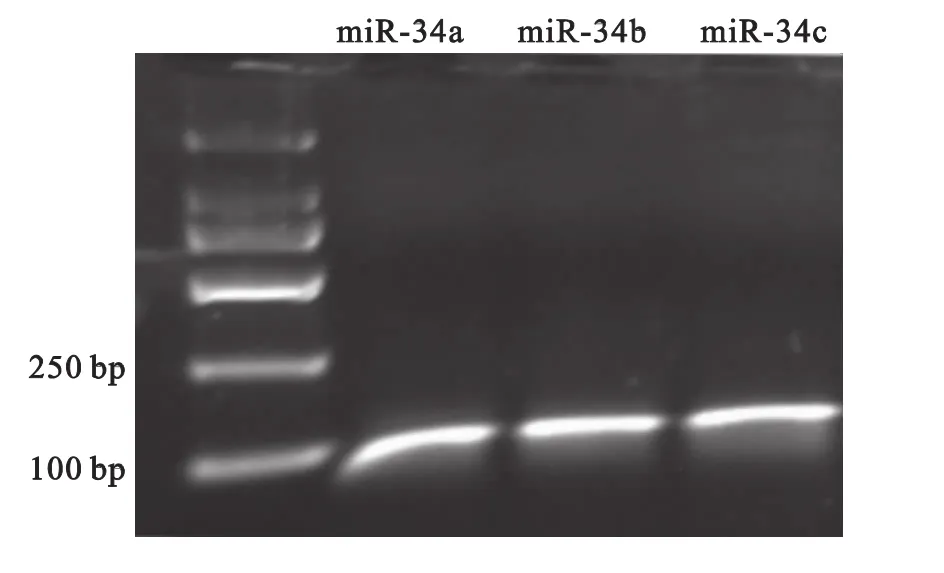
图2 引物特异性检测Figure 2 Specificity of q-PCR primer
2.3 miR-34a表达量高于 miR-34b和 miR-34c 提取老年小鼠心肌细胞对miR-34家族进行定量检测,发现在小鼠中miR-34a的表达量要显著高于miR-34b、miR-34c。说明在心肌细胞中 miR-34a起着更为重要的作用,见图3。

图3 老年小鼠心脏组织中miR-34检测分析Figure 3 Analysis of miR-34in old heart tissue
2.4 miR-34a在老年小鼠心脏中表达量显著高于年轻小鼠 比较年轻小鼠(6周)和老年小鼠(12个月),我们发现miR-34a的表达量在老年小鼠心脏中表达量更高,具有显著性差异。说明miR-34a可能是小鼠心脏功能衰老的一个重要标志,参与到与衰老有关的调节通路,见图4。
2.5 miR-34b与miR-34c在年轻小鼠和老年小鼠中的表达也有差别,但没有miR-34a明显,表明与衰老关系不是特别紧密,见图5。
3 讨论

图4 miR-34a在年轻小鼠和老年小鼠心脏中的表达Figure 4 Expression level of miR-34ain young and old heart

图5 miR-34b与miR-34c在年轻小鼠和老年小鼠中的表达Figure 5 Expression level of miR-34band miR-34cin young and old heart
microRNAs是一类在转录后调控中发挥重要作用的非编码RNA,小鼠体内约有30%的基因受非编码RNA调控[6]。人类基因中有3%编码有microRNAs[7]。部分microRNAs基因在染色体上位于两个独立基因之间,有的位于另一个基因的内含子中,有的甚至在其他基因的外显子中。脊椎动物中microRNAs主要通过成熟体5′端的“种子序列”与靶基因的mRNA 3′UTR区域结合,降解mRNA或者抑制蛋白的翻译,达到调控基因的目的[8,9]。也有研究表明,miRNA通过影响5′端帽子和3′端poly A尾来影响mRNA的稳定性[10]。很多具有重要功能的microRNAs在进化上是非常保守的,尤其是在“种子序列”的6到8个碱基。miR-34就是这样一个家族,这个家族有三个成员:miR-34a、miR-34b和 miR-34c,先前的研究报道它参与p53调节通路,与肿瘤、癌症的发生相关。果蝇中的研究发现miR-34家族有7种剪切形式,这主要是由Nbr酶介导的。在果蝇中敲除Nbr基因会减少miR-34家族的剪切种类,使其只有一种形式产生。这7种剪切形式中,它们的“种子序列”都是一样的,只是3′端有个别碱基不同,其中有三种是主要表达的,这与小鼠中的miR-34家族是一致的。究发现miR-34主要在脑部表达,与果蝇的寿命以及运动爬升能力有关。果蝇 miR-34通过直接调节Eip74EF基因控制衰老过程[11]。
心脏组织是机体血液循环主要器官而心脏的衰老是机体衰老的重要标志,影响巨大。既然果蝇的miR-34可以调控机体衰老,那么对哺乳动物最重要的器官又是什么影响仍有待探索。本研究主要探讨miR-34家族在心脏组织中的表达情况。由于 microRNAs的特殊性,通过加尾法反转成cDNA,同时确认了三种不同引物的特异性。首先在小鼠心脏组织中分析了家族三个成员的表达趋势,发现在这其中,miR-34a的表达量要显著高于 miR-34b和 miR-34c,提示miR-34a的功能可能更重要些。为了证明在小鼠心脏中miR-34是否也和在果蝇中一致,具有调节衰老的作用,分别检测了年轻小鼠和老年小鼠miR-34a的表达情况,发现miR-34a表达量在老年小鼠心脏中显著高于年轻小鼠,约有2.5倍,而miR-34b在老年小鼠心脏中也有部分上调但是没有miR-34a那么明显,甚至miR-34c在老年小鼠中有部分下调,提示我们miR-34a在这个家族中与心脏衰老关系最紧密。
4 结论
miR-34a是miR-34家族的主要表达形式,同时在老年小鼠心脏中表达更高,可将miR-34a作为心脏衰老的标志,也可作为诊断心脏功能的重要指标。
[1] Ambros,V.Bartel,B.Bartel,D.P,et al.A uniform system for microRNA annotation[J].RNA,2003,9(3):277-279.
[2] Lee,Y.Kim,M.Han,J,et al.MicroRNA genes are transcribed by RNA polymerase II [J].Embo Journal,2004,23(20):4051-4060.
[3] Denli,A.M.Tops,B.B.Plasterk,R.H,et al.Processing of primary microRNAs by the Microprocessor complex [J].Nature,2004,432(7014):231-235.
[4] Bernstein,E.Caudy,A.A.Hammond,S.M,et al.Role for a bidentate ribonuclease in the initiation step of RNA interference[J].Nature,2001,409(6818):363-366.
[5] Nan Liu,Michael Landreh,Kajia Cao,et al.The microRNA miR-34modulates aging and neurodegeneration in Drosophila [J].Nature,2012,482(7386):519-523.
[6] Reddy,A.B.Karp,N.A.Maywood,E.S,et al.Circadian orchestration of the hepatic proteome[J].Curr Biol,2006,16(11):1107-115.
[7] 曹学武,张海萍,陈正堂.Anti-miR-155反义寡核苷酸对A549细胞 Weel表达的影响[J].西部医学,2013,25(9):1298-1303.
[8] Lewis,B.P.Prediction of mammalian microRNA targets[J].Cell,2003,115(7):787-798.
[9] Farh,K.K.The widespread impact of mammalian MicroRNAs on mRNA repression and evolution [J].Science,2005,310(5755):1817-1821.
[10] Zeng,L.Carter,A.D.Childs,S.J.miR-145directs intestinal maturation in zebrafish [J].Proc Natl Acad Sci U S A,2009,106(42):17793-1798.
[11] Liu,N.Abe,M.Sabin,L.R.The exoribonuclease Nibbler controls 3'end processing of microRNAs in Drosophila[J].Curr Biol,2006,22(21):1888-1193.

