酒酒球菌在青梅汁中的生长及苹果酸乳酸发酵特性的研究
何翠婵,熊 犍,叶 君,林伟锋,陈 中
(华南理工大学轻工与食品学院,广东广州510640)
酒酒球菌在青梅汁中的生长及苹果酸乳酸发酵特性的研究
何翠婵,熊 犍,叶 君,林伟锋*,陈 中
(华南理工大学轻工与食品学院,广东广州510640)
以青梅汁为原料,利用酒酒球菌的苹果酸-乳酸发酵(MLF)对青梅汁进行生物降酸的研究。结果表明:接种量为2.0×108CFU/mL,青梅汁的pH≥3.4时,MLF能正常进行,并使样品的酸度降低61.35%以上;接种量为2.6×107CFU/mL时,青梅汁的pH为3.6才能触发MLF,样品的酸度降低了77.60%;接种量为2.3×108CFU/mL,在pH3.6和4.0的青梅汁中,添加1.0g/100g的葡萄糖的样品,与不添加葡萄糖的样品相比,其酸度分别降低了27.04%和34.63%;在柠檬酸-柠檬酸钠缓冲体系中,酒酒球菌使体系酸度降低了26.40%,证实酒酒球菌可利用柠檬酸作为碳源,进行MLF。
青梅,酒酒球菌,苹果酸乳酸发酵,降酸
苹果酸-乳酸发酵(malolactic fermentation,MLF)是葡萄酒生产尤其是优质干红葡萄酒酿造的一种主要生物降酸方法。它是指L-苹果酸在乳酸菌的作用下发生脱羧反应,生成L-乳酸并释放出CO2的过程,二元酸转变成一元酸,从而降低酒的酸度,也称为二次发酵或次级发酵[1-3]。自然条件能够引发MLF的四个乳酸菌种属是酒球菌属(Oenococcus)、片球菌属(Pediococcus)、明串珠菌属(Leuconostoc)和乳杆菌属(Lactobacillus)[4]。其中,酒球菌属的酒酒球菌对酒精和低pH具有较高的耐受性,是自然诱发MLF的主要启动者和完成者,也是目前最主要的商业MLF发酵剂[4-6]。通过酒酒球菌的MLF,可以降低果酒的酸涩和粗糙感,使之柔和、圆润,同时MLF的代谢产物如乙偶姻、双乙酰、2,3-丁二醇等能改善口味,增加香气,提高葡萄酒的生物稳定性和品质[4,7-8]。
青梅含有多种天然有机酸,包括柠檬酸、苹果酸、琥珀酸、酒石酸等[9-10]。目前,对青梅汁降酸的研究仅限于化学降酸法[11-12],该方法降酸效果显著,但会影响酒体的口感、色泽以及带来失光、混浊等不稳定现象[13]。关于应用生物降酸法对青梅汁进行降酸的研究还未见报道。
本文将酒酒球菌应用于青梅汁中,研究了接种量、葡萄糖含量及青梅汁的初始pH对其降酸的影响及其在青梅汁中的消长规律,为青梅汁生物降酸的实践提供理论依据。
1 材料与方法
1.1 材料与仪器
青梅汁 由青梅果肉与水按料液比1∶1混合打浆制备,pH为2.9,总酸含量为1.91g/100g;酒酒球菌6066(Oenococcus oeni) 中国工业微生物菌种保藏管理中心;NaHCO3食品级,市售;NaOH 国药集团化学试剂有限公司;柠檬酸-柠檬酸钠缓冲液0.10mol/L,pH为3.6;其他试剂 均为分析纯;活化培养基 胰蛋白栋20.0g,蛋白栋5.0g,酵母膏5.0g,葡萄糖5.0g,吐温80 0.05g,番茄汁250.0mL,蒸馏水750.0mL,pH5.5,1.05kg/cm2灭菌15min,配制固体培养基时添加琼脂20.0g。
pHS-25数显pH计 上海精密科学仪器有限公司;SW-CJ-ECU超净工作台 苏州净化设备有限公司;YX-280D灭菌锅 合肥华泰医疗设备有限公司;GHP-9270隔水式培养箱 上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 种子液的制备 在液体培养基中,按质量分数接入10%的菌种,于25℃下活化培养3d,按平板菌落计数法测得其活菌数约为2×109CFU/mL,备用。
1.2.2 工艺流程 青梅汁→调节pH(1.0mol/L NaHCO3溶液)→灭菌(121℃,20min)→冷却→接种→发酵(发酵温度25℃)→产品。
1.2.3 实验设计
1.2.3.1 pH对MLF的影响 用NaHCO3溶液调整青梅汁的初始pH为2.9、3.2、3.4、3.6、3.8、4.0进行发酵,接种量为2.0×108CFU/mL。每隔一定时间取样检测菌量,测定pH和总酸,以青梅汁的酸度降到最低值为发酵终点。
1.2.3.2 接种量对MLF的影响 将青梅汁(pH3.6)在2.6×107、2.6×108、7.8×108CFU/mL的接种量条件下进行发酵。每隔一定时间取样检测菌量,测定pH和总酸,以青梅汁的酸度降到最低值为发酵终点。
1.2.3.3 葡萄糖含量对MLF的影响 在青梅汁(pH3.6和pH4.0)中,分别添加0、1.0g/100g的葡萄糖进行发酵,接种量为2.3×108CFU/mL。每隔一定时间取样检测菌量,测定pH和总酸,以青梅汁的酸度降到最低值为发酵终点。
1.2.3.4 柠檬酸缓冲液对MLF的影响 将青梅汁和柠檬酸缓冲液(pH3.6)在接种量为2.6×108CFU/mL的条件下进行发酵。每隔一定时间取样检测菌量,测定pH和总酸,以青梅汁的酸度降到最低值为发酵终点。
1.2.3 测定方法 总酸:采用GB/T 15038-2006电位滴定法(以苹果酸计);活菌数的测定:采用GB/T 4789.35平板菌落计数法。
1.2.4 降酸率 降酸率(%)=(发酵前果汁酸度-发酵后果汁酸度)/发酵前果汁酸度×100。
2 结果与讨论
2.1 pH对酒酒球菌在青梅汁中的生长及MLF的影响
由图1可知,样品酸度的降低幅度及速率与样品的初始pH有关,pH越大,MLF的降酸速率越快;当样品的初始pH≤3.2时,酒酒球菌难以发生MLF;当pH≥3.4时,菌体能正常触发MLF;当样品的初始pH在3.4~4.0的范围内,其酸度的降低幅度没有明显的差异,分别为0.98、1.01、0.97、0.94g/100g(p<0.05),相应的降酸率为61.35%、69.64%、75.53%、78.80%。
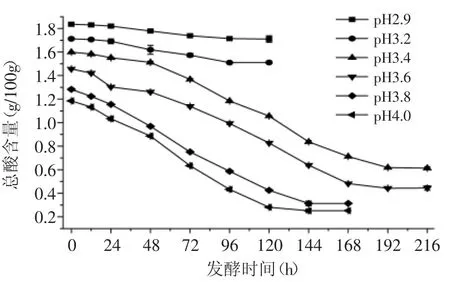
图1 pH对酒酒球菌降酸的影响Fig.1 Influence of pH on the deacidification of Oenococcus oeni
由图2可知,样品初始pH的高低直接影响着菌体细胞的生长,当样品的pH低于3.2时,菌体细胞的生物量随发酵时间的增加呈下降的趋势;而当样品的pH高于3.4时,菌体细胞的生物量随发酵时间的增加呈先上升后下降的趋势,且总体来看,pH越大时,菌体的存活率越高。
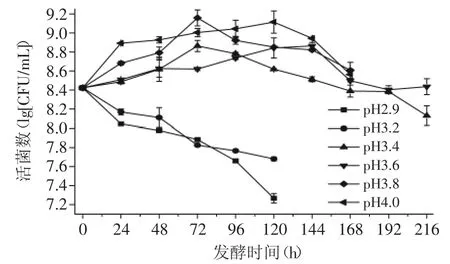
图2 pH对酒酒球菌生长的影响Fig.2 Influence of pH on the growth of Oenococcus oeni
综上所述,当样品的pH≤3.2时,会抑制菌体细胞的生长繁殖,难以发生MLF。因此,为了保证MLF的正常进行,应适当调整样品的初始pH,使之达到3.4以上。
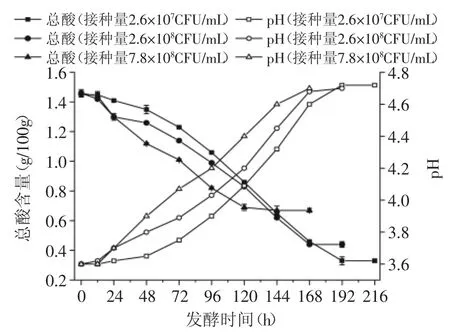
图3 接种量对酒酒球菌降酸的影响Fig.3 Influence of inoculation amount on the deacidification of Oenococcus oeni
2.2 接种量对酒酒球菌在青梅汁中的生长及MLF的影响
由图3可知,添加不同接种量的青梅汁,在MLF过程中,其pH呈上升趋势,而酸度呈快速下降的趋势;接种量越大,发酵速率越快,发酵周期越短,但样品的最终降酸幅度越低。接种量为2.6×107CFU/mL的样品,在0~48h内,菌体降酸速率缓慢;48~192h里,样品的降酸速率最快;发酵结束后,青梅汁的酸度下降了1.13g/100g,降酸率为77.60%,pH上升了1.1个单位。而接种量为2.6×108CFU/mL的样品,其酸度下降了1.02g/100g,降酸率为70.05%。
如图4所示,青梅汁中的菌体生物量总体呈先上升后下降的趋势,发酵结束后,菌体数量总体维持在2×108CFU/mL中;在发酵前期,接种量越小,菌体细胞增长的速率越快;在发酵后期,接种量越大,菌体细胞的死亡率越大。这是因为接种量越大,单位体积内菌体生物量越多,青梅汁中的营养物质不足于维持菌体细胞生长繁殖的需要,从而导致菌体细胞大量死亡。
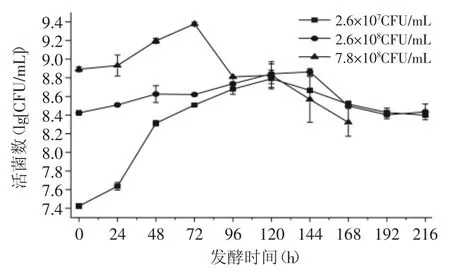
图4 接种量对酒酒球菌生长的影响Fig.4 Influence of inoculation amount on the growth of Oenococcus oeni
综上所述,接种量直接影响着酒酒球菌的降酸幅度及其在青梅汁中的生长繁殖。接种量越大,对青梅汁的降酸效果具有抑制作用。因此,在青梅汁中,以2.6×107CFU/mL的菌体生物量接入酒酒球菌后,能发生MLF,从而对青梅汁进行生物降酸。
2.3 葡萄糖含量对酒酒球菌在青梅汁中的生长及MLF的影响
由图5可知,在相同pH的青梅汁体系中,在发酵的前48h里,样品的降酸速率几乎是一致的,这是因为MLF先进行苹果酸代谢,其代谢的速率与样品的含糖量无关;但在发酵的后期,不添加葡萄糖的样品,酒酒球菌的MLF速率及降酸幅度明显高于添加了1.0g/100g葡萄糖的样品。而在不同pH的青梅汁体系(pH3.6和4.0)中,发酵结束后,不添加葡萄糖的样品,其酸度分别降低了0.95、0.99g/100g,而添加了1.0g/100g葡萄糖的样品,其酸度仅降低了0.56、0.57g/100g,降酸率分别下降了27.04%和34.63%。
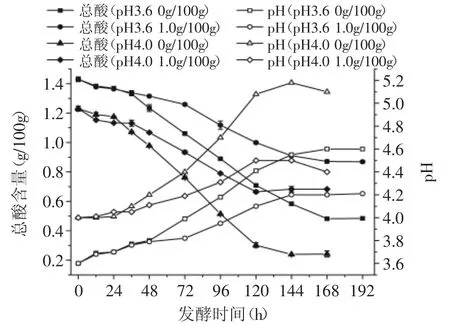
图5 葡萄糖含量对酒酒球菌降酸的影响Fig.5 Influence of glucose content on the deacidification of Oenococcus oeni
由图6可知,在所有青梅汁体系中,随着发酵时间的增加,菌体生物量均呈先上升后下降的趋势,发酵后期,菌体死亡速率明显加快,这与菌体自溶有关;pH相同时,菌体在添加了葡萄糖的青梅汁体系中,其生长趋势明显加快,这是因为菌体有足够可利用的碳源,对其生长繁殖有促进作用。
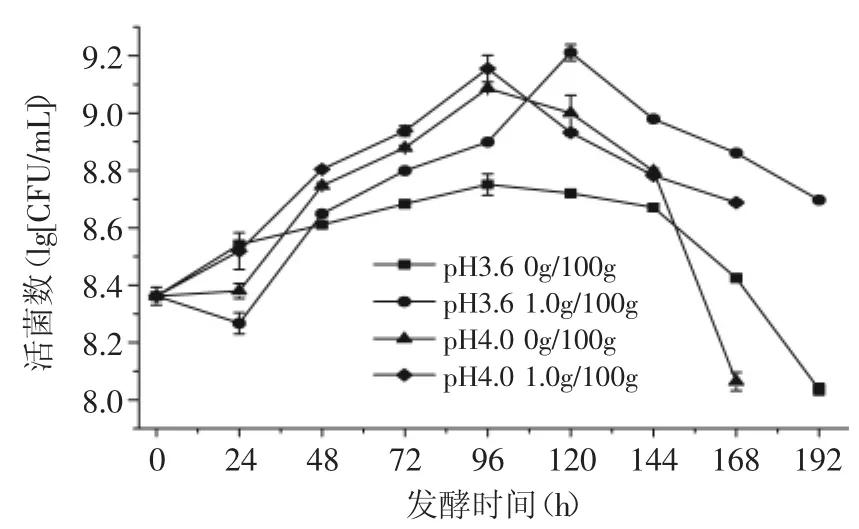
图6 葡萄糖含量对酒酒球菌生长的影响Fig.6 Influence of glucose content on the growth of Oenococcus oeni
综上所述,在青梅汁中添加1.0g/100g的葡萄糖,对酒酒球菌的生长具有促进作用,但会抑制MLF的进行,影响降酸效果。这有两个方面的原因,一是酒酒球菌在葡萄糖含量较高的青梅汁中先进行葡萄糖代谢,再进行柠檬酸代谢;其次,酒酒球菌葡萄糖代谢的代谢产物抑制了有机酸代谢的进程。
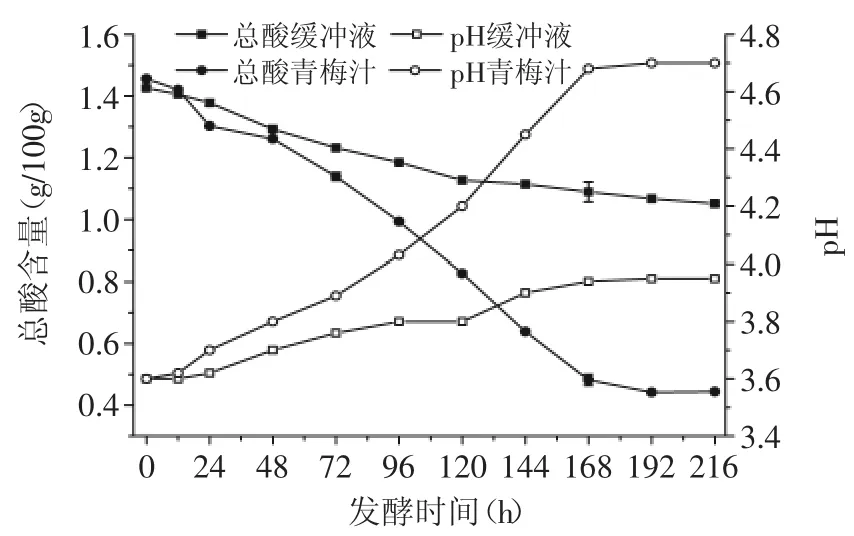
图7 酒酒球菌在缓冲液和青梅汁中的降酸效果Fig.7 Effect of deacidification on the buffer solution and plum juice by Oenococcus oeni
2.4 酒酒球菌在青梅汁和柠檬酸缓冲液中的生长及MLF的作用
由图7可知,酒酒球菌在柠檬酸-柠檬酸钠缓冲液和青梅汁中,均能发生MLF,但在柠檬酸-柠檬酸钠缓冲液,酒酒球菌降酸的速率较慢,降酸幅度小。发酵192h后,青梅汁的酸度已降到最低值,为0.44g/100g,降低了1.01g/100g,降酸率达到了69.64%,pH上升了1.1个单位;而缓冲液的酸度还在缓慢的下降,发酵结束后,其总酸含量由初始的1.43g/100g降低到了1.05g/100g,降酸率为26.40%,pH上升了0.3个单位。
由图8可知,在柠檬酸-柠檬酸钠缓冲体系中,酒酒球菌的菌体生物量随发酵时间的增加呈下降的趋势,发酵结束后,细菌的存活率为4.11%;这是因为缓冲体系中缺乏菌体生长繁殖所必需的营养物质,从而导致菌体的大量死亡。而在青梅汁中,菌体生物量随发酵时间的增加先呈缓慢增加再呈缓慢下降的趋势,其总体维持在2×108~7×108CFU/mL中。
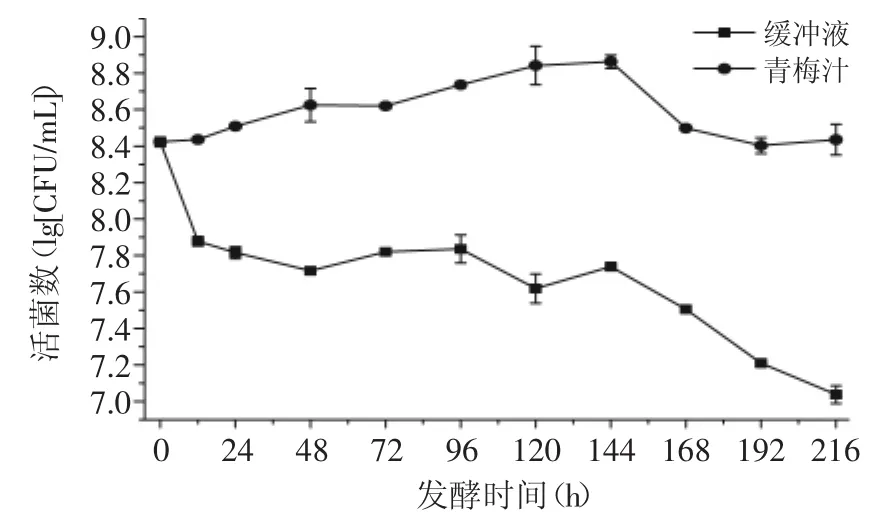
图8 酒酒球菌在缓冲液及青梅汁中的生长状况Fig.8 The growth of Oenococcus oeni in the buffer solution and plum juice
综上所述,酒酒球菌能单独利用柠檬酸作为碳源,从而启动MLF。与单一的柠檬酸-柠檬酸钠缓冲体系相比,酒酒球菌在复杂的青梅汁体系中的降酸速率快,降酸幅度大;这是因为青梅汁的营养成分能满足菌体的生长繁殖,当菌体达到一定的生物量时,才能发生MLF,从而起到降酸的作用。
3 结论
本实验考察了酒酒球菌的接种量、葡萄糖、pH对青梅汁生物降酸的影响。在本实验条件下,得出的结论如下:
3.1 酒酒球菌的接种量为2.0×108CFU/mL时,青梅汁的初始pH≤3.2,酒酒球菌不能引发MLF,而当其pH≥3.4时,菌体均可引发MLF。
3.2 pH为3.6时,酒酒球菌的接种量为2.6×107CFU/mL,能引发MLF,青梅汁的降酸率达到77.60%。
3.3 酒酒球菌接种量为2.3×108CFU/mL,在pH为3.6和4.0的青梅汁中,分别添加1.0g/100g的葡萄糖,会抑制体系MLF的进行。
3.4 在柠檬酸-柠檬酸钠缓冲体系中,酒酒球菌能大幅度降低体系的酸度,说明其可利用柠檬酸作为碳源,进行MLF。
[1]Maret du Toit,Lynn Engelbrecht,Elda Lerm,et al. Lactobacillus:the Next Generation of Malolactic Fermentation Starter Cultures-an Overview[J].Food Bioprocess Technol,2011(4):876-906.
[2]Matthews A,Grimaldi A,Walker M,et al.Lactic acid bacteria as a potential source of enzymes for use in vinification[J]. Applied and Environmental Microbiology,2004,70:5715-5731.
[3]Lonvaud-Funel A.Lactic acid bacteria in the quality improvement and depreciation of wine[J].Antonie van Leeuwenhoek,1999,76:317-331.
[4]Dickslm,Dellagliof,Collnsmd.Proposalto reclassify Leuconostoc oenos as Oenococcus oeni[corrig].gen.Nov.comb. Nov[J].International Journal of Systematic Bacteriology,1995,45(2):395-397.
[5]孙丙升,夏广丽,张谦搏,等.利用微生物进行葡萄酒降酸的研究进展[J].中外葡萄与葡萄酒,2010(11):72-76.
[6]Ruiz P,Izquierdo P M,Seseña S,et al.Intraspcific genetic diversity of lactic acid bacteria from malolactic fermentation of Cencibel wines as derived from combined analysis of RAPDPCR and PFGE pattern[J].Food Microbiology,2008,25:942-948.
[7]张浩,莫海珍.葡萄酒苹果酸-乳酸发酵细菌生理特性研究进展[J].安徽农业科学,2006,34(17):4213-4215,4218.
[8]Drici-Cachon A,Guzzo J,Cavin F,et al.Acid tolerance in Leuconostoc oenos.Isolation and characterisation of an acid resistant mutant[J].Applied Microbiology and Biotechnology,1996,44:785-789.
[9]肖更生,陈卫东,李升锋,等.青梅的研究进展[J].食品工业科技,2005,26(1):185-187.
[10]翟焕趁,史怀,宋亚娜,等.反相HPLC法同时测定青梅中的7种有机酸[J].福建农林学报,2007,22(4):414-417.
[11]郭正忠,寇兆民,葛芳.“十二岭”青梅酒的研制[J].酿酒科技,2010(2):101-103.
[12]赵文红,钱敏,白卫东.发酵青梅酒的研制[J].中国酿造,2009(1):164-166.
[13]文连奎,赵薇,张微,等.果酒降酸技术研究进展[J].食品科学,2010,31(11):325-328.
Study on growth and malolactic fermentation characteristics of Oenococcus oeni in plum juice
HE Cui-chan,XIONG Jian,YE Jun,LIN Wei-feng*,CHEN Zhong
(College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,China)
Plum juice was used as material and Oenococcus oeni was used as strain for malolactic fermentation(MLF)to reduce acids in juice.The results were as follows:when the inoculation amount was 2.0×108CFU/mL,the pH was equal or greater than 3.4,the MLF proceeded normally and the acidity of plum juice was reduced by more than 61.35%.When the inoculation amount was 2.6×107CFU/mL and the pH was 3.6,the MLF could perform and the acidity of plum juice was reduced by 77.60%.When the inoculation amount was 2.3×108CFU/mL and the pH were 3.6 and 4.0,compared with the sample without adding glucose,the acidity of plum juice reduced by 27.04%and 34.63%respectively with 1.0g/100g glucose.In sodium citrates buffer system,the acidity reduced by 26.40%,it was proved that Oenococcus oeni could use citric acid as carbon resource to run of MLF.
plum;Oenococcus oeni;MLF;deacidification
TS201.3
A
1002-0306(2014)06-0177-04
2013-07-22 *通讯联系人
何翠婵(1987-),女,硕士研究生,研究方向:粮食、油脂及植物蛋白工程。
广东省教育部产学研结合项目(2011B090400311)。

