响应面分析法优化紫茄皮花色苷的提取工艺
郭 菲,刘 继,黄 彭,刘东杰,熊亚波,秦 文
(四川农业大学食品学院,四川雅安 625014)
响应面分析法优化紫茄皮花色苷的提取工艺
郭 菲,刘 继,黄 彭,刘东杰,熊亚波,秦 文*
(四川农业大学食品学院,四川雅安 625014)
以紫茄皮为研究对象,利用有机溶剂提取花色苷,并以花色苷提取液的吸光值作为提取效果指标,采用响应面分析法优化紫茄皮花色苷的提取条件。在单因素实验的基础上,选取提取温度(℃)、液料比(mL/g)、提取时间作为自变量,A525V/m(V:提取剂用量,m:样品质量)作为响应值,利用Box-Behnken中心组合设计原理和响应面分析法,研究各自变量及其交互作用对花色苷提取效果的影响,在提取剂为70%乙醇(含0.05%盐酸,V/V)的条件下,确定最佳提取条件为提取温度38℃、液料比19∶1mL/g、提取时间95min。在此工艺条件下,花色苷提取效果A525为12.752,与理论预测值12.876相差0.124。说明通过响应面优化后得出的方程具有一定的实践指导意义。
紫茄皮,花色苷,提取,响应面分析法
茄子(eggplant),学名(SolanummelongenaL.),也叫落苏、昆仑瓜,是茄科(Solanaceae)茄属茄种的一年生草本植物,热带为多年生。茄子最早产于印度,公元4~5世纪传入中国,全国大部地区有栽培[1]。花青素(Anthocyanidin)类为2-苯基苯并吡喃阳离子衍生物,属类黄酮物质的一种,结构中有多个酚羟基或酚羟基与烷基或糖基而形成的醚或苷,当分子中有糖基时称为花色苷[2]。花青素在自然界分布广泛,是植物的主要水溶性色素之一。初步统计就有27个科72个属的植物都含花青素[3]。人们试图从各种动植物资源中获取天然色素,同时探索其生理活性,来缓解并解决由合成色素所带来的各种问题,因此天然色素具有广泛的应用潜力[4]。国内外学者对花色苷的功能已有相关报道,在保健食品应用中,这一类植物色素具有抗氧化[5-7]、降低血脂[8]、增强人体免疫机能[9]等作用。目前,对紫茄皮花色苷的提取方法主要有有机溶剂提取法[10]、微波法[11]、超声波法[12]和超临界CO2萃取[13]等方法。在有些研究中,对比了溶剂法和超声波提取法,由于超声波的作用,使得提取液粘度增大,从而效果不理想。可见,溶剂法要比超声波法提取效果好[14-15]。而超临界萃取法的设备和操作复杂,不主张作为主要的提取方法,所以在本实验中采用有机溶剂来提取紫茄皮中的花色苷。在国内目前在食用茄子时多将茄子皮丢弃[16],这不仅造成了资源浪费也给环境造成负担。本实验利用有机溶剂对紫茄皮中的花色苷提取进行研究,在单因素实验基础上通过响应面法来优化紫茄皮中花色苷最佳提取工艺条件,为今后的紫茄皮的综合开发利用提供了可行性依据,为使用天然色素提供了基础研究资料。
1 材料与方法
1.1 材料与仪器
紫茄 购于蔬菜批发市场;乙醇、盐酸 均为分析纯。
DHG-9245A型电热恒温鼓风干燥箱 上海一恒科技有限公司;V-3200型紫外可见分光光度计 上海尤尼柯仪器有限公司;BS210S型电子天平 塞多利斯北京天平有限公司;PHS-3C型酸度计 上海雷磁公司;W80高速万能粉碎机 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 紫茄皮预处理 将紫茄洗净,均匀削皮,烘箱30℃烘24h,粉碎,过40目标准筛,棕色瓶冷藏保存。
1.2.2 紫茄皮花色苷的提取 以70%乙醇(含0.05%盐酸,V/V)为提取剂,40℃浸提90min,抽滤过后取上清液,40℃真空浓缩回收乙醇,得到花色苷浓缩液。
1.2.3 紫茄皮花色苷可见光最大吸收波长的确定 取适量浓缩液用pH3.0柠檬酸-磷酸二氢钠缓冲溶液稀释,稳定1h,200~700nm全波长扫描,绘制光谱图,并与文献[17-18]中花色苷光谱进行比较,同时确定可见光区最大吸收波长。
1.2.4 花色苷的测定 本实验采用单pH测定法[19]。将待测花色苷溶液的溶剂用缓冲溶液替换,把pH调节至3.0,再采用分光光度法,根据朗伯-比尔定律,即A=εbc,其中:ε为摩尔吸收系数,是吸光系数在给定的波长和溶剂下的特征常数,所以在一定温度和介质条件下,ε为定值,b=1.0cm。因此在一定范围内A与花色苷的浓度成正比。本实验部分以吸光度Aλmax作为实验指标,衡量提取花色苷的提取效果。
1.2.5 提取工艺参数的确定
1.2.5.1 提取剂浓度的确定 以不同浓度乙醇(含0.05%盐酸)为提取剂,其浓度分别为20%、30%、40%、50%、60%、70%、80%和90%。提取温度40℃,液料比20∶1,提取时间90min,最后测定A525。
1.2.5.2 提取剂pH的确定 依据1.2.5.1研究基础,选取70%乙醇为提取剂,用5%盐酸和5%氢氧化钠溶液调节pH分别为1、2、3、4、5、6。提取温度40℃,液料比20∶1,提取时间90min,最后测定A525。
1.2.5.3 单因素实验 a.提取温度的确定:准确称取紫茄皮1.00g置于50mL三角瓶中,液料比为20∶1,封口浸提,遮光,浸提温度为30、40、50、60、70、80℃,时间为90min,测定A525。
b.液料比的确定:准确称取紫茄皮1.00g置于50mL三角瓶中,液料比为15∶1、20∶1、25∶1、30∶1、35∶1、40∶1,封口浸提,遮光,浸提温度40℃,时间为90min,测定A525V/m。其中V为提取剂用量(mL),m为样品量(g)。在提取的过程中,由于液料比不同则提取剂的体积不同,即不同的稀释比例会有不同的测定值。在单因素的提取温度和时间的实验中液料比为定值,不存在提取剂造成的体积差距而影响测定值,所以在料液比的实验和响应面分析实验中以A525V/m来表示提取效果[20]。
c.提取时间的确定:准确称取紫茄皮1.00g于50mL三角瓶中,液料比为20∶1,封口浸提,遮光,浸提温度为40℃,时间为30、60、90、120、150、180min,测定A525。
1.2.6 紫茄皮花色苷提取响应面实验 在提取温度、液料比、提取时间3个单因素实验基础上,把单因素定为自变量,A525V/m定为花色苷提取效果指标,设计三因素三水平17个实验点的响应面实验对紫茄皮花色苷提取工艺条件进行优化,因素水平见表1。
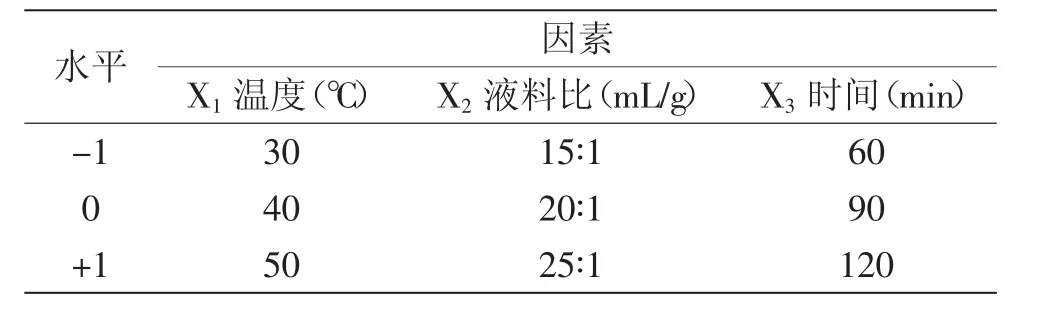
表1 响应面分析因子与水平表Table 1 Independent variables and their coded and actual values used for optimization
2 结果与分析
2.1 紫茄皮花色苷的紫外-可见扫描光谱分析
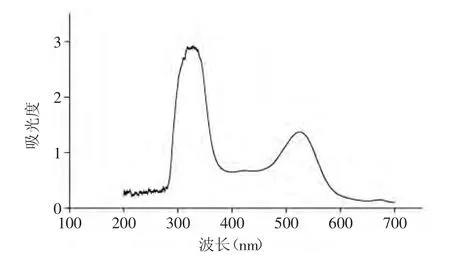
图1 紫茄皮花色苷紫外-可见扫描光谱图Fig.1 UV-visible scanning spectrum of purple eggplant-peel anthocyanins
由图1可知,紫茄皮花色苷有2个明显的吸收峰,分别出现在320~340nm,52~530nm。其中320nm~340nm为有机酸类物质羧基的特征吸收峰,520~530nm为花色苷类物质特征吸收峰[21]。由图1可知,在525nm出现可见光范围内的最大吸收波长,并且紫茄皮色素为花色苷类色素,因此选择525nm作为实验的检验波长。
2.2 提取工艺参数结果
2.2.1 乙醇浓度对提取效果的影响 由图2可知,在乙醇浓度为20%~70%时随着乙醇浓度的增加提取量逐渐上升,在70%时达到最大值,吸光度为0.95,在乙醇浓度为70%~90%范围内随着乙醇浓度的增加提取量逐渐降低,这主要是随着乙醇浓度的增加导致溶液极性的改变使提取液中杂质的含量增加,因此选择70%的酸化乙醇作为提取剂。
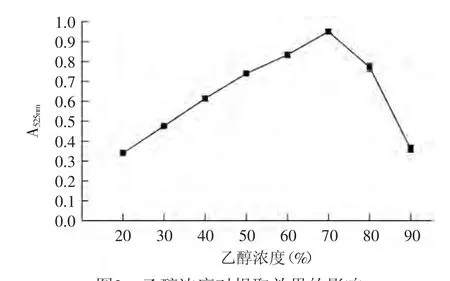
图2 乙醇浓度对提取效果的影响Fig.2 Effect of alcohol concentrations on the extraction efficiency
2.2.2 pH对提取效果的影响 从表2可知,提取剂pH对色素提取效果有明显影响,在pH1~3时,紫茄皮花色苷的提取量较高。因pH1.0强酸性条件下,加热并长时间提取时,容易发生花色苷部分水解[22],所以选取提取剂pH3.0为最佳。经测定,70%乙醇(含0.05%盐酸)pH=2.86~2.98,故后续实验采用70%(含0.05%盐酸)作为提取剂。
2.2.3 单因素实验结果与分析
2.2.3.1 温度对紫茄皮花色苷提取效果的影响 液料比为20∶1,以70%(含0.05%盐酸)乙醇作为提取剂,在不同温度下提取90min。各条件3次重复。如图3所示,在30~40℃范围内,花色苷提取效果随着温度的升高而上升,温度升高增加了溶剂分子和活性物质分子的动能,加速了分子运动进而促进扩散作用,在40℃时吸光度达到最大值1.0185,提取效果最好。在50~80℃范围内,花色苷提取效果随温度的升高而下降,80℃时提取效果最差,吸光值只有0.74。说明提取温度不能过高,过高的温度会导致花色苷降解。因此提取温度应控制在40℃。本研究符合花色苷热降解动力学理论[23]。
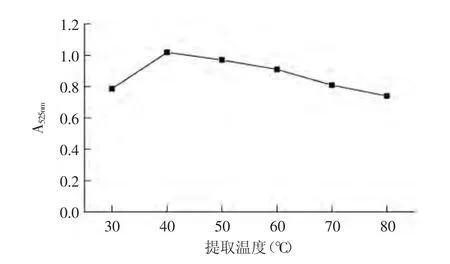
图3 温度对提取效果的影响Fig.3 Effect of temperature affect on the extraction efficiency
2.2.3.2 液料比对紫茄皮花色苷提取效果的影响 温度40℃,以70%(含0.05%盐酸)乙醇作为提取剂,在不同的液料比下提取90min。各条件3次重复。如图4所示,在乙醇浓度、温度、时间一定的情况下,液料比为15∶1~20∶1时,花色苷的提取效果呈上升趋势,在液料比为20∶1时A525V/m最大为22.466。随着液料比的增大提取效果变小,当液料比在30∶1后,提取效果的变化较小,这主要是因为对于固定原料的量随着提取剂量的增加,溶质能逐渐充分溶于提取剂中,所以A525V/m变化不大。因此选择固定液料比在20∶1进行下实验。
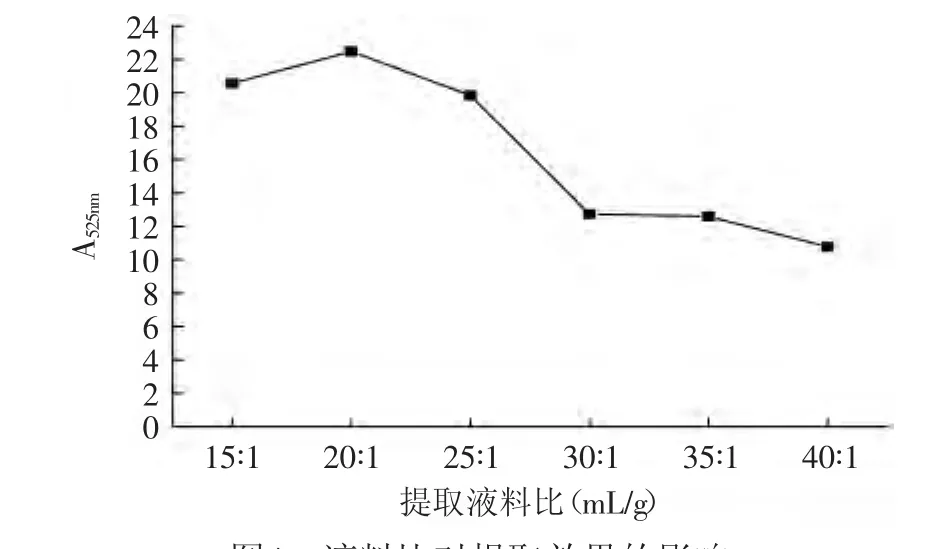
图4 液料比对提取效果的影响Fig.4 Effect of liquid-solid ratio on the extraction efficiency
2.2.3.3 提取时间对紫茄皮花色苷提取效果的影响
液料比20∶1,温度为40℃,以70%(含0.05%盐酸)乙醇作为提取剂,设定不同的提取时间。各条件3次重复。如图5所示,乙醇浓度、提取温度和液料比一定时,随着提取时间的延长,花色苷的提取效果先升高,在90min时提取效果最好,吸光值达到0.752。当提取时间超过90min后,提取效果呈下降趋势。分析原因可能是在90min以前,随着时间的延长,花色苷的积累越来越多,但超过90min,长时间的高温破坏了花色苷的结构,花色苷发生热降解,加之光照及氧化作用,导致花色苷稳定性下降[24],故不宜在加热情况下长时间提取。因此提取时间应该控制在90min。
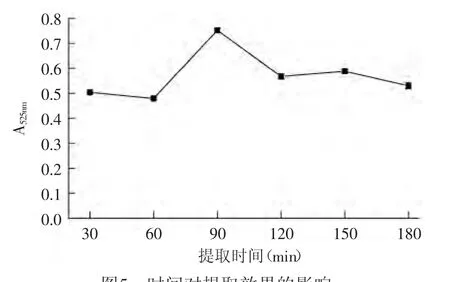
图5 时间对提取效果的影响Fig.5 Time affect on the extraction efficiency

表2 pH对提取效果的影响Table 2 Effect of solvent pH on extraction yield(20∶1,40℃,90min)
2.3 响应面法优化提取工艺结果分析
2.3.1 响应面实验设计及结果 根据Box-Behnken的中心组合实验设计原理,总结单因素实验结果,选取液料比、提取时间、提取温度对花色苷提取影响显著的3个因素,采用Design Expert 8.0.6设计软件设计响应面实验,分别用X1、X2、X3来表示提取温度、液料比、提取时间,并以-1、0、+1分别代表变量的水平,实验设计及结果见表3。
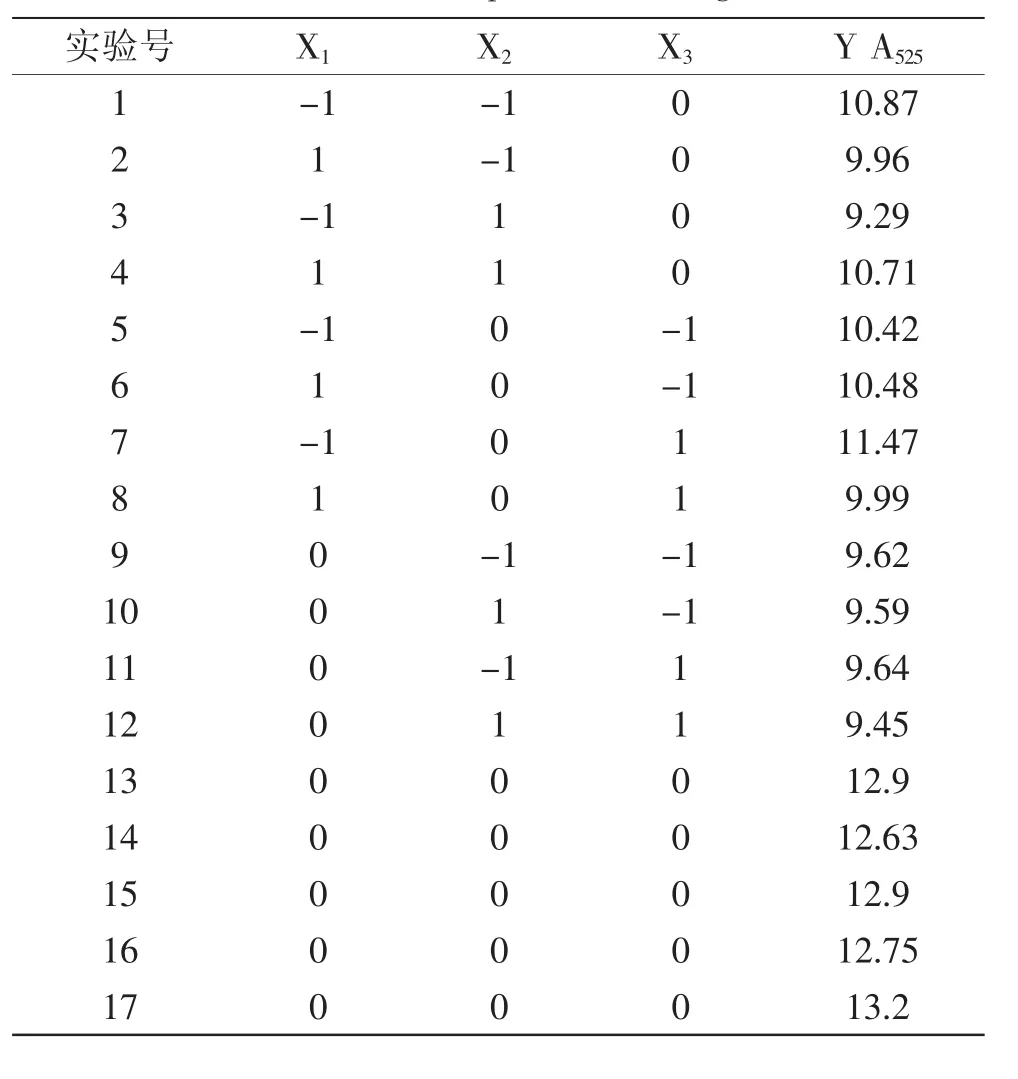
表3 Box-Behnken响应面实验设计及结果Table 3 Box-Behnken experimental design and result
2.3.2 响应面法实验数据处理及数值分析 为了研究不同条件对紫茄皮花色苷制备的影响和确定最佳制备条件,在单因素实验基础上进行响应面曲面分析实验,在17个实验点中有1~12是析因点,13~17是零点,也就是区域的中心点,利用这5个点可以估计整个实验误差。以A525V/m为响应值,通过响应面分析法分析后,得到各实验因子对响应值的影响的二阶多项式方程:
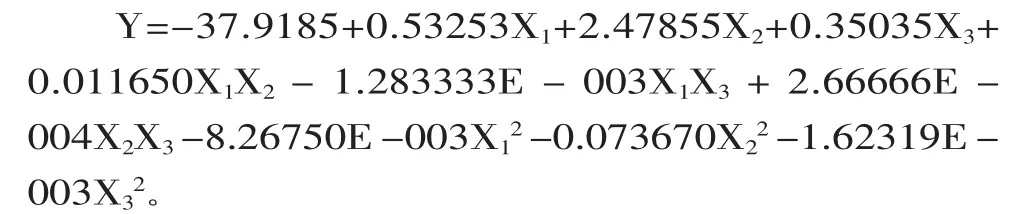
对二阶多项式方程进行分析,其结果见表4。
由表4可知,此响应面回归模型达到显著水平(p<0.05),且模型p=0.0001,表明模型的显著性极高,不同处理之间的差异性极大。CV值为3较低,说明实验操作的可信度较高。
模型的调整系数R2Adj=94.59%(表4),说明该模型能解释94.59%的响应值的变化,拟合程度良好,实验误差较小。决定系数(R2)和调整系数(R2Adj)分别为97.63%和94.59%,具有很好的一致性,可以用此模型来对紫茄皮花色苷得率进行分析和预测[25]。对模型回归方程系数的显著性实验表明:影响花色苷提取效果的主要因素的次序是X2>X1>X3,二次项X12、X22、X32,交互项X1X2、X1X3显著,表明提取温度与液料比及提取温度与提取时间等的交互作用等对紫茄皮花色苷的提取效果有较为显著的影响[26-27]。
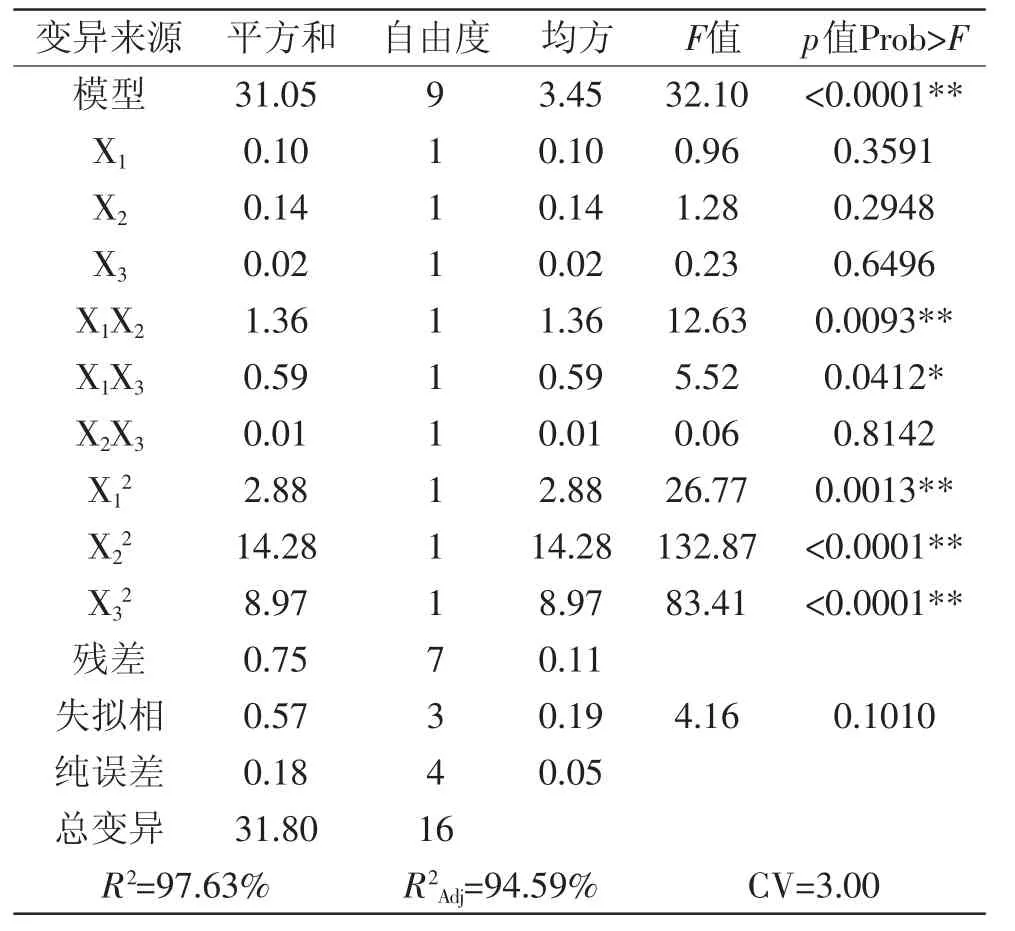
表4 回归模型的方差分析Table 4 Variance Analysis of regression model
2.3.3 响应面曲面分析 响应面图形是响应值对各因素所构成的三维空间的曲面图[28]。等高线的形状反映交互效应的强弱大小,椭圆形表示两个因素交互作用显著[29]。为进一步考察3个因素两两之间的交互作用对花色苷提取效果的影响,对其响应面曲线进行分析,从响应面图中找到优化区域,在优化区域内通过调整各因素的数值大小来满足花色苷提取过程中的实际需要,最终得到较好的花色苷提取条件。
2.3.3.1 提取温度和液料比对花色苷提取效果的影响 由图6可知,当提取时间为90min时,随着提取温度和液料比的升高,紫茄皮花色苷提取效果先升高后降低,响应面相对较陡,表明对提取温度和液料比对花色苷提取效果的影响较大。一方面,当温度过高时,花色苷会降解,不利于花色苷的稳定。另一方面,随着液料比的升高,花色苷的提取效果升高,但是当超过一定范围后,其提取效果不升反降。
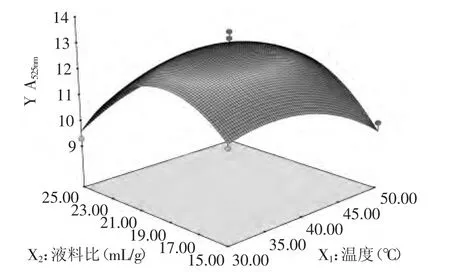
图6 提取温度和液料比对花色苷提取效果影响的曲面线图Fig.6 Response surface diagram of effect between extraction temperature and liquid-solid ratio
2.3.3.2 提取温度和提取时间对花色苷提取效果的影响 由图7可知,响应曲面的坡度较抖,表明花色苷的提取效果对提取温度和提取时间的变化较敏感。特别是提取时间变化对花色苷提取效果的影响比提取温度的影响大。提取温度选择35~45℃之间,提取时间选择80~95min之间可以得到较好的花色苷提取效果。
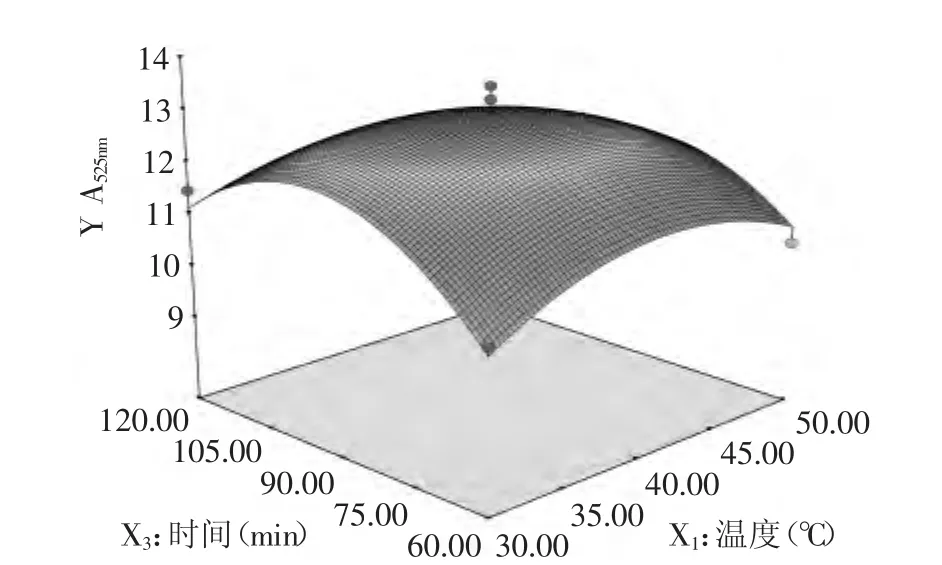
图7 提取温度和提取时间对花色苷提取效果影响的曲面线图Fig.7 Response surface diagram of effect between extraction temperature and extraction time
2.4 验证实验
经Design-Expert 8.0.6软件分析优化,可得到紫茄皮花色苷最佳提取工艺参数为提取温度37.60℃、液料比18.90∶1mL/g、提取时间93.49min,在此最佳工艺条件下花色苷提取效果A525理论值为12.876。考虑到可操作性,将最优提取条件调整为提取温度38℃、液料比19∶1mL/g、提取时间95min。用此条件进行验证实验,得到花色苷提取效果A525为12.752,与理论预测值12.876仅相差0.124,两者一致性高,说明优化结果可靠。
3 结论
本文以紫茄皮为原料,乙醇作为提取剂,花色苷提取液的吸光值作为提取效果指标,采用响应面分析法优化紫茄皮花色苷的提取条件。实验中不同浓度的乙醇对花色苷的提取效果不同,提取剂的pH同样影响紫茄皮花色苷的提取效果。经实验确定,在紫茄皮中提取花色苷宜采用70%乙醇(含0.05%盐酸)作为提取剂。通过单因素实验可知,最佳的单因素组合为温度40℃、时间90min、液料比20∶1。在单因素的基础上利用实验设计软件Design-Expert 8.0.6,采用Box-Behnken中心组合实验设计以及响应面分析对紫茄皮花色苷提取工艺进行优化,得出了紫茄皮花色苷提取各因素变量的二次方程模型,该模型具有统计学意义,对实验拟合较好,并获得优化工艺的条件为提取温度38℃、液料比19∶1mL/g、提取时间95min。在此工艺条件下,花色苷提取效果A525为12.752,与理论预测值12.876相差0.124。由此可以看出,采用酸性乙醇作为提取溶剂,经过响应面法优化提取工艺,能够更好地提取紫茄皮中的花色苷。
[1]贡树铭.佳蔬良药话紫茄[J].中医药文化,2013(2):41-42.
[2]陈俊成.食用天然色素——花青素简介[N].中国食品质量报,2004-04-03(7).
[3]McDougall G J,Fyffe S,Dobson P,et al.Anthocyanins from red cabbage-stability to simulated gastrointestinal digestion[J].Phytochemistry,2007,68(9):1285-1294.
[4]孙晓侠,吴珊珊,王改玲.超声波强化提取黑米皮色素的工艺研究[J].中国酿造,2010(9):133-136.
[5]Ogawa K,Sakakibara H,Iwata R,et al.Anthocyanin composition and antioxidant activity of the Crowberry(Empetrum nigrum)and other berries[J].J Agric Food Chem,2008,56(12):4457-4462.
[6]Boulekbache-Makhlouf L,Medouni L,Medouni-Adrar S,et al.Effect of solvents extraction on phenolic content and antioxidant activity of the byproduct of eggplant[J].Industrial Crops and Products,2013,49(1):668-674.
[7]赵芳,边丽,胡栋梁.茄子皮红色素抗氧化活性研究[J].食品与机械,2008(2):62-64.
[8]赵海田,王振宇,王路,等.花色苷类物质降血脂机制研究进展[J].东北农业大学学报,2012(3):139-144.
[9]孟宪军,毕菀芩,张琦,等.蓝莓花色苷对大鼠视网膜光损伤的保护作用及其机制[J].食品科学,2013(11):242-245.
[10]董丽花,闫超.茄子皮色素的最佳提取工艺和稳定性研究[J].中国调味品,2008(12):80-83.
[11]梁党,张会香,杨世军.茄子皮中紫色素的微波法提取工艺和稳定性研究[J].食品研究与开发,2010(8):237-240.
[12]王顺民,郭红转,周丽娟,等.茄子皮天然红色素超声波提取及理化性质研究[J].农产品加工·学刊,2008(2):12-14.
[13]Chatterjee D,Jadhav N T,Bhattacharjee P.Solvent and supercritical carbon dioxide extraction of color from eggplants:Characterization and food applications[J].LWT-Food Science and Technology,2013,51(1):319-324.
[14]滕学峰.黑大豆皮中色素的提取纯化、结构鉴定及其性质的研究[D].哈尔滨:东北农业大学,2008.
[15]刘妍妍.红甘蓝花色苷的提取纯化、稳定性及抗氧化活性研究[D].哈尔滨:东北农业大学,2009.
[16]吕明.拌茄泥吃茄子营养损失少[J].农业知识,2012(23):60.
[17]卢锋波,刘桂玲,王烁,等.响应面法优化果胶酶酶解提取黑莓花色苷的工艺参数[J].食品科学,2010(16):11-15.
[18]陈冠林,胡坤,高永清,等.紫红肉火龙果果皮色素提取工艺的响应面法优化[J].湖北农业科学,2013(2):418-422.
[19]黄昉,徐志宏,李汴生,等.黑豆种皮色素的测定和提取[J].食品工业科技,2004(4):117-119.
[20]邓洁红.刺葡萄皮色素的研究[D].长沙:湖南农业大学,2007.
[21]韩永斌.紫甘薯花色苷提取工艺与组分分析及其稳定性和抗氧化性研究[D].南京:南京农业大学,2007.
[22]Bonilla F,Mayen M,Merida J,et al.Extraction of phenolic compounds from red grape marc for use as food lipid antioxidants [J].Food Chemistry,1999,66(2):209-215.
[23]何玲,唐爱均,洪锋.红提葡萄红色素稳定性的研究[J].西北农林科技大学学报:自然科学版,2005(9):73-76.
[24]Chigurupati N,Saiki L,Gayser Jr C,et al.Evaluation of red cabbage dye as a potential natural color for pharmaceutical use [J].International Journal of Pharmaceutics,2002,241(2):293-299.
[25]Bai X L,Yue T L,Yuan Y H,et al.Optimization of microwave-assisted extraction of polyphenols from apple pomace using response surface methodology and HPLC analysis[J].J Sep Sci,2010,33(23-24):3751-3758.
[26]卞清德,马英昌,罗淑年,等.固定化磷脂酶用于大豆油脱胶的研究[J].中国油脂,2009(7):1-4.
[27]马志虎,侯喜林,汤兴利,等.响应面法优化超临界CO2萃取韭菜籽油[J].中国油脂,2009(7):13-17.
[28]王淑霞,李爱梅,张俊杰,等.响应面分析法优化龙眼核中多酚物质提取工艺[J].食品科学,2011(10):35-39.
[29]范龚健,韩永斌,顾振新.用响应面法优化红甘蓝色素提取工艺参数[J].南京农业大学学报,2006(1):103-107.
Optimization of anthocyanins extraction conditions of purple eggplant-peel by response surface methodology
GUO Fei,LIU Ji,HUANG Peng,LIU Dong-jie,XIONG Ya-bo,QIN Wen*
(College of Food Science,Sichuan Agricultural University,Ya’an 625014,China)
Using purple eggplant-peel as the research object,organic solvent extraction as the method,with the anthocyanin solution absorbance as a measure indicator.Response surface analysis method was used to optimize the extraction condition of purple eggplant-peel anthocyanins.On the basis of single factor experiments,extraction temperature,liquid-solid ratio(mL/g)and extraction time were chosen as arguments and A525V/m(V:extracting agent,m:the sample quality)as response value.The interaction of the respective variables and their influence on the extraction rate were studied by using Box-Benhnken central composite design and response surface analysis theory.Under the condition of 70%ethanol(containing 0.05%hydrochloric acid,V/V),the optimum extraction condition for extraction was obtained.Results showed that optimum conditions were:the temperature was 38℃,liquid-solid ratio was 19∶1,extraction time was 95min.Under these conditions,A525,the effect of anthocyanins extraction was 12.752.Comparing with the theoretical value 12.876,the relative error was 0.124.Results indicated that the equation derived by response regression equation had some practical significance.
purple eggplant-peel;anthocyanins;extraction;response surface method
TS255.1
B
1002-0306(2014)06-0268-06
2013-07-30 *通讯联系人
郭菲(1987-),女,硕士研究生,研究方向:食品科学。

