紫苏叶花色苷稳定性的研究
吴秋敏,苏 平,蔡宁晨,刘晓霞
(浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
紫苏叶花色苷稳定性的研究
吴秋敏,苏 平*,蔡宁晨,刘晓霞
(浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
紫苏是我国传统的药食两用植物,因含有丰富的花色苷成分,具有广阔的产业发展前景。随着人们对天然色素日益增长的需求,紫苏叶花色苷将成为一个良好的天然色素来源。本文研究了pH、光照、温度等因素对紫苏叶花色苷稳定性的影响:紫苏叶花色苷不耐高温,在光照条件下比较稳定,然而长时间的光照也会对紫苏叶花色苷造成影响。pH对其影响显著,在pH2~4范围内相对稳定。大部分无色金属离子对紫苏叶花色苷的稳定性没有影响,而Cu2+、Fe3+对紫苏叶花色苷稳定性影响较大。除此之外,氧化还原剂、苯甲酸钠和VC对紫苏叶花色苷都有破坏作用。
紫苏叶,花色苷,稳定性
食品都具有一定的颜色特征,色泽的好坏直接影响消费者对食品的可接受性以及对其品质的评价[1]。天然色素因安全可靠、具有一定的生物学功能,且着色色调自然而倍受青睐[2]。在过去的十年中,天然植物色素在食品工业中有很大的需求量,然而,由于天然色素在光、氧、温度、pH等这些因素中的稳定性不如合成色素,因此用天然色素取代合成色素仍面临挑战[3]。
花色苷是一种水溶性色素,属于黄酮类化合物,主要存在于果实、花卉以及有色叶片中。大量研究表明,花色苷类化合物具有良好的生物活性,包括抗氧化[4]、抗肿瘤[5]、抗疲劳[6]、改善视力[7]、预防心血管疾病[8]等。近年来,关于花色苷这种天然色素的研究越来越多,主要针对它的抗氧化性、稳定性、生理活性及着色影响等方面,而国内外对于紫苏叶花色苷及其稳定性的研究还没有报道。紫苏叶花色苷是一类花青素类色素,其主要成分包括丙二酰基紫苏宁和紫苏宁等[9]。由于其对光和热有较高的稳定性,因此对紫苏叶花色苷的开发利用有较好的前景。本文采用酸化乙醇法提取再用大孔树脂纯化紫苏叶中的花色苷,探讨其在不同条件下的稳定性,旨在为紫苏叶花色苷在工业中的生产应用提供理论依据。
1 材料与方法
1.1 材料与仪器
日本紫红五号 嫩叶采自浙江省湖州市,并冷冻保藏;大孔树脂(Amberlite XAD-7HP) 天津威德国际贸易有限公司;乙醇、盐酸、氢氧化钠、柠檬酸、VC、苯甲酸钠、高锰酸钾、亚硫酸钠、焦亚硫酸钾、NaCl、CaCl2、KCl、ZnCl2、MgCl2、CuCl2、FeCl3等 均为分析纯试剂。
RE-52AA型旋转蒸发器、SHZ-Ⅲ型循环水真空泵 上海亚荣生化仪器厂;冷冻干燥机 美国LABCONCO;UV-2550型紫外-可见分光光度计 日本岛津;HH-2型数显恒温水浴锅 上海浦东荣丰科学仪器有限公司;PHS-W系列微机型pH计 苏州江东精密仪器有限公司;白炽灯。
1.2 实验方法
1.2.1 紫苏叶花色苷的制备 将新鲜紫苏叶研磨成浆,用1%HCl-60%乙醇在60℃下水浴振荡1h,抽滤得到紫苏叶花色苷粗提物[10-11];再用XAD-7大孔树脂纯化,纯化物减压浓缩后冷冻干燥,得紫苏叶花色苷冻干粉。
1.2.2 不同条件对紫苏叶花色苷稳定性的影响
1.2.2.1 pH对紫苏叶花色苷稳定性的影响 避光下,用柠檬酸-氢氧化钠缓冲溶液将紫苏叶花色苷冻干粉分别配制成pH为1~12的色素溶液,配制得到的样品用铝箔纸包好在室温下保存。在室温条件下观察其随时间的颜色变化并测绘特征吸收光谱,分别测定420、700nm及最大吸收波长处的吸光值以色彩密度和降解指数来描述紫苏叶花色苷在不同pH时的稳定性。
1.2.2.2 温度对紫苏叶花色苷稳定性的影响 避光下,将紫苏叶花色苷冻干粉用去离子水配制成样品溶液,用柠檬酸-氢氧化钠缓冲溶液将样品溶液调节成pH为3,并用铝箔纸包好,分别在40、60、80、99℃水浴下加热1h,同时在(99±1)℃中水浴0、30、60、90、120min,测定不同温度处理条件下的420、700nm及最大吸收波长处的吸光值。
1.2.2.3 光照对紫苏叶花色苷稳定性的影响 将紫苏叶花色苷冻干粉配制成样品溶液,用柠檬酸-氢氧化钠缓冲溶液将样品溶液调节pH为3,用铝箔纸包好,分为两组,一组避光处理9d,另一组不避光处理,在白炽灯下光照9d。测定避光条件和光照条件下样品溶液420、700nm及最大吸收波长处的吸光值。
1.2.2.4 金属离子对紫苏叶花色苷稳定性的影响 避光下,将紫苏叶花色苷冻干粉配制成样品溶液,用柠檬酸-氢氧化钠缓冲溶液将样品溶液调节成pH为3,用铝箔纸包好。往样品中添加不同金属离子(0.4g/L),分别测定420、700nm及最大吸收波长处的吸光值,持续9d。
1.2.2.5 氧化还原剂对紫苏叶花色苷稳定性的影响
避光下,将紫苏叶花色苷冻干粉配制成样品溶液,用柠檬酸-氢氧化钠缓冲溶液将样品溶液调节成pH为3,用铝箔纸包好。往样品中添加高锰酸钾或亚硫酸钠(0.4g/L),反应1h后分别测定420、700nm及最大吸收波长处的吸光值。
1.2.2.6 苯甲酸钠对紫苏叶花色苷稳定性的影响 避光下,将紫苏叶花色苷冻干粉配制成样品溶液,用柠檬酸-氢氧化钠缓冲溶液将样品溶液调节成pH为3,用铝箔纸包好。往样品中添加不同浓度的苯甲酸钠,分别测定1h和1d后的420、700nm及最大吸收波长处的吸光值。
1.2.2.7 VC对紫苏叶花色苷稳定性的影响 避光下,将紫苏叶花色苷冻干粉配制成样品溶液,用柠檬酸-氢氧化钠缓冲溶液将样品溶液调节成pH为3,用铝箔纸包好。往样品中添加抗坏血酸(0.5g/L),每天测一次420、700nm及最大吸收波长处的吸光值吸光值,持续9d。
1.2.3 颜色密度、聚合色素和降解指数 参照文献[3]测定如下指标:颜色密度(Color Density)是用来表示溶液的色彩强度,是溶液在最大吸收波长处(Aλmax)和420nm处(A420nm)的吸光值之和。计算公式为:CD=(Aλmax-A700nm)+(A420nm-A700nm)。700nm处的吸光值(A700nm)为消除溶液浑浊的影响。
聚合色素(Polymeric Color)是聚合物色素(包括单宁、棕色化合物等)的一种表示方法,其成分的确定使用焦亚硫酸盐漂白的方法。
取0.2mL的K2S2O5添加到3mL的色素溶液中,在420nm(As420nm)、λmax(Asλmax)和700nm(As700nm)波长下,分别测定吸光度值。CDSO2=(Asλmax-As700nm)+(As420nm-As700nm)
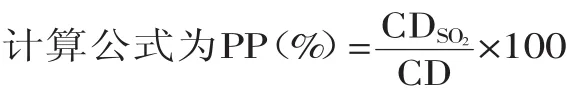
式:PP为聚合色素;CDSO2为添加焦亚硫酸盐样液的颜色密度;CD为样品溶液的颜色密度。
降解指数(Degradation Index,DI)是样品在420nm处的吸光值与最大吸收波长处的吸光值的比值,是对褐变化合物含量变化的测定。计算公式为:DI= A420nm/Aλmax。
2 结果与分析
2.1 pH对紫苏叶花色苷稳定性的影响
用柠檬酸-氢氧化钠缓冲溶液将紫苏叶花色苷溶液调节成不同的pH,观察其颜色变化,并测绘特征吸收光谱,结果见表1及图1。
由表1及图1可知,紫苏叶花色苷溶液的颜色随着pH的改变有明显不同。pH≥7时,花色苷溶液随着时间的推移其稳定性明显变差。避光放置1h后,pH为1~4的花色苷溶液,颜色均显出明显的红色,且随着pH的增加,逐渐从亮红转变为粉红,颜色逐渐变浅;pH为5~6时,颜色由浅红过渡到浅紫;pH为7~9时,颜色呈现紫色,且随着pH的增加,其颜色略微加深;pH为10~12时,颜色由深蓝逐渐过渡为黄褐色。避光放置5d后,pH为1~6时的花色苷溶液颜色及吸收光谱图与放置1h的相比,变化不大;而pH为7~12时的溶液颜色及吸收光谱图与放置1h的相比,原先呈现的紫色及蓝色均消失变为土黄色,且随着pH的增大,黄色逐渐加深,并且原先光谱图上呈现的特征吸收峰也都消失(表1)。这是因为pH可以改变花色苷的结构或改变它的组成,单糖花色苷在pH<2时,以2-苯基苯并吡喃阳离子(AH+)形式存在。花色苷在pH4~5时,以醌型假碱(B)或查而酮(C)形式存在。花色苷在pH>6时,以醇型A存在[12-13]。正是由于这些结构的变化,花色苷在不同pH时呈现不同的颜色。
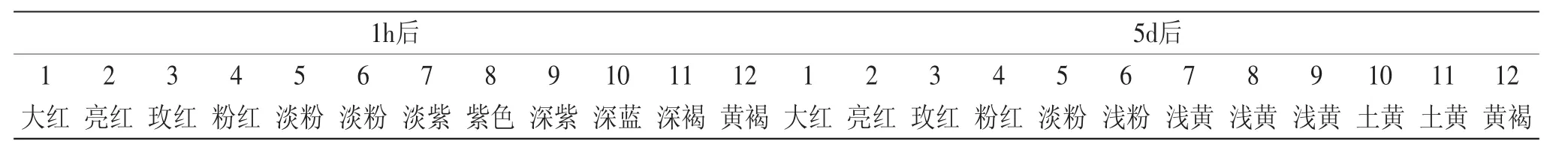
表1 紫苏叶花色苷在不同pH下避光放置1h后和5d后的颜色变化Table 1 The color changes of anthocyanins from leaves of Perilla frutescens at different pHs,initially and after 5 days,protected from light
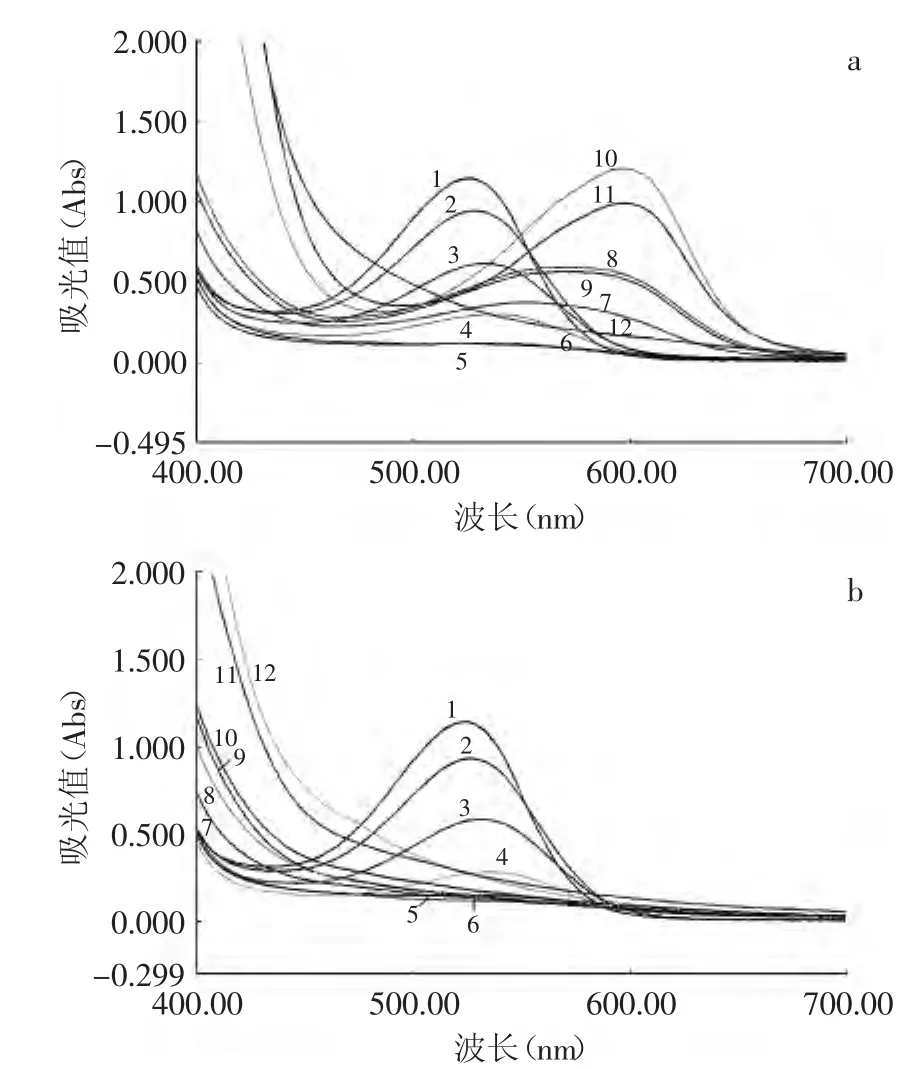
图1 特征吸收光谱图Fig.1 Spectrum charts for anthocyanins from leaves of Perilla frutescens
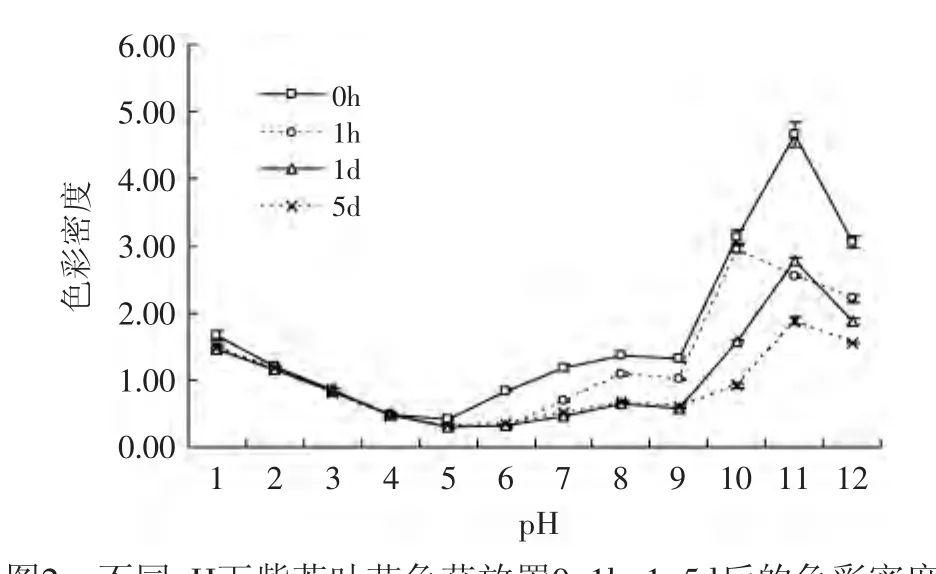
图2 不同pH下紫苏叶花色苷放置0、1h、1、5d后的色彩密度Fig.2 The effect of pH on the color density of anthocyanins from leaves of Perilla frutescens after 0、1h、1d and 5d
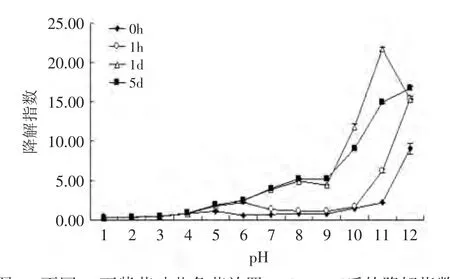
图3 不同pH下紫苏叶花色苷放置0、1h、1、5d后的降解指数Fig.3 The effect of pH on the degradation index of anthocyanins from leaves of Perilla frutescens after 0、1h、1d and 5d
由图2、图3可知,pH对花色苷的影响显著(p<0.01),pH为5时,色彩密度最低,颜色最浅,pH为11时,色彩密度最高,颜色最深。pH≥5时,随着时间的增长,花色苷溶液的色彩密度变小,变化较大;而随着pH的增加,降解指数呈现增长的趋势,这说明在碱性条件下紫苏叶花色苷更容易被降解。pH为2~4时,降解指数、色彩密度几乎没有变化。这说明在pH2~4条件下,紫苏叶的花色苷较为稳定。
综上可以得出,紫苏叶花色苷在酸性条件下比较稳定,且在pH为2~4范围内最为稳定,pH≥7时,紫苏叶花色苷会被分解为其他物质,呈黄褐色。因此,在加工紫苏叶花色苷时应尽量保持在酸性条件下,才更好地保持花色苷的色泽。
2.2 温度对紫苏叶花色苷稳定性的影响
用柠檬酸-氢氧化钠缓冲溶液将紫苏叶花色苷溶液调节成pH为3,在不同温度下处理,结果见图4、图5及表2。
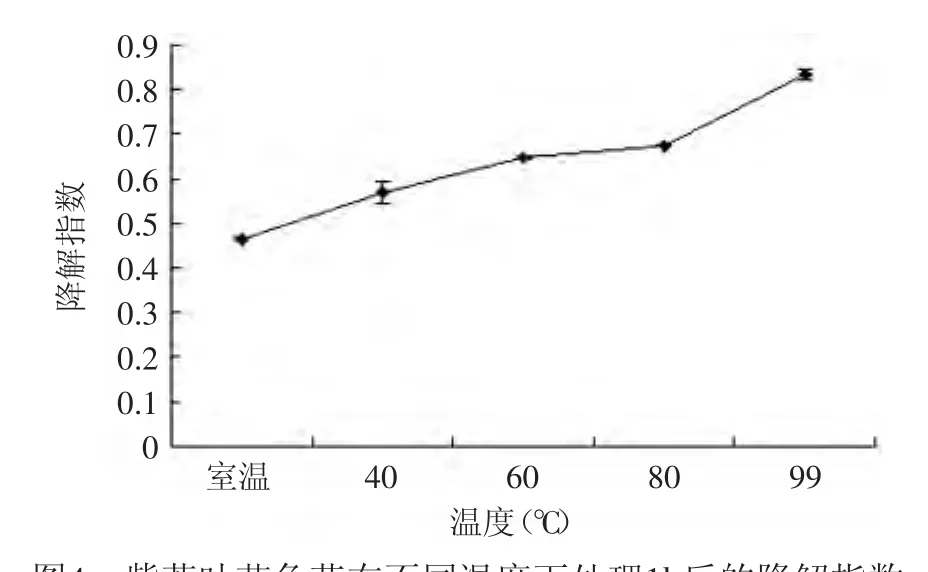
图4 紫苏叶花色苷在不同温度下处理1h后的降解指数Fig.4 The effect of different temperature on the degradation index of anthocyanins from leaves of Perilla frutescens after 1h
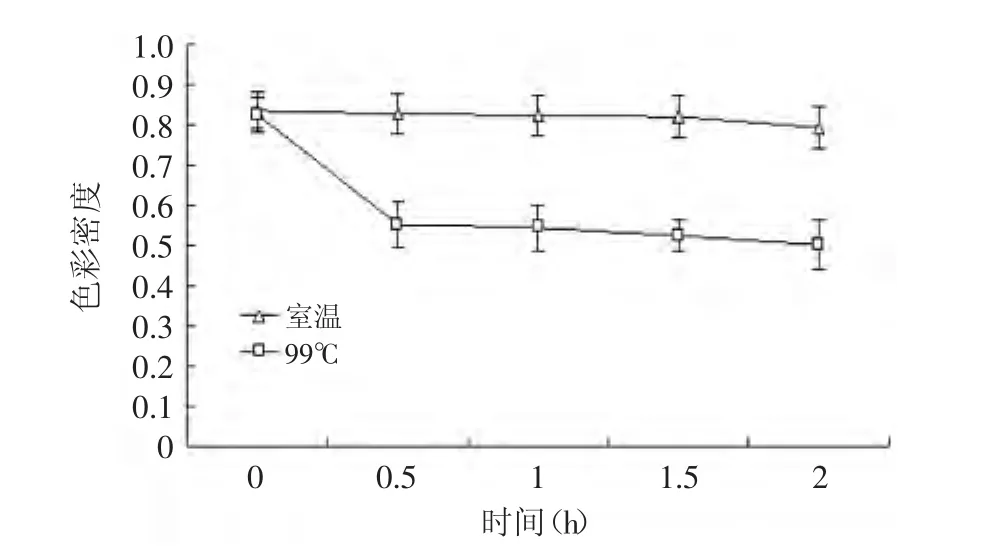
图5 紫苏叶花色苷在99℃下处理不同时间的色彩密度Fig.5 The effect of different time under 99℃on the color density of anthocyanins from leaves of Perilla frutescens
加热会降解花色苷,从而使花色苷失去它原有的颜色。随着温度的升高,花色苷溶液的降解指数逐渐增大(图4),这说明温度越高,对紫苏叶花色苷的破坏越厉害。在0~30min短时间内,高温对紫苏叶花色苷具有显著的破坏作用(p<0.01),并且随着时间的增加,温度对花色苷溶液的影响逐渐减小,最后趋于稳定(图5)。
随着温度的增高,花色苷溶液的色彩密度降低,聚合色素增大(表2)。这是因为,温度越高对紫苏叶花色苷的破坏作用越大,色彩密度降低;而聚合色素的增大有可能由于高温能够促使聚合色素的生成。处理 0h 1h
色彩密度 聚合色素(%) 色彩密度 聚合色素(%)室温 0.8±0.1 20.8±0.1 0.8±0.1 20.5±0.1 40℃ - - 0.8±0.1 22.5±0.3 60℃ - - 0.6±0.1 25.8±0.2 80℃ - - 0.6±0.1 25.9±0.1 99℃ - - 0.5±0.1 29.3±0.3
综上可知,温度越高,紫苏叶花色苷的稳定性越差,并且高温在较短的时间内就会破坏紫苏叶花色苷,另外,随着温度的升高,花色苷溶液的聚合色素也会增加。所以,利用和加工紫苏叶花色苷最好在低温下操作,有利于保持它的稳定性。
2.3 光照对紫苏叶花色苷稳定性的影响
用柠檬酸-氢氧化钠缓冲溶液将紫苏叶花色苷溶液调节成pH为3,分别在避光条件和光照条件下放置,结果见图6及表3。

图6 紫苏叶花色苷分别在避光和光照条件下处理0~9d的色彩密度Fig.6 The effect of light on the color density of anthocyanins from leaves of Perilla frutescens after 0~9d
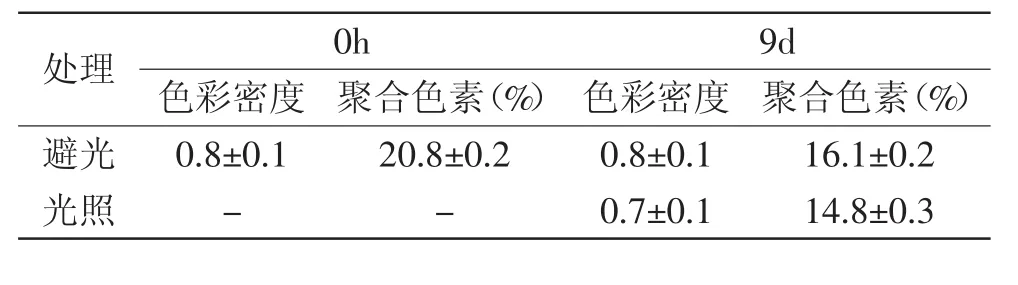
表3 避光和光照对花色苷溶液色彩密度和聚合色素的影响Table 3 Color density and polymeric colour of pH3 extracts before and after exposure to light
光照降低紫苏叶花色苷的色彩密度,且随着时间的增加,花色苷溶液的色彩密度呈下降趋势,且第5d是个转折点,第5d后花色苷溶液的色彩密度曲线下降的趋势更加明显(图6)。花色苷溶液避光保存多天后,其聚合色素降低,而相比于光照组,其色彩密度及聚合色素均比光照组的高(图6、表3)。这是因为光照会使花色苷分解或氧化,造成色素的脱色[14]。
综上可知,光照对紫苏叶花色苷有显著性影响(p<0.01),不仅会降低其色彩密度,而且还会降低其聚合色素。所以,长期储存或加工紫苏叶花色苷,应采用避光处理。
2.4 金属离子对紫苏叶花色苷稳定性的影响
用柠檬酸-氢氧化钠缓冲溶液将紫苏叶花色苷溶液调节成pH为3,再在溶液中分别添加不同种类的金属离子,结果见图7、图8及表4。
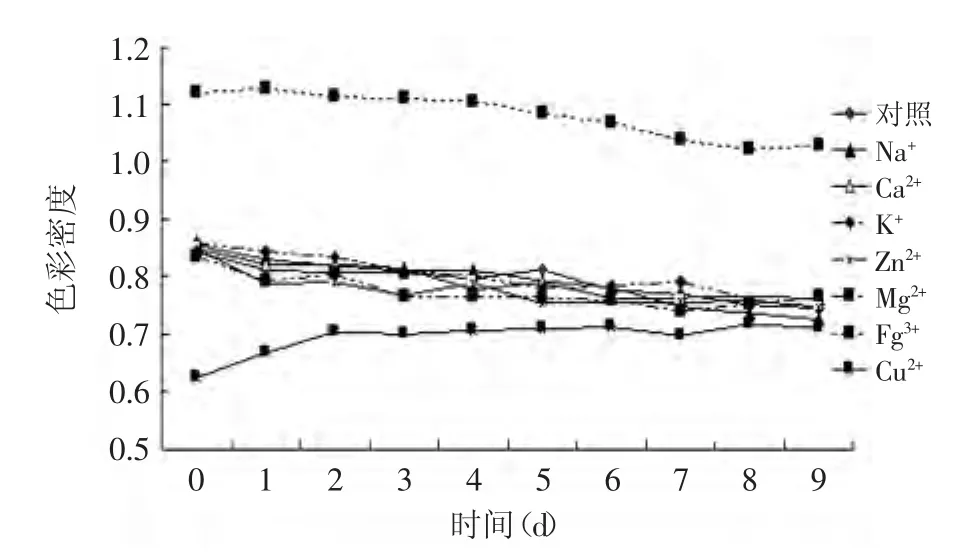
图7 紫苏叶花色苷分别在不同金属离子中处理0~9d的色彩密度Fig.7 The effect of different metal ion on the color density of anthocyanins from leaves of Perilla frutescens after 0~9d
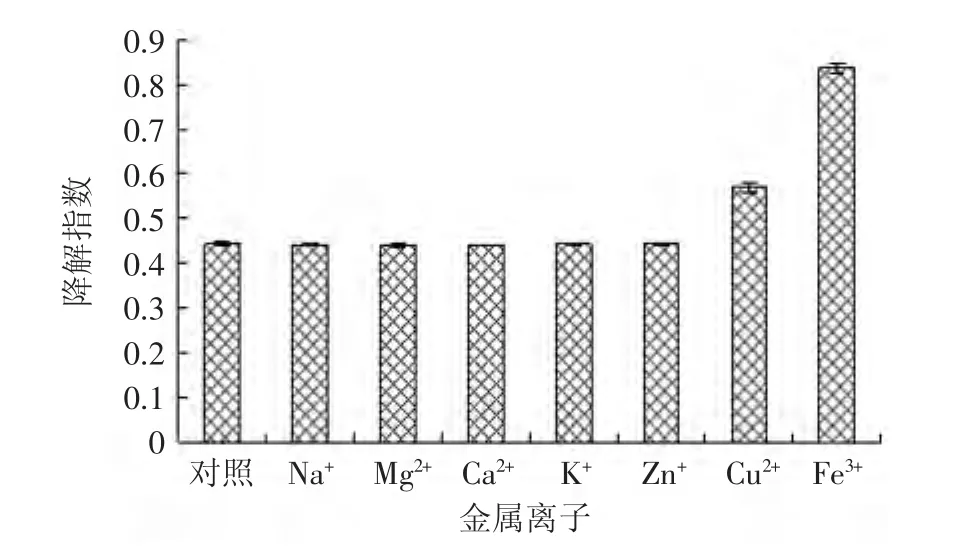
图8 紫苏叶花色苷分别在不同金属离子中处理1d后的降解指数Fig.8 The effect of different metal ion on the degradation index of anthocyanins from leaves of Perilla frutescens after 1d
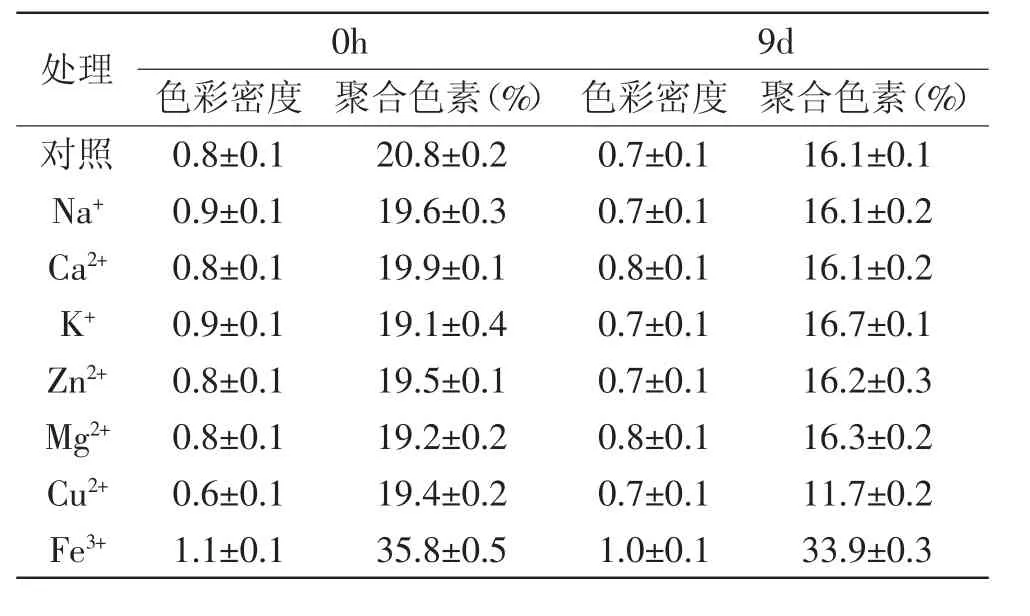
表4 不同金属离子对花色苷溶液色彩密度和聚合色素的影响Table 4 Color density and polymeric color of pH3 extracts after adding metal ion
Na+、Ca2+、K+这些离子对花色苷溶液的稳定性几乎没有显著性影响(p>0.05),而Cu2+、Fe3+有显著影响(p<0.05)。添加Cu2+的花色苷溶液与对照组相比,其色彩密度逐渐由小变大,且降解指数比对照组大、聚合色素比对照组小。添加Fe3+的花色苷溶液与对照组相比,其色彩密度、聚合色素及降解指数都大很多。这是因为通常情况下,天然花色苷会与Zn2+、Al3+、Fe3+、 Cu2+等分子量稍大、原子价态高且具有金属活性的金属离子发生反应。这些离子会使花色苷溶液褪色,甚至沉淀。然而,天然花色苷不与主族金属离子K+、Ca2+、Na+等发生反应,而Ca2+往往可以起到护色的作用[15]。
综上可知,大部分无色金属离子对紫苏叶花色苷的稳定性没有影响,而Cu2+、Fe3+对紫苏叶花色苷稳定性影响极显著(p<0.01),一部分原因是由于这两种离子本身就有颜色,另一部分原因是由于这两种离子对紫苏叶花色苷有螯合破坏作用。所以,在加工处理花色苷时应避免用铁铜金属的容器,也尽量避免这两种离子的接触。
2.5 氧化还原剂对紫苏叶花色苷稳定性的影响
用柠檬酸-氢氧化钠缓冲溶液将紫苏叶花色苷溶液调节成pH为3,再在溶液中分别添加高锰酸钾和亚硫酸钠,结果见图9及表5。
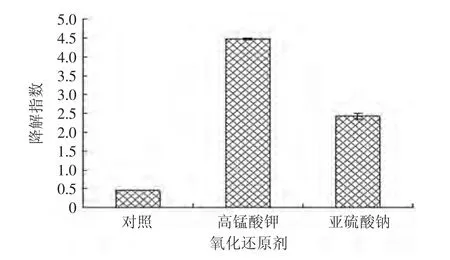
图9 紫苏叶花色苷分别在氧化剂和还原剂中处理1h后的降解指数Fig.9 The effect of reductant or oxidant on the degradation index of anthocyanins from leaves of Perilla frutescens after 1h
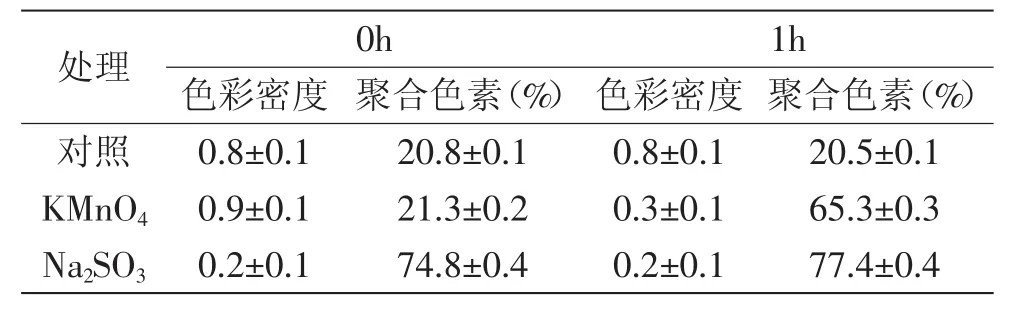
表5 氧化剂和还原剂对花色苷溶液色彩密度和聚合色素的影响Table 5 Color density and polymeric colour of pH3 extracts after adding reductant or oxidant
由图9可知,添加相同含量的氧化剂和还原剂对花色苷溶液都有显著影响(p<0.01),其降解指数均比对照组高,且添加氧化剂的花色苷溶液的降解指数比添加还原剂的花色苷溶液更高。这说明氧化剂与还原剂对花色苷溶液均有降解破坏作用,且氧化剂的降解作用比还原剂大。
而相比之下,Na2SO3对花色苷溶液的作用比KMnO4快(表5),添加Na2SO3到花色苷溶液,色彩密度立刻就降低很多;而添加KMnO4的花色苷溶液,色彩密度是过了1h后才明显降低。另外,添加Na2SO3和KMnO4的花色苷溶液中,聚合色素均比对照组高,而添加Na2SO3的花色苷溶液比添加KMnO4的聚合色素大。且添加KMnO4的溶液中,聚合色素随着色彩密度的减小而增大。这说明氧化剂和还原剂对紫苏叶花色苷的破坏作用都比较大,且能促使其生成聚合色素,但他们对花色苷的反应速度还有方式不同,可能因为他们对花色苷的氧化还原作用及结构破坏影响不同。所以,花色苷应避免用氧化或还原剂处理。
2.6 苯甲酸钠对紫苏叶花色苷稳定性的影响
用柠檬酸-氢氧化钠缓冲溶液将紫苏叶花色苷溶液调节成pH为3,再在溶液中分别添加不同质量浓度的苯甲酸钠,结果见图10及图11。
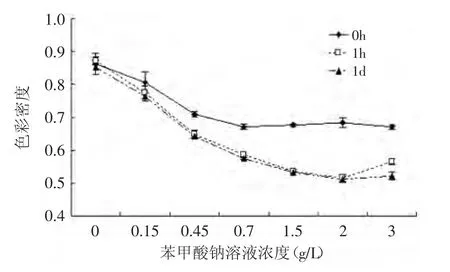
图10 紫苏叶花色苷分别在不同浓度苯甲酸钠溶液中处理1h和1d的色彩密度Fig.10 The effect of different sodium benzoate on the color density of anthocyanins from leaves of Perilla frutescens after 1h and 1d
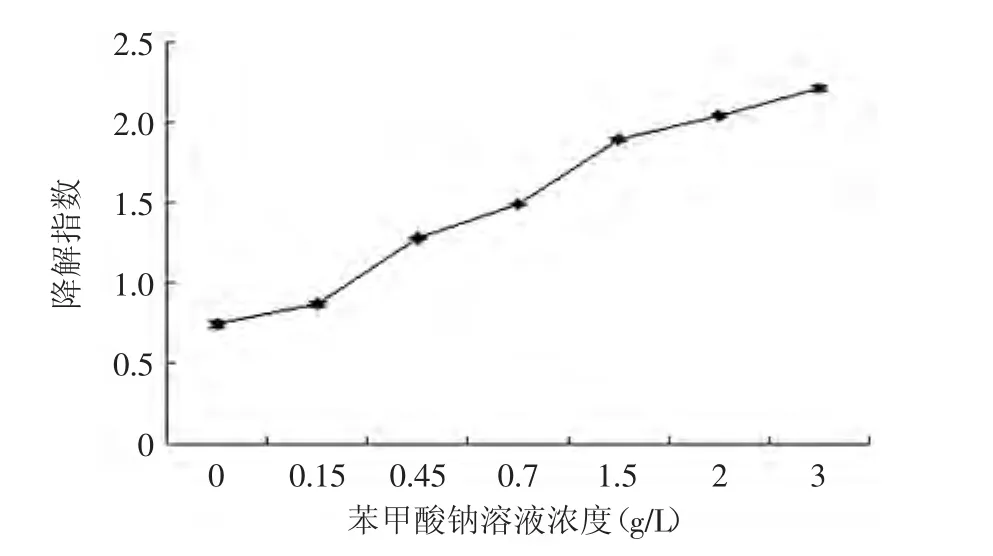
图11 紫苏叶花色苷分别在不同浓度苯甲酸钠溶液中处理1d后的降解指数Fig.11 The effect of different sodium benzoate on the degradation index of anthocyanins from leaves of Perilla frutescens after 1d
随着苯甲酸钠溶液添加量的增多,紫苏叶花色苷溶液的降解指数增大、色彩密度减小(图10、图11),这说明添加越多的苯甲酸钠,对紫苏叶花色苷的破坏作用越强。且苯甲酸钠对花色苷溶液在1h内有较大作用,1h以后,其对紫苏叶花色苷的破坏作用达到平衡。当苯甲酸钠质量浓度达到1.5g/L时,破坏作用达到最大,再增大浓度,对色彩密度的影响不大。所以,苯甲酸钠对花色苷有破坏作用,且破坏作用与苯甲酸钠的浓度和作用时间有关,1.5g/L浓度以下,对花色苷的破坏作用显著(p<0.01)。所以加工食品时应控制苯甲酸钠的添加量。
2.7 VC对紫苏叶花色苷稳定性的影响
用柠檬酸-氢氧化钠缓冲溶液将紫苏叶花色苷溶液调节成pH为3,再在溶液中添加VC,结果见图12及图13。
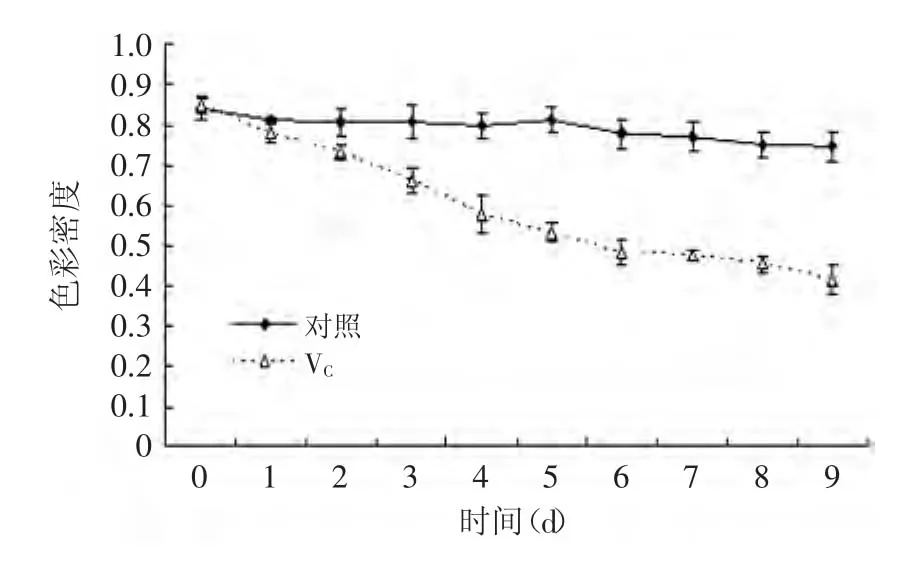
图12 紫苏叶花色苷在VC中处理0~9d的色彩密度Fig.12 The effect of VCon the color density of anthocyanins from leaves of Perilla frutescens after 0~9d
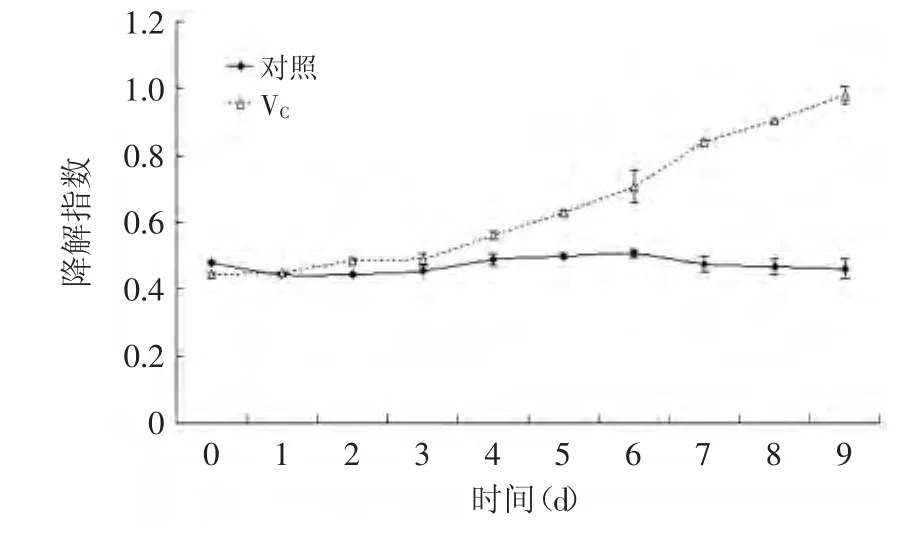
图13 紫苏叶花色苷分别在VC中处理0~9d的降解指数Fig.13 The effect of VCon the degradation index of anthocyanins from leaves of Perilla frutescens after 0~9d
随着时间的变化,VC对紫苏叶花色苷溶液色彩密度的影响非常显著(p<0.01)。随着时间的增长,花色苷溶液的色彩密度明显降低,降解指数明显增高(图12、图13)。这说明VC对紫苏叶花色苷有一定的破坏作用。这可能是因为VC自身的氧化褐变,产生的氧化产物而引起的。而VC也具有一定的还原性,可能破坏了花色苷的结构。所以,含有花色苷的食品加工应减少VC的添加量。
3 结论
通过对紫苏叶花色苷在不同条件下的稳定性的探讨,可以得到如下结论:
紫苏叶花色苷在酸性条件下比较稳定,且在pH为2~4范围内最为稳定,呈明亮的红色。当pH≥7时,紫苏叶花色苷会被分解为其他物质,呈浅黄色。随着温度的升高,紫苏叶花色苷的稳定性逐渐变差,并且高温条件下在较短的时间内就会破坏紫苏叶花色苷。另外,随着温度的升高,花色苷溶液的聚合色素也会增加。在白炽灯模拟的自然光照条件下,紫苏叶花色苷比较稳定,然而,长时间的光照也会对紫苏叶花色苷造成影响。随着光照时间的延长,紫苏叶花色苷的色彩密度和聚合色素均有一定程度的降低。大部分无色金属离子对紫苏叶花色苷的稳定性没有影响,而Cu2+、Fe3+对紫苏叶花色苷稳定性影响较大。另外,氧化还原剂、苯甲酸钠和VC对紫苏叶花色苷都有破坏作用。
综上实验结果,要在食品工业中很好地应用紫苏叶花色苷,需要将其应用于偏酸性的食品中,并且避光低温保藏,另外要避免Cu2+、Fe3+、氧化还原剂、苯甲酸钠和VC在紫苏叶花色苷的食品中添加。
[1]王艳龙,石绍福,韩豪,等.中国黑米花色苷研究现状及展望[J].中国生化药物杂志,2010,31(1):63-66.
[2]刘树文,何玲,洪锋,等.葡萄红色素稳定性的研究[J].中国食品学报,2005,5(4):115-118.
[3]Bolfivar A Cevallos-Casals,Luis Cisneros-Zevallos.Stability of anthocyanin-based aqueous extracts of Andean purple corn and red-fleshed sweet potato compared to synthetic and natural colorants[J].Food Chemistry,2004,86(1):69-77.
[4]Long Yi,Chun-ye Chen,Xin Jin,et al.Structural requirements of anthocyanins in relation to inhibition of endothelial injury induced by oxidized low-density lipoprotein and correlation with radical scavenging activity[J].FEBS Letters,2010,584:583-590.
[5]Andrea Bunea,Dumitrita Rugina,Zorita Sconta,et al.Anthocyanin determination in blueberry extracts from various cultivars and their antiproliferative and apoptotic properties in B16-F10 metastatic murine melanoma cells[J].Phytochemistry,2013,http://dx.doi.org/10.1016/j.phytochem.2013.06.018.
[6]Dong-Qing Jiang,Ying Guo,Dian-Hong Xu,et al.Antioxidant and anti-fatigue effects of anthocyanins of mulberry juice purification(MJP)and mulberry marc purification(MMP)from different varieties mulberry fruit in China[J].Food and Chemical Toxicology,2013(59):1-7.
[7]Hitoshi Matsumoto,Eri Takenami,Keiko Iwasaki-Kurashige,et al.Effects of blackcurrant anthocyanin intake on peripheral muscle circulation during typing work in humans[J].European Journal of Applied Physiology,2005,94:36-45.
[8]Akihiro Hagiwara,Kayoko Miyashita,Takumi Nakanishi,et al.Pronounced inhibition by a natural anthocyanin,purple corn color,of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine(PhIP)-associated colorectal carcinogenesis in male F344 rats pretreated with 1,2-dimethylhydrazine[J].Cancer letters,2001,171(1):17-25.
[9]Kondo T,Tamura H,Yoshida K,et al.Structure of malonylshisonin,a genuine pigment in purple leaves of Perilla ocimoides L.var.crispa Benth[J].Agricultural and Biological Chemistry,1989,53(3):797-800.
[10]杨振东.紫玉米芯花色苷提取工艺优化及其组分分析[J].中国食品添加剂,2010,(4):114-121.
[11]赵慧芳,王小敏,闾连飞,等.黑莓果实中花色苷的提取和测定方法研究[J].食品工业科技,2008(5):176-179.
[12]Anna Bakowska,Alicja Z.Kucharska,Jan Oszmiański.The effects of heating,UV irradiation,and storage on stability of the anthocyanin-polyphenol copigment complex[J].Food Chemistry,2003,81(3):349-355.
[13]Jie Li,Xiao-ding Li,Yun Zhang,et al.Identification and thermal stability of purple-fleshed sweet potato anthocyanins in aqueous solutions with various pH values and fruit juices[J].Food Chemistry,2013,136:1429-1434.
[14]陆卿卿,张丽霞,刘小莉,等.温度、pH和光照对蓝莓汁花色苷稳定性的影响[J].江西农业学报,2012,24(12):131-133.
[15]周伟伟.葛根微波干燥中的护色工艺研究[J].中国食品添加剂,2011(2):147-151.
Study on the stability of anthocyanins from leaves of Perilla frutescens
WU Qiu-min,SU Ping*,CAI Ning-chen,LIU Xiao-xia
(College of Biosystem Engineering and Food Science,Zhejiang University,Hangzhou 310058,China)
Perilla frutescensis a dual-purpose plant which could be used for food and medicine.Being abundant in anthocyanins,Perilla frutescenscould be widely used in many industries.With the increasing demand in natural colorant,anthocyanins from leaves ofPerilla frutescenswould be a good source of it.This paper studied the effect of light,metal ions,pH and temperature on the stability of anthocyanins from leaves ofPerilla frutescens.Anthocyanins could not tolerate high temperature.It could be relatively stable under light.But long-time lighting still damaged anthocyanins.pH had a significant effect on its stability and it was stable in pH 2~4 solution.Most metal ions had no effect on anthocyanins.However,Cu2+,Fe3+significantly had a bad effect on it.Besides,Results showed that reductant-oxidant,sodium benzoate and vitamin C had a degradation effect on anthocyanins from leaves ofPerilla frutescens.
leaves ofPerilla frutescens;anthocyanins;stability
TS202.3
A
1002-0306(2014)06-0292-06
2013-07-22 *通讯联系人
吴秋敏(1990-),女,硕士研究生,研究方向:农产品产后加工。

