施马伦贝格病焦磷酸测序检测方法的建立
(中国检验检疫科学研究院动物检疫研究所,北京 100029)
施马伦贝格病焦磷酸测序检测方法的建立
王彩霞,林祥梅,张永宁,吕继洲,冯春燕,袁向芬,邓俊花,吴绍强
(中国检验检疫科学研究院动物检疫研究所,北京 100029)
为适应口岸施马伦贝格病快速、准确、高通量检测需求,建立一种基于RT-PCR及焦磷酸测序技术平台的施马伦贝格病检测方法。本研究针对施马伦贝格病毒基因组RNA的S、M和L三个基因节段保守区域利用焦磷酸测序软件PyroMark Q96ID分别设计RT-PCR扩增引物及焦磷酸测序引物,以人工合成的SBV重组质粒为模板分别建立了SBV S、M、L基因的PCR-焦磷酸测序检测方法,比较三基因的PCR扩增结果以及测序分析结果,结合特异性检测结果,最终确定以M基因作为靶基因建立的焦磷酸测序检测方法效果最好,并以德国FLI提供的SBV(BH80株)RNA对所建立的方法进行验证,通过对测得序列的比对分析可确定为施马伦贝格病毒,这表明本研究所建立的方法灵敏度高、稳定性好、特异性强,可以用于施马伦贝格病毒基因序列水平上的精准检测鉴定。
施马伦贝格病毒;聚合酶链反应;焦磷酸测序;鉴定;检测
施马伦贝格病(Schmallenberg disease)是2011年11月首先在德国西部一个靠近荷兰和比利时的小城镇施马伦贝格发现的,是一种新发虫媒动物传染病。病牛出现发热、精神不振、体质下降、厌食、产奶量下降和腹泻等临床症状,有时会伴有流产症状[1]。施马伦贝格病毒(SBV)基因组为单股负链RNA,可分为L、M和S三个基因节段,其中L编码RNA依赖性RNA聚合酶;M编码2种表面糖蛋白Gn和Gc以及一个非结构蛋白;S编码核衣壳蛋白N和另一非结构蛋白NSs[2-3]。N蛋白是SBV病毒粒子中含量最丰富的蛋白,具有很强的免疫原性,是诱导机体产生抗体最早的蛋白,可作为该病分子生物学和血清学诊断的靶蛋白[1,4-5]。
焦磷酸测序技术(pyrosequencing)是一种能够进行定量序列测定的短链测序技术,具有高通量、快速、敏感等特点。目前该技术在物种鉴定、病毒快速鉴定和分型、微生物检测等方面应用广泛[6]。本研究针对SBV S、M、L三个基因节段的保守区域,
利用焦磷酸测序软件分别设计RT-PCR扩增引物及焦磷酸测序引物,建立了针对S、M、L三个基因节段的焦磷酸测序检测方法,并以德国FLI提供的SBV RNA对所建立的方法进行验证检测。
1 材料与方法
1.1 材料
SBV(BH80株)RNA由德国弗里德里希洛弗勒研究所(FLI)病毒诊断实验室惠赠。
1.2 方法
1.2.1 引物设计
根据GenBank中发布的SBV S、M、L三个基因节段的序列,经Blast分析比对,找出序列的保守区域,利用焦磷酸测序检测系统自带的引物设计软件设计RT-PCR扩增引物及测序引物(表1)。引物由英潍捷基(上海)贸易有限公司合成,用灭菌水将其浓度配制为10μmol/L,-20℃保存备用。
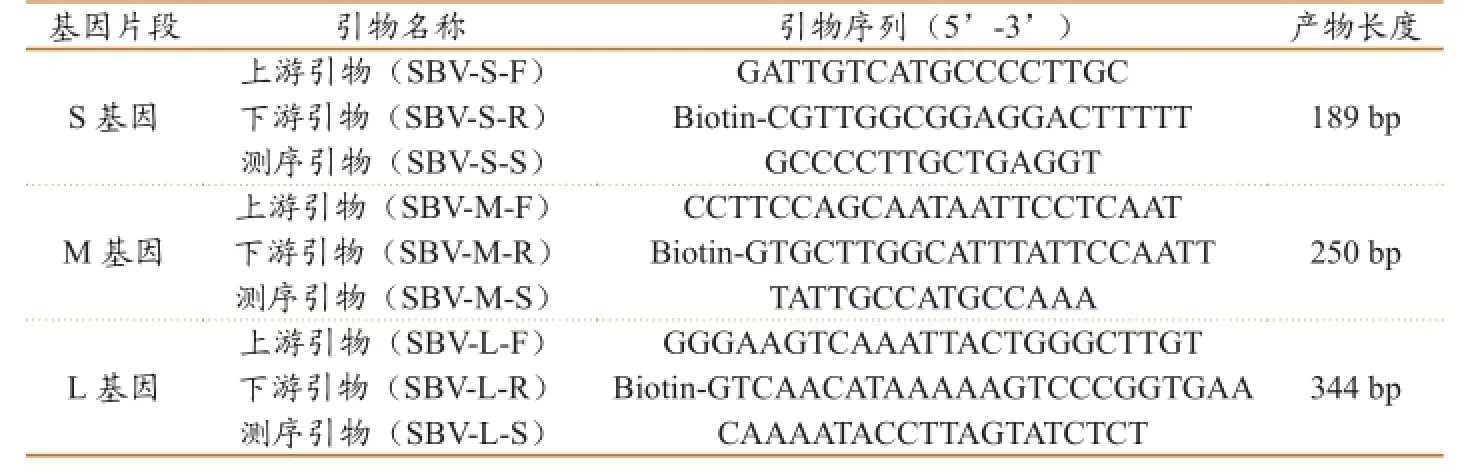
表1 RT-PCR扩增引物及测序引物
1.2.2 阳性克隆质粒的构建
通过对SBV S、M、L三个基因节段在线序列的查找与分析,选取包含其特异性序列的片段由大连宝生物公司进行基因合成,其中S基因片段长度为702bp,M基因片段长度为710bp,L基因片段长度为600bp,并构建到pMD19-T载体中,分别构建了重组质粒pMD19-T-SBVS、pMD19-TSBVM、pMD19-T-SBVL。测定三种重组质粒溶液的DNA浓度并换算为拷贝数,均10倍系列稀释至10拷贝/μL,-20℃保存备用。
1.2.3 检测靶基因的筛选
1.2.3.1 S、M、L三基因的焦磷酸测序—PCR扩增
以系列稀释的重组质粒(107~101拷贝/μL)为模板,分别以相应的扩增引物进行PCR扩增。25μL的PCR反应体系:10×PCR Buffer 2.5μL,2.5mmol/LdNTP 2μL,10μmol/L上下游引物各1μL,5U/μLrTaq 0.5μL,质粒DNA1μL,ddH2O补充至25μL。反应条件:94℃预变性5min;94℃变性30s,50℃(S基因)/58℃(M和L基因)退火30s,72℃延伸30s,进行50个循环;72℃延伸8min。PCR扩增完毕,以1.5%的琼脂糖凝胶电泳检测,比较三个基因的扩增效率。
1.2.3.2 单链模板制备及焦磷酸测序
分别取PCR产物10μL加ddH2O补至50μL,在产物中分别加入磁珠3μL和结合缓冲液47μL,常温震荡混匀10min;打开真空泵,将真空预装工具在超纯水中清洗30s后抓取磁珠,分别在70%乙醇、变性缓冲液、洗涤缓冲液中清洗5~10s,将磁珠移至预先加入测序引物和退火缓冲液的PSQ96孔板中;将此PSQ96孔板放在ThermoPlate上置80℃3min,取出自然冷却至室温;设定测序程序及碱基投放顺序和循环数,根据程序给定的剂量,在试剂舱中相应的孔中加入酶混合物、底物混合物以及4种碱基,将试剂舱和96孔测序板放入焦磷酸测序仪PyroMark Q96ID的机箱中进行测序反应,反应完毕,仪器自动给出测序结果,对测序结果进行在线BLAST分析,并比较其序列特异性。
1.2.4 特异性检测
从GenBank中选择沙门达病毒(Shamonda virus)、萨苏伯里病毒(Sathuperi virus)、道格拉斯病毒(Douglas virus)、赤羽病病毒(Akabane virus)和艾罗病毒(Aino virus)M基因完整的编码序列,由大连宝生物公司进行基因合成并插入到pMD19-T载体中,分别构建重组质粒。以上述重组质粒为对照样品,以pMD19-T-SBVM重组质粒为阳性对照,以ddH2O为阴性对照,进行特异性检测。PCR扩增结束,以1.5%的琼脂糖凝胶电泳检测。
1.2.5 样品检测
采用本研究所建立的基于M基因的SBV焦磷酸测序方法对德国FLI病毒诊断实验室惠赠的SBV(BH80株)RNA样品进行RT-PCR扩增。50μL反应体系:10×One Step RNA PCR Buffer 5μL、25mol/LMgCl210μL、10mmol/LdNTP 5μL、40U/LRNase Inhibitor 1μL、5U/LAMV Optimized Taq 1μL、5U/μLAMV RTase XL 1μL、10mmo/ L上下游引物各1μL、SBV RNA 5μL、无RNA酶双蒸水补充至50μL。反应条件:50℃反转录30min;94℃热灭活反转录酶2min;94℃变性30s,58℃退火30s,72℃延伸30s,进行50个循环;72℃延伸8min。
RT-PCR扩增完毕,电泳检测后取10μLRTPCR扩增产物按照1.2.3.2所述操作步骤进行单链分离及测序试验,测序完毕,仪器自动给出测序结果,比较检测结果。
2 结果
2.1 检测靶基因的筛选
2.1.1 重组质粒PCR扩增产物分析
利用设计的SBV-S、SBV-M、SBV-L基因的特异引物,经PCR扩增后,10倍系列稀释梯度质粒的PCR扩增产物电泳结果见图1。SBV-S基因的目的片段长度为189bp,107-104拷贝/μL重组S基因质粒均得到了与预期大小一致的目的条带;SBV-M基因的目的片段长度为250bp,107-104拷贝/μL重组M基因质粒均得到了与预期大小一致的目的条带;SBV-L基因的目的片段长度为344bp,107-105拷贝/μL重组L基因质粒均得到了与预期大小一致的目的条带。根据PCR扩增产物的电泳结果,可以看出S基因和M基因的扩增效率比较高,L基因扩增效率较低,不再进行后续测序研究。
2.1.2 S、M基因PCR产物的焦磷酸测序

图1 SBV S、M、L三基因重组梯度质粒PCR扩增产物的琼脂糖凝胶电泳分析
根据电泳结果,选择SBV S、M两基因重组梯度质粒的PCR扩增产物进行焦磷酸测序,测序结果见图2。其中,SBV S基因107-104拷贝/ μL质粒的PCR扩增产物均可测得一致序列:TAAGGGATGC ACCTGGGCCG ATGGTTATAC AATGTATCTT GGATTTGC,将此序列在网上进行BLAST分析,结果与SBV序列的一致性可达100%,但是该序列与道格拉斯病毒(Douglas virus)序列的一致性也为100%,因此通过该序列来达到SBV的鉴别诊断比较困难。SBV M基因107-104拷贝/μL质粒的PCR扩增产物均可测得一致序列:TGGAGAAAGC CTCTTTTCCA TTATTATCTA TG,将此序列在网上进行BLAST分析,结果显示序列一致性为100%的均为SBV,表明该序列的特异性较好,可以用作SBV基因序列水平上的精准检测。
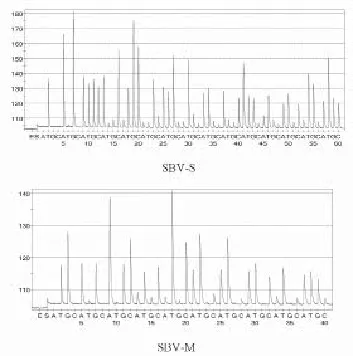
图2重组梯度质粒PCR产物的焦磷酸测序结果
2.2 特异性检测结果
以构建的沙门达病毒、萨苏伯里病毒、道格拉斯病毒、赤羽病病毒和艾罗病毒的重组质粒为
对照样品,以pMD19-T-SBVM重组质粒为阳性对照,以ddH2O为阴性对照进行PCR扩增,扩增结束,以1.5%的琼脂糖凝胶电泳检测,结果见图3。从图3可以看出,只有阳性对照扩增出了目的片段,其余均未见目的条带,表明,本研究所设计的SBV-M基因的扩增引物具有较好的特异性。
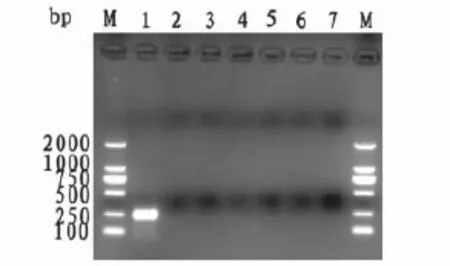
图3 SBV-M基因PCR扩增的特异性检测
2.3 SBV(BH80株)RNA RT-PCR扩增产物分析
以SBV-M基因的特异性引物对德国FLI病毒诊断实验室惠赠的SBV RNA进行RT-PCR扩增后,以1.5%的琼脂糖凝胶电泳检测,得到了与预期大小一致的目的片段(图4)。
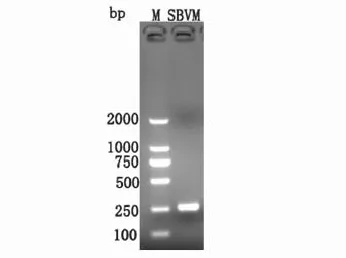
图4 SBV(BH80株)RNA RT-PCR扩增产物的琼脂糖凝胶电泳分析
2.4 SBV(BH80株)RNA RT-PCR扩增产物的焦磷酸测序检测结果
对SBV(BH80株)M基因的RT-PCR扩增产物进行焦磷酸测序,反应结束,仪器自动给出的测序结果为:TGGAGAAAGC CTCTTTTCCA TTATTATCTA TGTCAGAAGA GT(图5),将此序列在网上进行BLAST分析,结果表明序列一致性为100%的均为SBV,验证了本研究建立的焦磷酸测序检测方法可以精确鉴别施马伦贝格病毒。

图5 SBV(BH80株)RNA RT-PCR产物的焦磷酸测序结果
3 讨论
施马伦贝格病是一种新发动物疫病。自FLI在德国奶牛场首次确诊该病以来,荷兰、比利时、法国、俄罗斯、土耳其等数十个国家相继报道了该病的爆发与流行[1,7-8],该病具有非常强的跨境传播能力,给相关国家的养殖业造成了巨大经济损失。截至目前,我国未见该病的相关报道,因此,加强口岸检疫,严防该病的侵入,成为防治该病的重中之重,这就需要我们加强该病的检测技术研究,为该病的检测做好技术储备。目前,该病的诊断方法主要有病毒的分离与鉴定方法[1,9]、血清学方法[4-5,10-11]、分子生物学方法[1,4,12],其中病毒的分离与鉴定是确诊该病的最好方法,血清学方法中的ELISA检测已有商业化试剂,在分子生物学方面,目前德国FLI和我国的张永宁等均已针对SBV的S基因建立了施马伦贝格病的荧光定量RT-PCR检测方法[12-13]。
SBV属于布尼亚病毒科(Bunyaviride)正布尼亚病毒属(Orthobunyavirus)辛波血清群(Simbu serogroup)。由于SBV与辛波血清群的沙门达病毒、萨苏伯里病毒、道格拉斯病毒、赤羽病毒和艾罗病毒等亲缘关系很近[1,14],为了更好的建立一种敏感、特异的检测方法,本研究选择SBV S、M、L三基因同时开展焦磷酸测序研究,通过试验筛选最佳的检测靶基因建立SBV焦磷酸测序检测方法。通过序列比对分析,分别选择SBV S、M、
L基因的保守区域利用焦磷酸测序仪携带的引物设计软件设计测序专用的扩增引物(生物素标记)和测序引物,并对PCR反应条件及反应体系进行优化,争取以最少用量的反应成分进行试验,防止反应体系中过多的生物素标记引物或者其他反应成分均会对后续试验造成影响,使得检测结果不准确。以最佳的反应体系扩增梯度稀释的重组质粒,扩增完毕以1.5%琼脂糖凝胶电泳检测PCR扩增产物,电泳结果显示107-104拷贝/μL重组S基因质粒均扩增出了目的条带,107-104拷贝/μL重组M基因质粒均扩增出了目的条带,107-105拷贝/μL重组L基因质粒均扩增出了目的条带,根据电泳检测结果得出,S、M基因的扩增效率较高,敏感性高,L基因的扩增效率较差,因此,选择S和M基因进行后续的测序研究。取适量S和M基因的PCR产物上机进行测序,反应结束仪器自动给出测序结果。其中107~104拷贝/μL重组S基因质粒PCR扩增产物的测得序列一致,均为:TAAGGGATGC ACCTGGGCCG ATGGTTATAC AATGTATCTT GGATTTGC,将此序列在网上进行BLAST分析,结果与SBV序列的一致性可达100%,但是该序列与道格拉斯病毒序列的一致性也为100%,因此通过该序列来达到病毒的鉴别诊断比较困难。重组M基因质粒107-104拷贝/μL的PCR扩增产物的测得序列一致为:TGGAGAAAGC CTCTTTTCCA TTATTATCTA TG,将此序列在网上进行BLAST分析,结果显示序列一致性为100%的均为SBV,表明该序列的特异性较好,可以用作SBV基因序列水平上的精准检测。为进一步验证M基因PCR扩增引物的特异性,本研究以构建的沙门达病毒、萨苏伯里病毒、道格拉斯病毒、赤羽病病毒和艾罗病毒的重组质粒为对照样品,以pMD19-T-SBVM重组质粒为阳性对照,以ddH2O为阴性对照进行了特异性检测,结果表明本研究所设计的SBV-M基因的PCR扩增引物具有较好的特异性。通过上述试验可以得出,M基因无论在扩增效率、敏感性和特异性方面,还是在测序结果上都取得了比较满意的结果,因此将M基因作为焦磷酸测序检测方法的靶基因。
应用所建立的SBV-M基因的焦磷酸测序检测方法检测德国FLI实验室提供的SBV RNA样品,将测序结果进行Blast分析,结果显示与SBV序列一致性达到100%,因此可将样品判断为SBV感染。本研究所采用的焦磷酸测序技术不仅具有经典Sanger DNA测序法的高精确性,还具有高通量、高自动化、高效、简单易行、省时省力等其他检测技术不可比拟的优点[15],所建立的SBV-M基因的焦磷酸测序检测方法在普通RT-PCR扩增的基础上,辅以基因序列水平上的目的片段测序,减少了由于RT-PCR敏感性高而出现的假阳性结果,大大提高了检测特异性[16],使检测结果更加准确。
综上,本研究建立了施马伦贝格病毒基于RTPCR的焦磷酸测序检测方法能够从基因序列水平上对SBV进行精准检测鉴定,为SBV的检测提供了一种高通量、快速、灵敏、特异的精准检测技术,为施马伦贝格病的检疫提供了很好的技术储备。
[1] Hoffmann B,Scheuch M,Höper D,et al. Novel orthobunyavirus in Cattle,Europe,2011[J]. Emerg Infect Dis,2012,18(3):469-472.
[2] Doceul V,Lara E,Sailleau C,et al. Epidemiology,molecular virology and diagnostics of Schmallenberg virus,an emerging orthobunyavirus in Europe[J]. Vet Res,2013,44:31.
[3] Fischer M,Hoffmann B,GollerK V,et al. A mutation ‘hot spot’ in the Schmallenberg virus M segment[J]. J Gen Virol,2013,94:1161-1167.
[4] Bilk S,Schulze C,Fischer M,et al. Organ distribution of Schmallenberg virus RNA in malformed newborns[J]. Vet Microbiol,2012,159(1/2):236-238
[5] Bréard E,Lara E,Comtet L,et al. Validation of a commercially available indirect ELISA using a nucleocapside recombinant protein for detection of Schmallenberg virus antibodies[J]. PLOS One,2013,8:e53446
[6] 陈之遥,周国华. 焦测序技术的研究进展[J]. 现代生物医学进展,2008,8(8): 1573-1598.
[7] 张永宁,吴绍强,刘建,等.欧洲暴发施马伦贝格病疫情及我国应采取的对策[J].中国兽医杂志,2012,48(4):92-95.
[8] Beer M,Conraths F J,Van der Poel W H. ‘Schmallenberg virus’—a novel Orthobunyavirus emerging in Europe[J]. Epidemiol Infect,2013,141(1):2802-2803.
[9] van der Heijden H M,Bouwstra R J,Mars M H,et al. Development and validation of an indirect Enzyme-linkedimmunosorbent assay for the detection of antibodies against Schmallenberg virus in blood samples from ruminants[J]. Res Vet Sci,2013,95(2):731-735.
[10] Loeffen W,Quak S,de Boer-Luijtze E,et al. Development of a virus neutralization test to detect antibodies against Schmallenberg virus and serological results in suspect and infected herds[J].Acta Vet Scand,2012,54,44.
[11] Zhang Y,Wu S,Wang J,et al. Expression and purification of the nucleocapsid protein of Schmallenberg virus,and prepatation and characterization of a monoclonal antibody against this protein[J]. Protein Expr Purif,2013,92:1-8.
[12] Hoffmann B,Schulz C,Beer M. First detection of Schmallenberg virus RNA in bovine semen,Germany,2012[J].Vet Microbiol,2013,167(3/4):289-295.
[13] 张永宁,吴绍强,吕继洲,等. 施马伦贝格病毒荧光定量RT-PCR检测方法的建立、验证与初步应用[J].畜牧兽医学报,2014(已收录,待发表).
[14] Goller K V,Hoper D,Schirrmeier H,et al. Schmallenberg virus as possible ancestor of Shamonda virus[J]. Emerg Infect Dis,2012,18(10):1644-1646.
[15] 徐保红,李秀娟,杨芳,等.PCR-焦磷酸测序法快速鉴定副溶血性弧菌[J].预防医学情报杂志,2011,27(1):78-80.
[16] 王彩霞,林祥梅,邓俊花,等.基于PCR及焦磷酸测序技术的单孢子虫鉴定技术研究与应用[J].渔业科学进展,2011,32(5):92-96.
Development of PCR-Pyrosequencing Assay for Detection of Schmallenberg Disease
Wang Caixia,Lin Xiangmei,Zhang Yongning,Lv Jizhou,Feng Chunyan,Yuan Xiangfen,Deng Junhua,Wu Shaoqiang
(The Institute of Animal Quarantine,Chinese Academy of Inspection and Quarantine,Beijing 100029)
To meet the rapid,accurate and high throughput detection of Schmallenberg disease,a pyrosequencing assay was developed in combination with PCR amplif cation of the target sequences. Pyrosequencing specif c primers of SBV segments of S,M and L were separately designed targeting the conserved region of the sequence using primer designer software PyroMark Q96ID. PCR-pyrosequencing assay of SBV S,M,L were established with the recombinant plasmid of SBV S,M,L as template,and the sequences were determined by PyroMarkTMID System. SBV RNA presented by FLI was used as positive material to validate the developed PCR-pyrosequencing assay. Comparing the electrophoresis result of PCR amplicons,the result of pyrosequencing assay and the result of specif city detection,the pyrosequencing assay targeting M gene was the best one among the assays targeting S,M and L genes. The developed SBV-M pyrosequencing assay was further verif ed by using the SBV positive RNA material as template by means of Blast analysis of obtained sequence online. Results showed that the developed pyrosequencing assay could identify SBV. The method was of high sensitivity,good stability and high specif city,and could be used as an accurate detection method for Schmallenberg disease .
Schmallenberg disease; polymerase chain reaction; pyrosequencing; identif cation; detection
S852.659.5;S858.23
:A
:1005-944X(2014)10-0057-06

