毛细管电泳在线富集技术在季铵盐农药检测中的应用
张庆庆,王燕燕,张文芳
(1.中国人民公安大学刑事科学技术系,北京100038;2.北京市公安局法医鉴定中心,北京100192)
毛细管电泳在线富集技术在季铵盐农药检测中的应用
张庆庆1,王燕燕2,张文芳2
(1.中国人民公安大学刑事科学技术系,北京100038;2.北京市公安局法医鉴定中心,北京100192)
季铵盐类农药属于极性强的碱性有机阳离子化合物,用常规气相色谱方法分析较困难,而高效毛细管电泳很适合分离季铵盐这类离子化合物。由于进样量以及检测器灵敏度的制约,毛细管电泳通常要使用在线富集技术提高其浓度检测限。针对季铵盐阳离子的特性,具体探讨了用毛细管电泳分析此类阳离子化合物的几种在线富集技术,也可为检测其他类似分析物起到借鉴作用。
季铵盐农药;毛细管电泳;阳离子;在线富集
一、引言
农业生产中常用的季铵盐农药有百草枯(PQ)、敌草快(DQ)、燕麦枯(DF)、甲哌啶(MQ)和矮壮素(CQ),属中低毒类农药,都是极性强的易溶于水的碱性有机阳离子化合物,易残留,且易产生环境和健康风险问题。此类农药检测方法有光谱法[1][2]、气相色谱-质谱法(GC-MS)[3][4]、液相色谱紫外检测法(LCUV)[5][6]、液相色谱-质谱联用法(LC-MS)[7][8]及酶联免疫法(ELISA)[9][10]等。
用气相色谱分析季铵盐比较困难,需要用还原剂将其还原。目前主流的反相液相色谱分析,需在流动相中添加离子对试剂增加其在柱上的保留性,但离子对试剂会影响质谱的检测灵敏度。近年来,虽然已研制出了无须添加离子对试剂的亲水性色谱柱,但PQ和DQ峰仍难基线分离,影响色谱的准确定量[11]。用毛细管电泳(CE)分离季铵盐时,PQ和DQ则很容易就能基线分离,分离效率高、出峰快,很适合于分离检测季铵盐类极性化合物。但毛细管检测光程短,检测体积小(只有液相检测池的1/100),最常配备的二极管阵列(PDA)检测器的灵敏度(检测限10-5~10-6mol/L)远不及激光诱导荧光(LIF)检测器(检测限10-14mol/L)[12]。而且MQ和CQ不含紫外生色团,在使用紫外检测器时,需用间接紫外检测的方法,而间接检测法本身的灵敏度不高[13]。CE-MS(毛细管-质谱法)能解决定性的问题,同时检测五种季铵盐,但已有的方法灵敏度不是很理想[14]。针对灵敏度低的问题,在没有高灵敏度检测器的情况下,需考虑结合在线富集或离线预处理等方法提高灵敏度。而在线富集技术只需要调整背景缓冲液以及进样程序就能将灵敏度提高几个数量级,极大地降低了浓度检测限,因此被广泛运用于CE分析中。
能用于季铵盐阳离子检测的毛细管电泳富集模式有:(1)毛细管区带电泳(Capillaryzoneelectrophoresis,CZE)。包括场放大堆积(Field-amplifiedsample stacking,FASS);大体积堆积(Large-volume sample stacking,LVSS);pH-修饰堆积(pH-mediated-stacking)。(2)胶束毛细管电动色谱(Micellarelectrokinetic chromatography,MEKC)。包括常规的胶束电动(Nor mal-stacking MEKC);扫集-胶束电动(Sweeing-M EKC);阳离子选择性耗尽进样-扫集-胶束电动(Cation-selective exhaustive injection-sweepin g-micellarelectrokinetic chromatography,CSEI-sweeping-MEK C)。(3)等速电泳(Isotachophoresis,ITP)。
二、毛细管区带电泳富集
(一)场放大样品堆积(FASS)
将样品制备在低电导基质中,毛细管经背景电解质溶液(BGS)平衡后,压力引进少量低电导溶液(通常是水),在毛细管进样端形成一个高电场的区域。电动进样时,分析物离子会很快通过低电导区域迁移到达样品区带和BGS的边界,随后因电场强度下降导致迁移速度变慢从而聚焦在边界附近。FASS富集效果显著,操作简单,但若没有水柱,分析物离子容易堆积在顶端进样口处,造成富集效应退化。

图1 毛细管电泳场放大分离季铵盐示意图
季铵盐在pH1~14的范围内几乎都能完全电离,成为高度溶剂化、质子化的阳离子,而缓冲液pH值主要是影响毛细管壁硅羟基的电离进而影响电渗流(EOF)大小。Galceran[15]等分析了pH值、温度、电压、缓冲阳离子浓度、进样模式等人对迁移时间、表观淌度、峰高等参数的影响。另外,在缓冲溶液中添加一定比例的乙腈能改善PQ和DQ间的分离度和基线稳定性[16]。为改善重现性,有时采用两端同时加压来避免因焦耳热产生的气泡[17]。
(二)大体积堆积(LVSS)
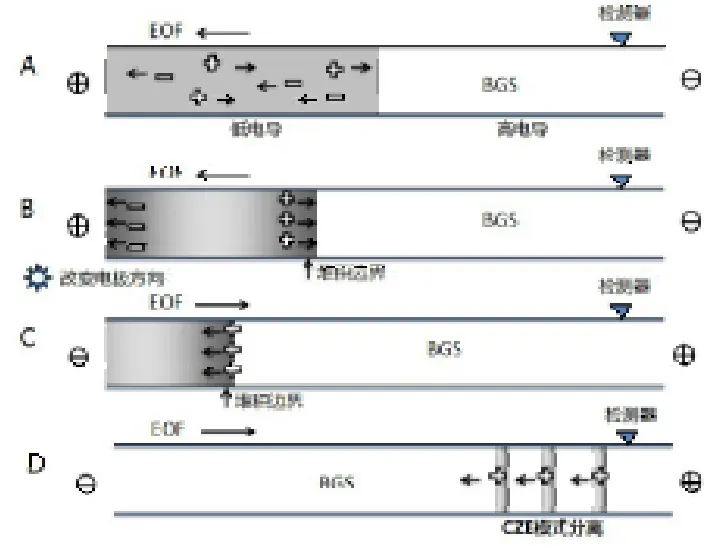
图2 毛细管电泳大体积进样分离季铵盐示意图
LVSS检测季铵盐时,需要加入十六烷基三甲基溴化铵(CTAB)等改性剂使电渗流逆转。样品溶解在低电导液中,毛细管充满BGS后进样,常采取整管进样方式,将样品溶液灌满整根毛细管后,施加正向分离电压。此时,电渗流朝向入口端,而阳离子分析物则朝向出口检测端迁移,堆积在样品区带和BGS边界,阴离子和中性离子向入口端迁移,慢慢地退出毛细管。仔细监测工作电流,直至上升接近原始值的95~99%后改变电压方向进行正常的电泳分离。变成负电压后电渗流逆转,推动逆流的阳离子向检测端迁移。Núñez[18]结合固相萃取使用该富集方式检测饮用水中三种季铵盐除草剂。此外,LVSS也可以采用不改变电压方向的方式进行,但BGS的pH<3,此时电渗流受到抑制[19]。LVSS方式不能同时分离检测阴离子和阳离子,更适用于检测淌度不大的离子,且操作不容易控制。
(三)pH-修饰堆积(pH-mediated-stacking)
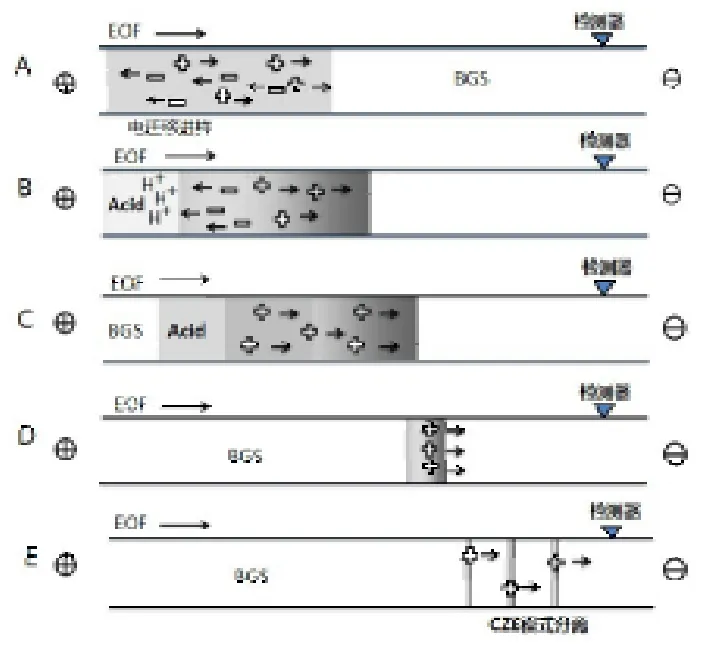
图3 pH酸修饰富集分离季铵盐示意图
在FASS和LVSS中,为了实现富集,样品采用水或者低电导缓冲液配制,而常见的生物样本为电解质溶液,离子强度大,需要繁琐的前处理过程来进行提取和净化。pH-修饰富集是对高电导样本采用酸碱中和作用的一种富集方法,即用酸或碱中和样品中的高电导基质,形成低电导区带而堆积样品。这种技术可用于分离富集低浓度、高离子强度的样品,能避免由于样品区带的导电性高于背景电解质而导致的去堆积现象[20]。在高离子强度基质的样品电动进样后,再电动进样一段强酸,强酸中的质子在电动进样时快速向样品区带迁移,中和其中的弱酸根离子,使样品区带变成电中性,电导率降低,促使待测物离子的迁移速度加快,堆积在边界处。该方式目前还没有人应用于季铵盐农药检测中。
三、毛细管胶束电动富集
(一)常规的胶束电动(MEKC)

图4 常规的胶束电动毛细管色谱堆积分离季铵盐示意图
CZE是基于溶质淌度差异进行分离的,而MEK C则是基于溶质在胶束中的不同分配进行分离的。将样品制备于低电导的缓冲溶液中,背景缓冲液含有能形成胶束的SDS(十二烷基硫酸钠),再将毛细管充满缓冲液,注射样品溶液之后,施加正向电压以MEKC模式分离,分析物在含有胶束的缓冲液中迁移堆积[21]。
(二)扫集-胶束电动(Sweeing-MEKC)

图5 反向电压扫集-胶束电动分离季铵盐示意图
Sweeping-MEKC中所有溶液要保持低pH值抑制电渗流,制备样品用的基体溶液与背景缓冲溶液的导电性基本相同,样品溶液中不加固定相。BGS是含表面活性剂的胶束缓冲液,样品可溶解在没有胶束的缓冲液中,当BGS和样品溶液注入完成后,运行负电压,阴离子向入口端移动,阳离子向出口端移动,SDS胶束进入毛细管样品溶液区带扫集分析物。赵燕燕[22]在检测血清中的PQ时,比较分析了Swee ping-MEKC与紫外分光光度这两种测试方法。
(三)阳离子选择性耗尽进样-扫集-胶束电动(CS EI-sweeping-MEKC)

图6 阳离子选择性耗尽电动分离季铵盐示意图
毛细管首先用不含胶束的BGS预处理,再引入高电导率的缓冲溶液(不含有机溶剂),随后引进一段水柱施加正向电压电迁移进样(样品制备在低电导率介质中),之后将毛细管两端置于含胶束的BGS下施加负电压分离。该方法将扫集与场放大样品技术联用,先用电动进样使样品堆积,再用胶束扫集使样品第二次富集,因此,能明显地提高富集效果,方法选择性强,适合样品中痕量及超痕量组分的分离分析。因相反电荷分析物与SDS之间存在强烈的相互作用,CSEI-sweeping-MEKC在线阳离子浓缩用阴离子SDS胶束能提供高的选择性富集[23]。Núñez[21]比较了MEKC、Sweeping-MEKC、CSEI-Sweeping-M EKC这三种在线富集方式,结果Sweeping-MEKC的富集倍数是500倍,而CSEI-Sweeping-MEKC的富集倍数达到了5万倍,检测限均小于1ug/ml。
四、毛细管等速电泳富集

图7 毛细管等速电泳分离季铵盐示意图
用两种淌度差别大的缓冲体系分别构成前导离子(Leading ion)和尾随离子(Terminating ion),将试样像夹心饼干一样夹在二者之间。因前导离子淌度最大,迁移最快,因而走在最前,其后是淌度次之的离子。所有溶质都按前导离子的速度等速前移,并形成独立的溶质区带而得到分离[24]。Kaniansky[25]和Walker[26]等人用该方法检测过水样中的PQ和DQ,但这种方式操作并不简便,检测限也不理想,因此使用不多。
五、结论
比较以上几种富集模式,其中FASS的富集效果好且操作简便;而CSEI-sweeping-MEKC的富集倍数最高,但操作较复杂;pH-修饰更适于生物高盐样本;LVSS能避免因离子淌度差异引起的进样歧视问题。因此,实践中可依据实际情况选择适合的富集模式。应用在线富集技术,无需对仪器进行改造就能降低浓度的检测限,大幅提高仪器的检测灵敏度,使得CE技术在分析领域有了更广阔的应用。
【参考文献】
[1]Quintás G,Garrigues S,Pastor A,et al.FT-Raman determination of Mepiquat chloride in agrochemical products[J].Vibrational spectroscopy,2004(1):41-46.
[2]白云,范川鹏,李素燕等.紫外分光光度法测定血液中的百草枯[J].国际检验医学杂志,2013(11):1421-1422.
[3]PosecionNC,OstreaEM,BielawskiDM.Quantitativedetermination of paraquat in meconium by sodium borohydride-nickel chloride chemical reduction and gas chromatography/mass spectrometry(GC/MS)[J].Chromatography B,2008(1-2):93-99.
[4]Saito T,Fukushima T,Yui Y,etal.Monolithic spin column extraction and GC-MS for the simultaneous assay of diquat,paraquat, and fenitrothion in human serum and urine[J].Anal Bioanal Ch em.2011(1):25-31.
[5]Fuke C,Arao T,Morinaga Y,etal.Analysis of paraquat,diquat and two diquat metabolites in biological materials by high-performance liquid chromatography[J].Leg Med,2002(3):156-163.
[6]Merritt T J S,Douglas L,Rzezniczak T Z,et al.Rapid and simple analysis of paraquat in tissue homogenate by ultra-high performance liquid chromatography[J].Analytical Methods,2011(6): 1428-1432.
[7]Bassarab P,Williams D,Dean J R,et al.Determination of quaternary ammonium compounds in seawater samples by solid-phase extraction and liquid chromatography-mass spectrometry[J].Chr omatography A,2011,1218(5):673-677.
[8]张曦,金芬,钱永忠等.高效液相色谱-串联质谱法测定樱桃番茄中的四种季铵类农药[J].食品工业科技,2011(6):394-397.
[9]Garcia-Febrero R,Salvador J,Sanchez-BaezaF,etal.Rapid method based on immunoassay for determination of paraquat residues in wheat,barley and potato[J].Food Control,2014:193-201.
[10]Koivunen M E,Gee S J,Park E K,et al.Application of an Enzyme-Linked Immunosorbent Assay for the Analysis of Paraquat in Human-Exposure Samples[J].Arch Environ Contam Toxicol. 2005(2):184-190.
[11]李红梅,孙守威,史谢飞.高效安全的敌草快和百草枯液相色谱分离分析技术[J].分析化学,2007(10):1499-4502.
[12]赵新颖,任占军,孙杰等.毛细管电泳技术及其应用进展[J].上海工程技术大学学报,2006(2):140-143.
[13]Galceran M T,Carneiro M C,Diez M,et al.Separation of quaternary ammonium herbicides by capillary electrophoresis with indirectUV detection[J].Journalof ChromatographyA,1997(2): 289-295.
[14]O.Núñez,J.Kim,E.Moyano,et al.Capillary electrophoresismass spectrometry for the analysis of quaternary ammonium herbicides[J].Chromatography A,2002:243-255.
[15]Galceran M T,Carneiro M C,Puignou L.Capillary Electrophoresis of Quaternary Ammonium Ion Herbicides:Paraquat,Diquat and Difenzoquat[J].Chromatographia,1994(9):581-586.
[16]Pérez-Ruiz T,Martínez-Lozano C,Sanz A,et al.Simultaneous Determination of Diquat and Paraquat Residues in Various Matrices by Capillary Zone Eiectrophoresis with Diode Array Detection[J].Chromatographia,1996(9):468-472.
[17]王明明,沈菁,宋婷等.场放大样品进样-压力辅助毛细管区带电泳测定饮用水中的百草枯[J].分析化学,2012(5):809-810.
[18]Núñez O,Moyano E,Galceran M T.Solid-phase extraction and sample stacking-capillary electrophoresis for the determination of quaternary ammonium herbicides in drinking water.Journalof Chromatography A,2002(1-2):275-282.
[19]Quirino J P,Terabe S.Large volume sample stacking of positively chargeable analytes in capillary zone electrophoresis without polarity switching:Use of low reversed electroosmotic flow induced by a cationic surfactant at acidic pH[J].Electrophoresis, 2000(2):355-359.
[20]Weiss D J,Saunders K,Lunte C E.pH-Mediated field-amplified stacking of pharmaceutical cation in high-ionic strength samples [J].electrophoresis,2001(1):59-65.
[21]Núñez O,Kim J B,Moyano E,etal.Analysis of the herbicides paraquat,diquat and difenzoquat in drinking water by micellar electrokinetic chromatography using sweeping and cation selective exhaustive injection[J].Chromatogr A,2002(1):65-75.
[22]赵燕燕,刘会芳,王丽娟等.推扫富集胶束电动毛细管色谱法和紫外分光光度法测定血液灌流前后血清中百草枯浓度的比较[J].应用化学,2008(9):1069-1072.
[23]QuirinoJP,IwaiY,OtsukaK,etal.Determination ofenvironmentallyrelevantaromaticaminesin thepptlevelsbycationselective exhaustiveinjection-sweeping-micellar electrokinetic chromatog raphy[J].Electrophoresis,2000(14):2899-2903.
[24]傅若农.色谱分析概论(第二版)[M].北京:化学工业出版社,20 08:220.
[25]Kaniansky D,IvanyiF,OnuskaFI.Onlineisotachophoreticsample pretreatment in ultratrace determination of paraquat and diquat in water by capillary zone electrophoresis[J].Analytical Che mistry,1994(11):1817-1824.
[26]Walker P A,Shaver J M,Morris M D.Identification of cationic herbicides in deionized water,municipal tap water,and river water by capillary isotachophoresis/on-line Raman spectroscopy[J]. Applied spectroscopy,1997(9):1394-1399.
D631
A
1673―2391(2014)08―0165―04
2014-07-15责任编校:江流
公安部科技强警基础工作专项项目(编号:2013GABJC002)。

