脉搏指示连续心排血量监测在脓毒症休克治疗中的应用
杨宏锋,金兆辰,吉木森,张清艳,蔡 燕,吕韶燕
(江苏大学附属人民医院,江苏镇江212000)
脓毒症休克是以全身感染导致器官功能损害为特征的一组复杂临床综合征,发病率及病死率均很高。近年来,随着新型抗生素及以早期复苏治疗为核心的早期加强治疗的广泛应用,脓毒症休克患者的抢救成功率明显提高,但常并发多脏器功能障碍如心肌抑制、急性肝肾功能损伤、毛细血管渗漏、急性肺损伤等。2009年1月~2012年12月,我们在32例脓毒症休克患者治疗过程中进行脉搏指示连续心排血量(PiCCO)监测,效果满意。现报告如下。
1 资料与方法
1.1 临床资料 同期于我院住院治疗的脓毒症休克患者60例,男36例,女24例;年龄25~80(49± 9.15)岁。急性生理与慢性健康评分表(APACHEⅡ)评分为(18.32±5.28)分。纳入标准:有明确感染临床表现;存在全身炎症反应综合征(SIRS);收缩压<90 mmHg或较原基础值下降幅度>40 mmHg (至少1 h)或需要血管活性药物维持正常血压;有组织灌注不良表现,如少尿(<30mL/h)超过1 h或有急性神志障碍。排除标准:年龄<18岁;失血性休克;濒死状态;导管置入受限,如穿刺部位感染、动脉移植术后等;合并影响PiCCO数值准确性的情况,包括心内分流、重度三尖瓣反流和低温治疗、复温期间[1]。本研究经医院伦理委员会批准,得到患者和家属同意,并签署知情同意书。将60例患者随机分为PiCCO组32例和对照组28例,两组一般资料具有可比性。
1.2 治疗及PiCCO监测方法 两组均早期留取病原学标本,积极行抗感染治疗,留置中心静脉导管(颈内静脉或锁骨下静脉)监测中心静脉氧饱和度(ScvO2)、中心静脉压(CVP)及平均动脉压(MAP)。在此基础上,PiCCO组留置脉搏指示连续心排血量(PiCCO)监测仪导管以及中心静脉导管行PiCCO监测,目标是维持ScvO2>70%:①采用德国PiCCO监测仪,输入患者的体质量、身高等数据,将加压输液袋连接好压力传感器,动脉压调零后开始监测。经中心静脉导管快速(4 s内)注射冰生理盐水15mL,重复3次(3次测量数值之间差异应<10%),利用单指示剂热稀释法原理及动脉脉搏轮廓分析和计算得出心输出量和心指数(CO和CI)、胸腔内血容量指数(ITBVI)、血管外肺水指数(ELWI)、心脏舒张末容积指数(GEDI)、每搏量变异(SVV)、脉压变异(PPV)及肺血管通透性指数(PVPI)等参数。行持续床边血液滤过(CRRT)治疗者在CRRT治疗或停机时暂停监测,血容量及温度变化趋于平稳后恢复监测[2,3]。②在血容量和血管外肺水达到最佳负平衡时,给予血管活性药物维持血压≥60 mmHg;ITBVI<850 mL/m2时予500 mL羟乙基淀粉30 min内输注、维持ITBVI在850~1 000 mL/m2(未达目标者重复此治疗),ITBVI>1 000mL/m2时据MAP和CO予硝酸甘油和(或)多巴酚丁胺;ELWI≥10 mL/kg者予呋塞米;MAP<60 mmHg时予0.05μg/(kg·min)去甲肾上腺素、每次增加0.05μg/(kg·min),MAP>100 mmHg时予硝酸甘油0.5~3.0μg/(kg·min);Hb<70 g/L及CO<2.5 L(min·m2)时予多巴酚丁胺2.5μg/(kg·min)。患者临床表现平稳48 h后停止PiCCO监测(控制监测时间≤7 d);发生导管相关性血流感染者,及时拔除中心静脉置管并留取血标本,同时更换新的导管。对照组:按照严重脓毒症和脓毒症休克国际指南(EGDT)[4]治疗:对怀疑有血容量不足的患者进行液体复苏,开始30 min内输注≥1 000 mL晶体液或300~500 mL胶体液,目标是使CVP达到8~12 mm-Hg;在液体复苏同时,静脉给予去甲肾上腺素或多巴胺,使MAP≥65 mmHg;ScvO2<70%、Hct<30%者输注红细胞(使Hct≥30%),仅ScvO2<70%者予正性肌力药物多巴酚丁胺或米力农(使ScvO2>70%)。
1.3 观察指标 记录PiCCO组0、6、12、24、48、72 h监测参数变化;记录两组血管活性药物去甲肾上腺素或多巴胺用量,常规液体(平衡液、聚明胶肽及血浆)输入量,机械通气及血气分析指标,急性肾脏损伤发生例数。
1.4 统计学方法 采用SPSS11.5统计学软件处理数据。计量资料以±s表示,组间比较采用方差分析或成组t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 PiCCO组不同时间点监测参数变化 不同时点ELWI及PVPI均无显著变化;与0、6 h比较,GEDI、SVV、PVV在12、24、48、72 h均有显著变化。详见表1。
2.2 两组血管活性药物用量及常规液体输入量比较 去甲肾上腺素和多巴胺用量 PiCCO组分别为(22.6±22.0)、(900±150)μg/min,对照组分别为(35.0±28.0)、(1 000±230)μg/min,两组比较P均<0.05;PiCCO组和对照组72 h内常规液体输入量分别为(12 680±2 540)、(10 860±2 160)mL,两组比较P<0.05。
2.3 两组机械通气及血气分析指标比较 两组6~72 h机械通气及血气分析指标均发生显著变化,但组间比较无显著差异。详见表2。
2.4 急性肾脏损伤发生例数 PiCCO组2例(6.3%)、对照组8例(28.6%)出现急性肾脏损伤,两组比较,P<0.05。
表1 PiCCO组不同时点监测参数变化(±s)
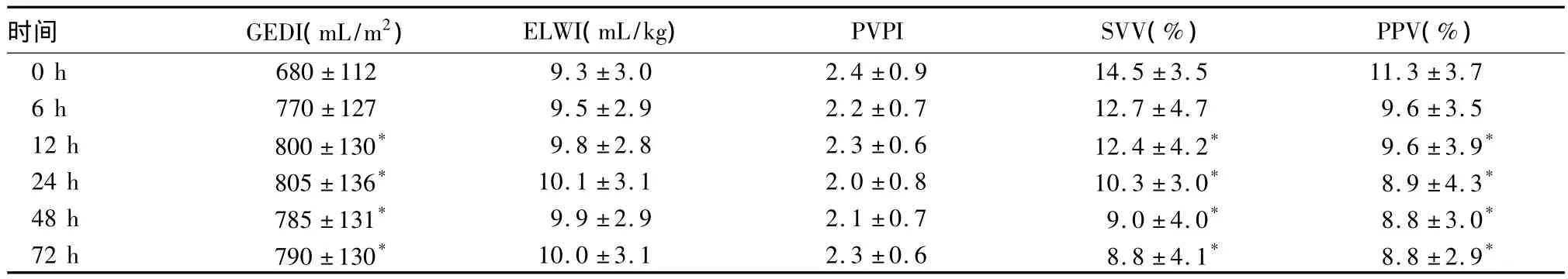
表1 PiCCO组不同时点监测参数变化(±s)
注:与0 h比较,*P<0.05
时间 GEDI(mL/m2) ELWI(mL/kg) PVPI SVV(%) PPV(%) 0 h 680±112 9.3±3.0 2.4±0.9 14.5±3.5 11.3±3.7 6 h 770±127 9.5±2.9 2.2±0.7 12.7±4.7 9.6±3.5 12 h 800±130* 9.8±2.8 2.3±0.6 12.4±4.2* 9.6±3.9* 24 h 805±136* 10.1±3.1 2.0±0.8 10.3±3.0* 8.9±4.3* 48 h 785±131* 9.9±2.9 2.1±0.7 9.0±4.0* 8.8±3.0* 72 h 790±130* 10.0±3.1 2.3±0.6 8.8±4.1* 8.8±2.9*
表2 两组机械通气及血气分析指标比较(±s)
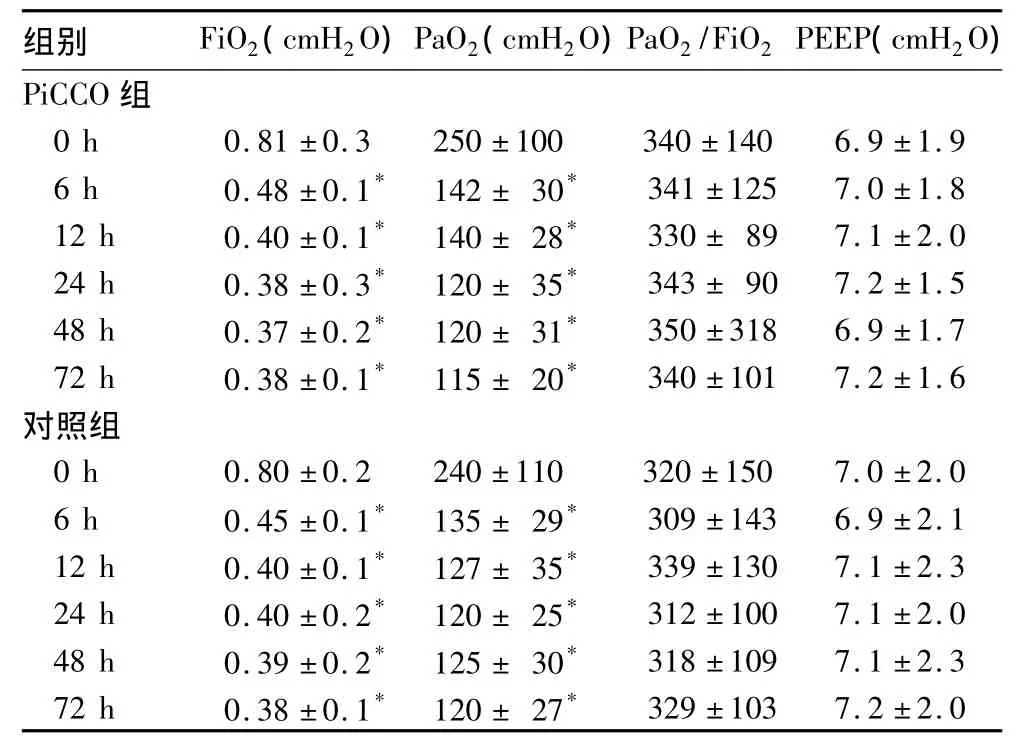
表2 两组机械通气及血气分析指标比较(±s)
注:与同组0 h比较,*P<0.05
?
3 讨论
脓毒症休克患者易发生多脏器功能障碍,且器官损害常表现为功能性。Hotchkiss等[5]对20例死于脓毒症和多脏器功能障碍患者进行的尸检显示,均未见肾小球或肾小管凋亡,13例(65%)有急性肾功能衰竭的临床表现,但只有1例有肾脏坏死的证据;其他重要脏器(心脏、肺脏和肝脏)的情况也类似,只有少量细胞发生坏死和凋亡,与严重功能障碍的临床表现不相符。对于存活的脓毒症休克患者,其大多数衰竭器官的功能均能恢复至基础水平;而早期积极给予液体复苏能使脓毒症患者保持有效循环血容量,通过增加心脏前负荷来增加CO,从而增加器官组织灌注,并维持组织、细胞的氧供需平衡,进而减少脏器功能障碍。在血流动力学监测指导下的液体治疗常更易达到预期目标,但CVP水平或CVP的改变与液体反应性无关[6]。
既往肺动脉导管曾被认为是血流动力学监测的最佳途径[7~9],但最近研究[8]证实,PiCCO与肺动脉导管测量有很好的相关性,且与肺动脉导管相比有以下优点:①损伤较小,肺栓塞、肺动脉破裂和心律失常发生率低[10]。②可测量GETI和ELWI。其中GETI反应心脏前负荷的敏感性优于血流灌注压(如CVP和肺毛细血管嵌压)[11~13];ELWI是评估肺水肿的一种定量指标,其指导下的液体治疗在患者预后及机械通气中均有重要价值[14~16]。③可通过连续监测CO及时发现危重患者病情变化,并指导药物调整。④可综合分析液体参数并据以指导临床治疗方案[17]。临床应用PiCCO测定ELWI、GETI和ITBVI已经得到公认,其测定方法简单,基本原理如下:心脏和肺可看作由一系列序贯而独立的容积腔组成,股动脉导管检测到的热稀释曲线可看作为每个容积腔稀释曲线的组合,稀释曲线中最长衰变曲线对应的是最大的容积腔,将热稀释曲线进行数学转化后即可得到ITBVI和胸腔内热容量,并根据公式进一步计算出ELWI、GETI。一项最新的Meta分析发现,动力学参数如PPV和SVV变化在机械通气时能更精确地反映患者的液体反应[18]。本研究显示,PiCCO组血管活性药物用量显著少于对照组,72 h内常规液体输入量显著多于对照组,急性肾脏损伤发生例数显著少于对照组;两组6~72 h机械通气及血气分析指标均发生显著变化,但组间比较无显著差异。提示PiCCO指导下的液体复苏所需常规液体量明显高于传统用量、血管活性药物用量显著减少,但对于危重患者的机械通气及血气分析指标影响不大;可降低急性肾脏损伤发生率。可能机制:PiCCO技术可密切监测血管外肺水变化,从而减少液体复苏量不足所致组织、器官潜在损害。本研究不足之处为属单中心、小样本研究,需要以后多中心、大样本的随机对照研究验证。
总之,对脓毒症休克患者进行PiCCO监测,可指导临床进行精确液体复苏等治疗,从而减少急性肾损伤等相关不良事件发生。
[1]Giraud R,Siegenthaler N,Park C,et al.Transpulmonary thermodilution curves for detection of shunt[J].Intensive Care Med,2010,36(6):1083-1086.
[2]Heise D,Faulstich M,Morer O,etal.Influence of continuous renal replacement therpy on cardiac outputmeasurement using thermodilution techniques[J].Minerva Anestesiol,2012,78(3):315-321.
[3]Dufour N,Delville M,Teboul JL,etal.Transpulmonary thermodilutionmeasurements are notaffected by continuous veno-venous hemofiltration at high blood pump flow[J].Intensive Care Med,2012,38(7):1162-1168.
[4]Dellinger RP,Levy MM,Carlet JM,et al.Surviving sepsis campaign:international guidelines formanagementof severe sepsis and septic shock[J].Crit Care Med,2008,36(1):296-327.
[5]Hotchkiss RS,Swanson PE,Steckelberg JM,et al.Apoptotic cell death in patients with sepsis,shock,and multiple organ dysfunction[J].Crit Care Med,1999,27(7):1230-1251.
[6]Marik PE,Baram M,Vahid B.Does central venous pressure predict fluid responsiveness:a systematic review of the literature and the tale of seven mares[J].Chest,2008,134(1):172-178.
[7]Felbinger TW,Reuter DA,Eltzschig HK,et al.Cardiac index measurements during rapid preload changes:a comparison of pulmonary artery thermodilution with arterial pulse contour analysis[J].Clin Anesth,2005,17(4):241-248.
[8]Della Rocca G,Costa MG,Coccia C,et al.Cardiac outputmonitoring:aortic transpulmonary thermodilution and pulse contour analysis agree with standard thermodilution methods in patients undergoing lung transplantation[J].Can J Anaesth,2003,50(7): 707-711.
[9]Holm C,Melcer B,Horbrand F,etal.Arterial thermodilution:an alternative to pulmonary artery catheter for cardiac output assessment in burn patients[J].Burns,2001,27(2):161-166.
[10]Wheeler AP,Bernard GR,Thompson BT,et al.Pulmonary-artery versus central venous catheter to guide treatmentof acute lung injury[J].N Engl JMed,2006,354(21):2213-2224.
[11]Michard F,Alaya S,Zarka V,etal.Globalenddiastolic volume as an indicator of cardiac preload in patients with septic shock[J].Chest,2003,124(5):1900-1908.
[12]Sakka SG,Rühl CC,Pfeiffer UJ,etal.Assessmentof cardiac preload and extravascular lung water by single transpulmonary thermodilution[J].Intensive Care Med,2000,26(2):180-187.
[13]Trof RJ,Danad I,Reilingh MW,et al.Cardiac filling volumes versus pressures for predicting fluid responsiveness after cardiovascular surgery:the role of systolic cardiac function[J].Crit Care,2011,15(1):R73.
[14]Bognar Z,Foldi V,Rezman B,etal.Extravascular lungwater index as a sign of developing sepsis in burns[J].Burns,2010,36 (8):1263-1270.
[15]Chung FT,Lin SM,Lin SY,et al.Impact of extravascular lung water index on outcomes of severe sepsis patients in amedical intensive care unit[J].Respir Med,2008,102(7):956-961.
[16]Davey-Quinn A,Gedney JA,Whiteley SM,et al.Extravascular lung water and acute respiratory distress syndrome-oxygenation and outcome[J].Anaesth Intensive Care,1999,27(4):357-362.
[17]Oren-Grinberg A.The PiCCO moniter[J].Int Anesthesiol Clin,2010,48(1):57-85.
[18]Marik PE,CavallazziR,Vasu T,etal.Dynamic changes in arterial waveform derived variables and fluid responsiveness inmechanically ventilated patients:a systematic review of the literature[J].Crit Care Med,2009,37(9):2642-2647.

