苦参碱对白血病HL-60细胞增殖、凋亡及其Bcl-2 mRNA、Survivin mRNA表达的影响
宋庆林,江 梅
(1焦作市人民医院,河南焦作454002;2焦作市第二人民医院)
苦参碱是豆科植物苦参、苦豆子、广豆根等中草药的活性成分,是苦参碱类生物碱的代表,属于四环喹诺里西啶生物碱[1]。白血病是常见的造血系统恶性肿瘤,约占恶性肿瘤总发病率的5%,尤其常见于儿童和青少年[2]。研究[3]显示,苦参及其生物碱对肿瘤细胞有杀伤和诱导分化的作用,且对正常细胞不产生破坏作用,还能提高机体免疫功能。2011年3月~2013年3月,我们观察了苦参碱对白血病HL-60细胞增殖、凋亡及凋亡相关基因Bcl-2 mRNA、Survivin mRNA表达的影响,旨在为开发新的抗肿瘤药物提供实验依据。
1 材料与方法
1.1 材料 试验药物:苦参碱购自百灵威科技公司,货号KS-5203,经HPLC法鉴定纯度>98%;顺铂购自江苏豪森药业股份有限公司(国药准字H20040813)。细胞株:人早幼粒细胞白血病细胞株HL-60由中国医学科学院基础医学研究所基础医学细胞中心提供。试剂:RPMI1640培养液及四甲基偶氮唑蓝(MTT)均购自美国Gibco公司;小牛血清购自杭州四季青生物有限公司;Bcl-2及Survivin的RT-PCR引物设计与合成委托生工生物工程股份有限公司。
1.2 HL-60细胞培养及分组处理 取悬浮生长的HL-60细胞,置于含10%小牛血清的RPMI1640培养基中,37.5℃、5%CO2饱和湿度条件下常规培养。每2 d换液传代1次,至对数生长期后随机分为对照组、顺铂组、苦参碱组,均调整细胞密度至2×105/mL后接种于96孔培养板内,其中苦参碱组分别加入0.5、1.0、2.0 mg/mL的苦参碱,顺铂组加入0.01 mg/mL的顺铂,对照组予等量药物溶媒。每个剂量组设6个平行孔,重复3次。
1.3 HL-60细胞增殖情况检测 采用MTT比色法。上述各组在37℃、5%CO2培养箱内培养24 h后,每孔加入MTT继续培养4 h,离心后吸去上清,加入DMSO显色,避光平行振荡10min,在酶标仪上测定波长为490 nm处的光密度(OD值),细胞生长抑制率(%)=1-实验孔OD值/对照组OD值。
1.4 HL-60细胞凋亡率测算及细胞周期分布检测
①细胞凋亡率:采用原位末端标记法(TUNEL)。取悬浮生长的HL-60细胞分为苦参碱组和对照组,苦参碱组予0.1、0.2、0.4 mg/mL的苦参碱培养,对照组同上处理;24、48 h后PBS洗涤1次,4%多聚甲醛固定30 min;PBS洗涤1次,用含0.1%Triton X-100的PBS重悬沉淀,冰浴2 min,加入TUNEL检测液50μL,37℃避光孵育60 min,在荧光显微镜下以分析软件ImagePro检测各组荧光值。②细胞周期分布:同①分组、培养HL-60细胞,24、4 8 h后分别进行常规细胞收集,离心,弃上清液,细胞沉淀用PBS冲洗2次,在震荡状态下缓慢滴入-20℃预冷的75%乙醇2 mL,过夜,再用PBS冲洗2次,加入0.01%RNA酶10μL,37℃水浴30 min,加入0.25%的碘化丙啶避光染色30 min,流式细胞仪检测,CELLQuest软件分析。
1.5 HL-60细胞Bcl-2 mRNA、Survivin mRNA的检测 同1.2中分组、处理 HL-60细胞,根据NCBI GenBank中cDNA序列,按照互补原则,兼并Tm值、C+G含量等因素进行引物设计:Bcl-2上游引物为5'-TGTGTGGAGAGCGTCAAACC-3',下游引物为5'-TGGATCCAGGTGTGCAGGT-3';Survivin上游引物为5'-GTCAGCCCAACCTTCACAT-3',下游引物为5'-GGCGAATCAAATCCATCAT-3';根据上述引物,采用北京全式金实时定量 RT-PCR试剂盒检测 Bcl-2 mRNA及Survivin mRNA的相对表达。
1.6 统计学方法 采用SPSS13.0统计软件。计量资料以±s表示,组间比较用成组t检验;计数资料比较用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 HL-60细胞生长抑制率 对照组及顺铂组HL-60细胞生长抑制率分别为0.04% ±0.00%、51.73%±10.17%,苦参碱组0.5、1、2 mg/mL处理者分别为15.73%±11.50%、40.30% ±6.52%、63.41%±5.94%,顺铂组和苦参碱组均显著高于对照组,P均<0.01。
2.2 HL-60细胞凋亡率及细胞周期分布 细胞凋亡率见表1,细胞周期分布见表2。
表1 两组HL-60细胞凋亡率比较(%,±s)

表1 两组HL-60细胞凋亡率比较(%,±s)
注:与对照组同时点比较,*P<0.01
组别 细胞凋亡率24 h 48 h苦参碱组0.1 mg/mL 10.26* 33.13* 0.2 mg/mL 25.03* 38.65* 0.4 mg/mL 41.02* 52.36*对照组1.58 3.08
表2 两组HL-60细胞周期分布比较(%,±s)
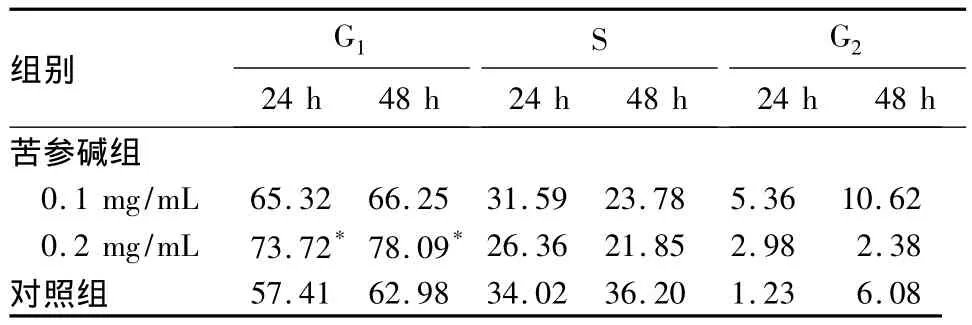
表2 两组HL-60细胞周期分布比较(%,±s)
注:与对照组同时点比较,*P<0.05
组别G1 24 h 48 h S 24 h 48 h G2 24 h 48 h苦参碱组0.1 mg/mL 65.32 66.25 31.59 23.78 5.36 10.62 0.2 mg/mL 73.72*78.09*26.36 21.85 2.98 2.38对照组57.41 62.98 34.02 36.20 1.23 6.08
2.3 HL-60细胞Bcl-2 mRNA及Survivin mRNA表达 苦参碱组2.0 mg/mL苦参碱作用者及顺铂组HL-60细胞Bcl-2 mRNA、Survivin mRNA表达均显著低于对照组。详见表3。
表3 HL-60细胞Bcl-2及Survivin m RNA表达比较(±s)
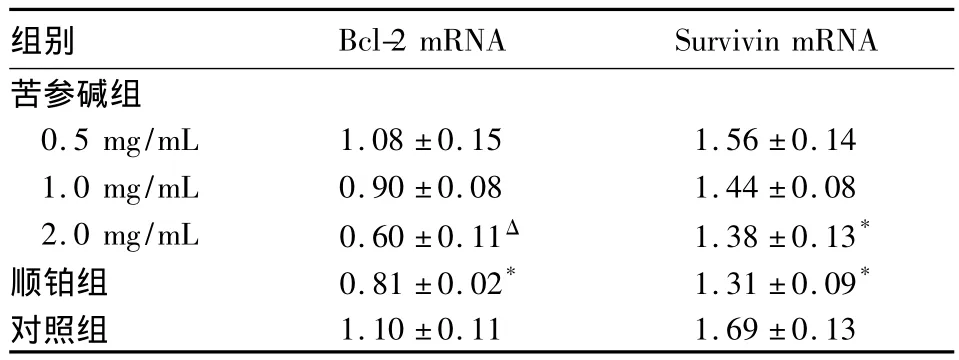
表3 HL-60细胞Bcl-2及Survivin m RNA表达比较(±s)
注:与对照组比较,*P<0.05,ΔP<0.01
组别Bcl-2 mRNA Survivin mRNA苦参碱组0.5 mg/mL 1.08±0.15 1.56±0.14 1.0 mg/mL 0.90±0.08 1.44±0.08 2.0 mg/mL 0.60±0.11Δ 1.38±0.13*顺铂组 0.81±0.02* 1.31±0.09*对照组1.10±0.11 1.69±0.13
3 讨论
白血病的生物学特征是造血干细胞增殖失控、分化成熟受阻及正常凋亡机制被抑制。细胞的分化受增殖能力的影响,即分化程度低的细胞增殖旺盛、反之则增殖能力低下。近期研究发现,苦参碱参与多种肿瘤细胞的凋亡诱导过程,尤其是对消化系统肿瘤和乳腺肿瘤细胞的凋亡诱导作用显著。但国内外有关其在早幼粒细胞白血病细胞HL-60中作用的研究少见。研究[4]显示,苦参碱能够抑制白血病 KG1a(人急性髓细胞白血病细胞株)细胞的增殖,改变其细胞周期分布、诱导细胞凋亡。顺铂是临床上常用的广谱抗癌药之一,主要作用靶点为DNA,可与DNA链间及链内交链形成DDP-DNA复合物,干扰DNA复制,对肿瘤的放疗有增敏作用;对机体的消化系统、骨髓、肾脏以及内耳等亦可产生毒性损伤。本研究显示,顺铂组和苦参碱组HL-60细胞生长抑制率均显著高于对照组,苦参碱组尤以浓度为2 mg/mL处理者为著。提示苦参碱与顺铂同样具有抑制HL-60细胞增殖的作用,并具有剂量依赖性效应。
细胞增殖的速度取决于细胞周期的长短,而细胞周期的长短主要决定于G1期,G1期阻滞可使细胞增殖周期延长。目前,研究抗肿瘤药物对肿瘤细胞增殖抑制作用的方法有染料排斥法(如台盼蓝拒染法)、集落形成法、1H-TdR掺入法及MTT法等。鼠抗人增殖细胞核抗原(PCNA)在肿瘤细胞异常增殖中具有重要作用,是研究肿瘤增殖活性的重要标记物之一,主要在G1期和S期合成,是DNA聚合酶的辅助因子,其表达与细胞增殖程度密切相关[5]。本研究显示,苦参碱组细胞凋亡率、G1期细胞比例均显著高于对照组。提示苦参碱可诱导HL-60细胞凋亡,并将其增殖阻滞在G1期。细胞凋亡是一个十分复杂的生理过程,参与调控的因子众多,其中Bcl-2是目前己知的较强的抑制凋亡基因,在细胞凋亡调控中起重要作用[6];Survivin蛋白是内源性凋亡蛋白家族(IAPs)的成员之一[7],在大部分肿瘤组织中有高表达,是迄今发现的最强的凋亡抑制因子[8]。Bcl-2及Survivin均与肿瘤的发生及耐药性密切相关。本研究显示,苦参碱组HL-60细胞Bcl-2mRNA及SurvivinmRNA表达均显著低于对照组。表明苦参碱诱导HL-60细胞凋亡可能是通过下调Bcl-2、Survivin基因的表达实现的。从细胞动力学分析,S期比例高的肿瘤患者对化疗药物敏感,但同时残留肿瘤的再生率亦高,易复发;G0期高者(即未进入增殖状态但具有增殖能力的细胞比例较高者),化疗后也容易引起复发。这两者可以理解为微小残留病变导致白血病复发的根源。因此,苦参碱可能通过调控细胞增殖周期增强白血病的化疗敏感性。
综上所述,苦参碱体外可抑制急性早幼粒细胞白血病HL-60细胞增殖、诱导细胞凋亡,其作用机制可能与下调凋亡基因Bcl-2、Survivin表达有关;此为中国传统中药在白血病治疗中的应用奠定了基础。
[1]刘梅,刘雪英,程建峰.苦参碱的药理研究进展[J].中国中药杂志,2003,9(280):801-803.
[2]陈濒珠.实用内科学[M].北京:人民卫生出版社,2001,10 (1):937.
[3]许相儒,蒋纪恺.苦参及其生物碱抗肿瘤活性研究进展[J].中国中西医结合杂志,1998,18(5):314.
[4]王国征,孙明,郭坤元.苦参碱对白血病KG 1a细胞增殖及凋亡的影响[J].山东医药,2008,48(37):25-27.
[5]方政,赵军方,李新明.苦参碱对人涎腺腺样囊性癌细胞增殖抑制及PCNA、c-myc、p53蛋白表达的影响[J].山东医药,2009,49(19):28-30.
[6]贾炜.Bcl-2家族研究进展[J].当代医学,2012,18(3):26.
[7]蔡贤福,何卫阳,肖明朝.survivin特性及其在抗肿瘤中的应用[J].医学综述,2012,18(3):362.
[8]马兴元.细胞分裂与凋亡的重要调节因子Survivin:一个抗癌新药靶[J].生命的化学,2010,30(3):338.

