双抗夹心酶联免疫吸附法检测沙门氏菌
伍燕华,牛瑞江,赖卫华,山 珊,刘道峰,倪小琴,冯荣华
(南昌大学食品科学与技术国家重点实验室,江西南昌330047)
沙门氏菌是自然界普遍存在的一种食源性致病菌,在中国食物中毒中沙门氏菌引起的病例占第一位[1],常引起人类急性腹泻、呕吐、腹部疼痛、高烧和败血症等疾病[2]。
传统检测沙门氏菌的方法可分为预增菌、选择性增菌及分离鉴定三个不同阶段,全过程至少需要4~7d才能得出检测结果[3]。GB 4789.4-2010是目前我国规定的检测食品中沙门氏菌的标准方法,主要是根据沙门氏菌的生化特性进行检测,包括前增菌、选择性增菌、分离培养、生化鉴定和血清分型五个步骤[4]。国标法准确可靠,但检测时间太长,因而,建立快速准确的检测方法,对于预防和控制沙门氏菌中毒具有重大意义。
分子生物学检测技术具有高灵敏度、高特异性、快速准确等优点,已经广泛应用于食源性致病菌的快速检测。快速检测沙门氏菌的分子生物学技术主要包括:聚合酶链式反应[5-9]、基因芯片[10-11]和环介导等温扩增[12-13]等。然而,分子生物学检测方法要求具有较高素质的操作人员、较好条件的检测仪器以及检测条件,因此较难在基层大面积推广使用。
酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)是一种灵敏度高,特异性强,重复性好,容易在基层使用的实验诊断方法。将抗原、抗体免疫反应的特异性和酶的高效催化作用原理有机地结合起来,可敏感地检测样品中微量的特异性抗原。Bang等建立了检测鼠伤寒沙门氏菌的间接竞争ELISA法[14],Kumar等采用ELISA法检测伤寒沙门氏菌[15],焦新安团队建立了检测猪霍乱沙门氏菌感染的单抗竞争ELISA法[16],朱春红等采用间接ELISA法检测肠炎沙门氏菌[17]。然而,沙门氏菌有2600多种血清型,上述的ELISA方法仅仅针对单一类型菌株进行检测。本研究建立了检测沙门氏菌双抗夹心ELISA方法,可以对沙门氏菌A、B、C、D、E等五种典型菌株进行筛查,沙门氏菌的检测范围大大增加,同时本文对该方法的灵敏度和特异性进行了评价。
1 材料与方法
1.1 材料与仪器
LB肉汤培养基、氯化镁孔雀绿肉汤选择性培养基 北京陆桥技术有限公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG、辣根过氧化物酶(HRP)标记的羊抗鼠IgG 北京中杉金桥生物技术有限公司;抗沙门氏菌单克隆抗体C1359 美国Meridian公司;磷酸盐缓冲液(PBS) 国药集团化学试剂有限公司;磷酸盐洗液(PBST) 上海双螺旋生物科技有限公司。五种沙门氏菌:包括猪霍乱沙门氏菌(ATCC 10708)、甲型副伤寒沙门氏菌(ATCC 9150)、鸭沙门氏菌(ATCC 9150)、肠炎沙门氏菌(ATCC 13076)、鼠伤寒沙门氏菌(ATCC 13311);十五种非沙门氏菌:包括大肠杆菌XY1264、大肠杆菌XY0840、大肠杆菌CMCC44102、大肠杆菌CMCC44496、大肠杆菌CMCC44350、大肠杆菌CMCC44828、阪崎肠杆菌CMCC 45401、阪崎肠杆菌CMCC 45402、志贺氏菌301、志贺氏菌2457、单核增生李斯特菌CMCC54001、单核增生李斯特菌CMCC54007、副溶血弧菌ZDBE、蜡样芽胞杆菌CMCC49027、枯草芽孢杆菌BD366 均为本实验室保存。
BHC-1300ⅡA/B3生物安全柜 苏州安泰;ZHWY-2102C恒温培养振荡器 上海智诚;TGL-16台式离心机 湖南湘仪。
1.2 实验方法
1.2.1 免疫抗原及检测菌液的制备[18]将保存的鼠伤寒沙门氏菌(ATCC 13311)复苏后,转接于200m L LB肉汤培养基中,37℃振荡培养20h,4000r/min离心10m in收集菌体,0.01mol/L pH7.4的PBS(磷酸盐缓冲液)洗涤两次后加入含0.5%福尔马林的PBS 30m L,室温下作用24h灭活菌体,然后4000r/m in离心10m in收集菌体,PBS洗涤两次后重悬备用。
1.2.2 抗沙门氏菌多克隆抗体的制备 选择雌性日本大耳兔2只,免疫前耳缘静脉采血,取阴性血清。随后进行皮下多点免疫。首次免疫抗原量约为1.395×109CFU/只。之后进行4次追加免疫,免疫剂量为2.79×109CFU/只,免疫周期为两周。采用间接ELISA方法测定效价,效价达到105后,股动脉采血,收集血清,采用辛酸-硫酸铵法纯化多抗[19]。
1.2.3 双抗夹心ELISA方法的建立 将纯化后的抗鼠伤寒沙门氏菌多克隆抗体稀释2500倍,100μL/孔,4℃包被过夜,用PBST(磷酸盐洗液)洗3次,每孔中加入3%BSA 300μL封闭液,37℃孵育1h。弃去封闭液,用PBST洗3次,每孔230μL。加入沙门氏菌,100uL/孔,并设置空白对照和阴性对照。用PBST洗4次,每孔230μL。单克隆抗体稀释200倍,100μL/孔,37℃孵育1h;用PBST洗4次,每孔230μL;加入酶标抗体,100μL/孔,37℃孵育0.5h;用PBST洗5次,每孔230μL;加入现配的显色液四甲基联苯胺,100μL/孔,37℃反应15m in;加入终止液(2mol/L H2SO4)50μL/孔,终止显色反应;在酶标仪上测定OD450nm值。
1.2.4 细菌抗原制备 将低温冻干保存的菌种划线接种于固体LB平板上,37℃培养18h后挑取单菌落接种于液体LB培养基中(副溶血性弧菌需要高盐LB培养基),37℃、160r/m in摇床培养18h,将菌液煮沸处理20m in用作检测抗原。纯培养的各种菌株在热处理前均用无菌0.01mol/m L PBS梯度稀释后涂布LB平板,进行菌落计数以确定菌液浓度。
1.2.5 双抗夹心ELISA检测五种典型的沙门氏菌 对沙门氏菌的五种菌液(均为5×108CFU/m L)进行检测,其中包括A组的副伤寒沙门氏菌,B组的鼠伤寒沙门氏菌,C组的猪霍乱沙门氏菌,D组的肠炎沙门氏菌和E组的鸭沙门氏菌,结果以P/N值判定,P/N≥2.1时判断为阳性,其计算公式如下:

1.2.6 ELISA对非沙门氏菌的特异性检测 对鼠伤寒沙门氏菌和十五种非沙门氏菌的菌液(均为1×108CFU/m L)进行双抗夹心ELISA检测,确定方法的特异性。
1.2.7 ELISA方法检测鼠伤寒沙门氏菌的灵敏度 将鼠伤寒沙门氏菌接种于LB肉汤培养基中,37℃、180r/m in振荡培养12h,平板计数后,将系列稀释后的待检菌液作为检测液,加入双抗夹心ELISA体系中,检测该方法的灵敏度。
1.2.8 ELISA方法与免疫磁珠富集法结合在牛奶添加实验中的应用 取25g无菌牛奶加入到225m L无菌水中制成样品液,将鼠伤寒沙门氏菌5CFU/m L接种量接种于样品液中,分别取10m L样品加入到选择性氯化镁孔雀绿肉汤培养基中混合均匀,37℃、160r/min条件下培养6~12h,不同时间取样,采用免疫磁珠富集分离对样品进行富集分离[20],得到目的菌后用ELISA检测,同时设置阴性对照及空白对照。
2 结果与分析
2.1 五种沙门氏菌的ELISA检测结果
沙门氏菌有2600多种血清型,主要分为A、B、C、D、E五个组[21]。P/N值的结果显示(表1),双抗夹心ELISA方法可以检测到A组的副伤寒沙门氏菌,B组的鼠伤寒沙门氏菌,C组的猪霍乱沙门氏菌,D组的肠炎沙门氏菌和E组的鸭沙门氏菌等五种代表性菌株。
2.2 非沙门氏菌的ELISA检测结果
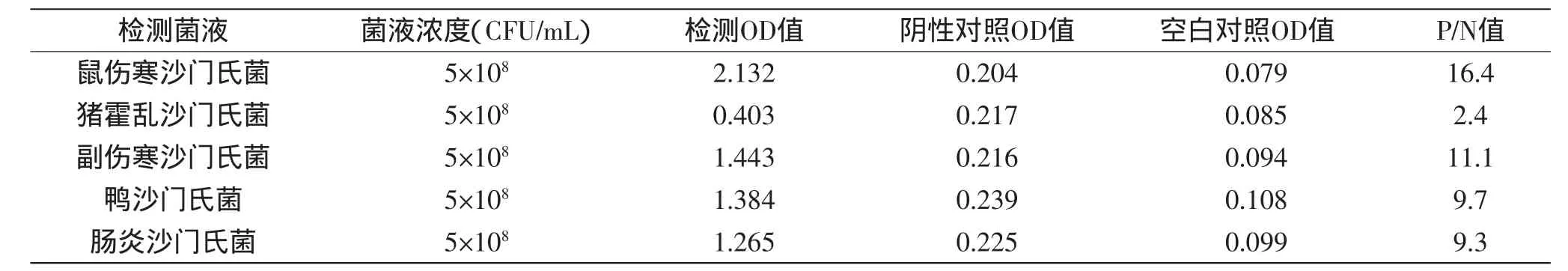
表1 双抗夹心ELISA检测五种沙门氏菌的结果Table1 The resultof five strains of Salmonella by double-antibody sandwich ELISA
用已建立的双抗夹心ELISA方法对鼠伤寒沙门氏菌和15株非沙门氏菌(表2)进行检测,P/N值的结果显示,只有鼠伤寒沙门氏菌显示阳性,其他15株非沙门氏菌均显示阴性。
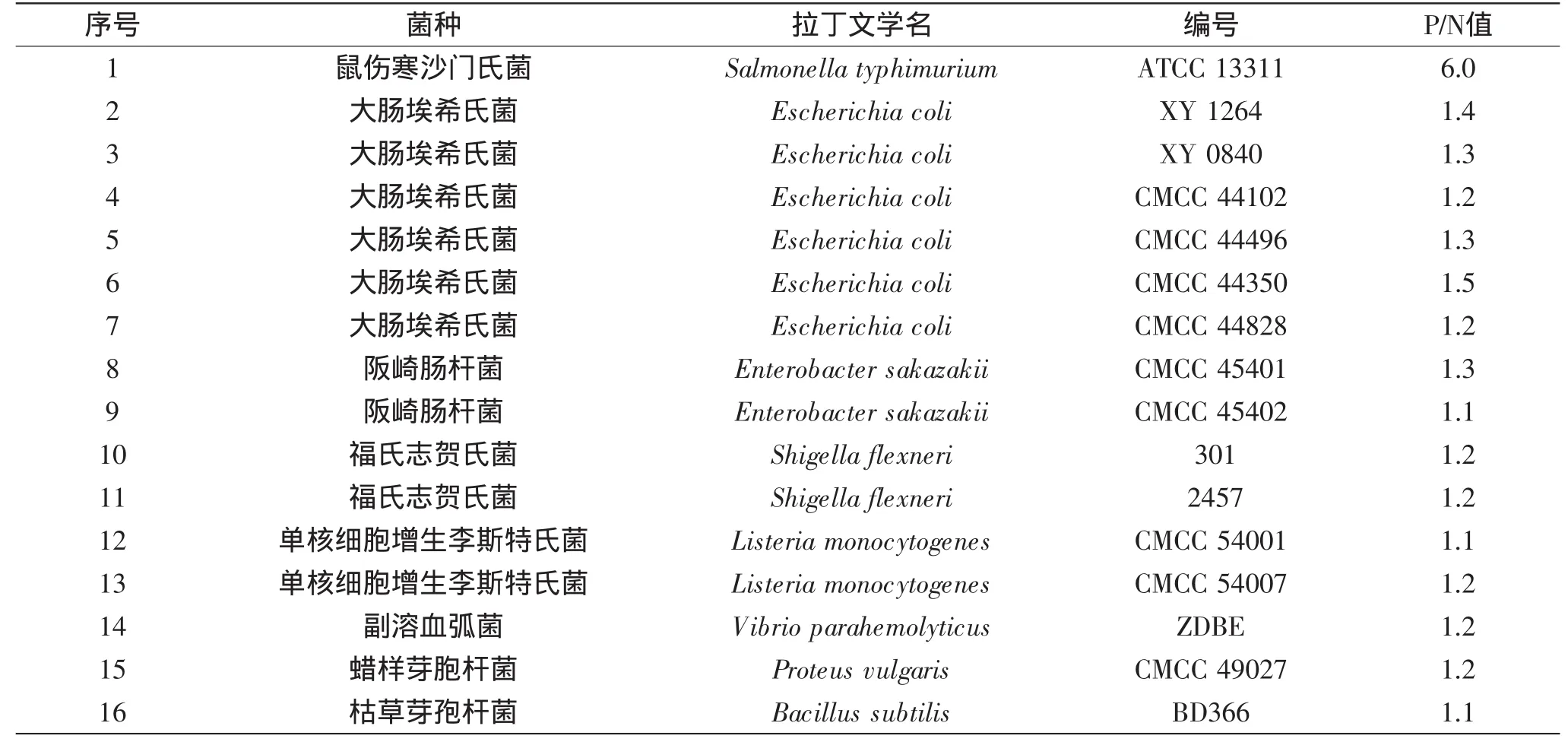
表2 特异性实验所用菌种Table2 Strains using in specific experiment

表3 双抗夹心ELISA方法灵敏度检测结果Table3 Result of the test of sensitivity by double-antibody sandwich ELISA
2.3 双抗夹心ELISA方法灵敏度分析
以鼠伤寒沙门氏菌纯培养菌液系列稀释,测定方法的灵敏度,结果如表3所示,随着抗原浓度的降低,吸光值下降,P/N值的结果显示,该方法对纯培养液的检测限为104CFU/m L。
2.4 牛奶添加实验的检测结果
接种量5CFU/m L的牛奶样品在选择性培养基中培养不同时间,免疫磁珠法进行富集后用双抗夹心法进行检测,阴性OD值为0.184,空白OD值为0.085,添加沙门氏菌的牛奶样品结果如表4所示,根据P/N值判断,培养8h后,通过联用免疫磁珠富集和ELISA法,可以检测出阳性样本。

表4 不同培养时间双抗夹心ELISA方法检测结果Table4 Resultof the double-antibody sandwich ELISA for different culture time
3 结论
本研究采用福尔马林灭活的鼠伤寒沙门氏菌全菌抗原免疫日本大白兔,获得抗沙门氏菌多克隆抗体,以此多克隆抗体作为捕获抗体,以单克隆抗体作为检测抗体,建立了双抗夹心ELISA方法。该方法可以检测五株不同类型的沙门氏菌,特异性较强,对鼠伤寒沙门氏菌培养液的最低检测浓度为1.0×104CFU/m L。在牛奶样品的添加实验中,联用选择性增菌液进行前增菌,免疫磁珠富集,ELISA方法进行检测,接种量5CFU/m L的样品在培养8h后可检出阳性结果。
[1]杜雄伟,李叶,冮洁,等.肉制品中沙门氏菌invA基因实时荧光定量PCR检测方法的建立[J].食品工业科技,2013,34(12):68-70.
[2]Liu YC,Che YH,Li YB.Rapid detection of Salmonella typhimurium using immunomagnetic separation and immunooptical sensing method[J].Sensors and Actuators B,2001,72(3):214-218.
[3]耿士忠,潘志明,刘杰.猪及猪肉中沙门氏菌快速检测的研究进展[J].猪业科学,2010,6:100-105.
[4]王毳,闫磊,曾庆祝.沙门氏菌的检测技术与方法[J].现代食品科技,2007,23(5):82-85.
[5]Trevanich S,Tiyapongpattana S,Miyamoto T.Application of an optimized 18-h method involving one step culturing and single primer-based PCR assay for detection of Salmonella spp.in foods[J].Food Control,2010,21(5):593-598.
[6]赵红庆.五种致腹泻大肠埃希菌的多重PCR检测研究[D].北京:中国人民解放军军事医学科学院,2007.
[7]Grace JYN,Li MN,Raymond TPL,et al.Development of a novel multiplex PCR for the detection and differentiation of Salmonella enterica serovars Typhi and Paratyphi A[J].Research in Microbiology,2010,161(4):243-248.
[8]Camila GF,Angela PS,Patrícia HCS,et al.PCRmultiplex for detection of Salmonella Enteritidis,Typhi and Typhimurium andoccurrence in poultry meat[J].International Journal of Food Microbiology,2010,139(1/2):15-22.
[9]Chen J,Zhang L,Paoli GC,et al.A real-time PCR method for the detection of Salmonella enterica from food using a target sequence identified by comparative genomic analysis[J].International Journal of Food Microbiology,2010,137:168-174.
[10]KOSTIC Tl.Amicrobial diagnosticmicroarray technique for the sensitive detection and identification of pathogenic bacteria in a background of nonpathogens[J].Analytical Biochemistry,2007,360(2):244-254.
[11]Courtney S,Mossoba ME,Hammack TS,et al.Using PCR amplification to increase the confidence level of Salmonella typhimurium DNA microarray chip hybridization[J].Molecular and Cellular Probes,2006,20(3/4):163-171.
[12]王羽.LAMP技术检测肉及肉制品中沙门氏菌的研究[D].保定:河北农业大学,2008.
[13]Okamura M,Ohba Y,Kikuchi S,et al.Loop-mediated isothermal amplification for the rapid,sensitive,and specificdetection of the O9 group of Salmonella in chickens[J].Veterinary Microbiology,2008,132(1/2):197-204.
[14]Bang J,Shukla S,Kim YH,et al.Development of indirect competitive ELISA for the detection of Salmonella typhimurium [J].Romanian Biotechnological Letters,2012,17(2):7194-7204.
[15]Kumar S,Balakrishna K,Batra HV.Enrichment-ELISA for detection of Salmonella typhi from food and water samples[J].Biomedical and Environmental Sciences,2008,21(2):137-143.
[16]殷月兰,潘志明,孟书霞,等.单抗竞争ELISA检测猪沙门氏菌感染方法的建立与应用[J].中国预防兽医学报,2003,25(1):65-68.
[17]朱春红,吴娟,张伟娟,等.肠炎沙门氏菌基因表达和间接检测方法的初步建立[J].中国预防兽医学报,2010,32(1):44-48.
[18]段霞,黄欣,黄岭芳,等.双抗夹心ELISA方法检测食品中单核细胞增生李斯特菌[J].食品科学,2010,31(24):272-276.
[19]牛瑞江,赖卫华,熊齐荣,等.鼠伤寒沙门氏菌特异性多克隆抗体的纯化方法[J].食品科学,2011,32(13):151-155.
[20]山珊,牛瑞江,赖卫华,等.免疫磁珠法富集沙门氏菌的优化及应用[J].食品工业科技,2013,34(13):153-156.
[21]Hoerner R,Feldpausch J,Gray RL,etal.Reveal®Salmonella 2.0 Test for Detection of Salmonella spp.in Foods and Environmental Samples[J].Journal of AOAC International,2011,94(5):1467-1480.

