桦褐孔菌次生代谢产物清除自由基活性成分的分离纯化及初步鉴定
李婉珍,潘 燕,葛 飞,樊美珍
(1.安徽工程大学,微生物发酵安徽省工程技术研究中心,安徽芜湖241000;2.安徽省微生物防治重点实验室,安徽合肥230036)
桦褐孔菌(Inonotus obliquus(Fr.)Pilat)为多孔菌科(Polyporaceae)纤孔菌属(Inonotus)的药用真菌[1]。在我国主要生长在吉林、黑龙江、西藏、青海等高海拔山区的桦属树木上[2]。
桦褐孔菌是一种具有很高药用价值、应用前景广泛的真菌。近期研究结果表明,桦褐孔菌除了具有抗肿瘤[3-4]、抗病毒、降血压、改善血液循环、调整血压、降低血胆固醇、增强免疫的作用外,还具有清除体内自由基和明显的抗氧化作用[5-8]。
目前,国内外有关桦褐孔菌多糖及抗氧化活性的相关研究较多[9-12],而对桦褐孔菌菌株发酵液清除自由基活性成分分离纯化研究的相关报道相对较少[13-15],尤其是对活性组分纯化合物的结构鉴定尚未见报道,本实验以清除自由基活性为目标,对桦褐孔菌次生代谢产物中清除自由基活性成分进行研究,并采用多种分离方法对其活性组分进行分离纯化,旨在分离出具有清除自由基活性的纯化合物,为桦褐孔菌深层发酵产物的开发应用提供参考。
1 材料与方法
1.1 材料与仪器
桦褐孔菌(Inonotus obliquus(Fr.)Pilat) 由吉林应用真菌研究所提供;二苯代苦味肼基自由基(DPPH) 购于美国Sigma公司;其他试剂 为国产分析纯。
B685型中压液相色谱仪 瑞士BUCHI;Spectra M 2酶标仪 美国Molecular Devices公司;FREEZONE 12型冻干机 美国LABCONCO公司;柱层析系统 上海沪西分析仪器厂;6010型紫外-可见分光光度计 上海惠普分析仪器有限公司;Waters Spherisorb ODS2型高效液相色谱(HPLC)分析柱(4.6mm×250mm,5μm)、Waters 2487型双波长检测器 美国Waters公司;Summetryshield RP18柱(5μm,3.9×150mm) Korean,Autocharm工作站。
1.2 实验方法
1.2.1 桦褐孔菌发酵液乙酸乙酯脂溶相样品的制备
本实验将桦褐孔菌菌株发酵液浓缩至1/20倍加入3倍体积95%乙醇(乙醇终浓度为75%)醇沉,室温下静置24h,5000r/min离心10min,取上清液浓缩脱醇,加入3倍体积的乙酸乙酯进行萃取,待分层后得酯溶相,将酯溶相浓缩至干备用。
1.2.2 乙酸乙酯提取脂溶相清除自由基活性的定性分析 本实验将发酵液的乙酸乙酯提取物配制成1.0mg/m L的甲醇溶液,采用二苯基苦基苯肼自由基薄层实验法(DPPH-TLC-ASSAY)[16]进行自由基活性的定性分析。
1.2.3 清除自由基活性的测定方法 采用DPPH-酶标仪法[17]:加用95%甲醇配制的不同浓度的样品100μL和用95%甲醇配制好的DPPH试液100μL置于96孔酶标板中,37℃条件下振荡30s,选择波长在517nm处测其吸光值。每样品平行测定3次。然后按下述公式计算自由基清除率:
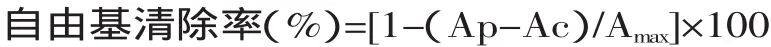
式中,Ap—样品加入DPPH试液的吸光值(517nm处吸光值);Ac—样品不加入DPPH试液的吸光值;Amax—DPPH试液不加样品(以95%甲醇代替)的吸光值。
1.2.4 乙酸乙酯提取脂溶相经反相柱(Summetryshield RP18)粗分 本实验中中压液相色谱采用硅胶含量为80g键合的C18的柱材料,色谱柱直径为5cm,长度为30cm。
将待分样品甲醇充分溶解,加到中压液相色谱(MPLC)的加样管中,依次采用100%双蒸水(Ⅰ)、30%甲醇水溶液(Ⅱ)、50%甲醇水溶液(Ⅲ)、70%甲醇水溶液(Ⅳ)、100%甲醇溶液(Ⅴ)五种梯度进行洗脱。按不同梯度分别收集样品浓缩至干,各组分样品和DPPH分别用95%甲醇配制成浓度为1mg/m L溶液,进行清除自由基活性检测。
1.2.5 凝胶柱层析(SephadexLH-20)法对粗分的样品分离 制备凝胶层析柱及上样分离[18],调整柱流速在1滴/20s左右进行洗脱,加足流动相甲醇,用自动收集仪分管进行收集,每管控制收集5m L左右。应用TLC法对收集的样品进行合并浓缩,分别配制浓度为0.5mg/m L甲醇溶液,DPPH用甲醇配成浓度为0.8mg/m L的试剂,进行清除自由基活性检测。
1.2.6 硅胶柱层析法对分离样品纯化 采用干法装柱及上样[19],依次采用100%石油醚、石油醚∶氯仿(10∶1)、100%氯仿、氯仿∶甲醇(100∶1)、100%甲醇洗脱剂进行梯度洗脱,以20滴/m in的流速开始洗脱,每20m L收集一管。收集到的各个组分采用TLC法分析,把相同Rf值的组分进行合并。
1.2.7 重结晶 用氯仿∶石油醚(1∶10)混合溶剂20m L溶解0.5g样品,装入洁净的小玻璃管中,用封口膜封口后用小针在膜上刺几个小孔,将小管置于干燥器或4℃冰箱中,使有机溶剂缓慢挥发7~30h。同时,在观察时,避免晃动液体。
1.2.8 纯度鉴定
1.2.8.1 薄层层析法(TLC) 本实验对样品LWZc采用氯仿∶甲醇(C∶M)=10∶1、氯仿∶丙酮(C∶AC)=3∶2、石油醚∶乙酸乙酯(PE∶EA)=5∶1三种不同极性的展开系统展开,样品LWZf采用氯仿∶丙酮=3∶2展开剂展开,脱尾现象严重,再采用A#(氯仿∶丙酮∶甲酸=240∶160∶1)、B#(氯仿∶丙酮∶甲酸∶水=120∶80∶1∶5)两种展开剂展开,待溶剂挥发后在254nm紫外灯下观察荧光猝灭斑点,再在碘蒸汽条件下和10%H2SO4显色剂条件下显色观察。
1.2.8.2 高效液相色谱法(HPLC) 样品溶解于适量的甲醇(色谱级)中,然后进行HPLC纯度检验。色谱条件:色谱柱:waters 4.6mm×250mm,紫外检测波长:190~400nm全波长下扫描,流动相:0.005%甲酸水与甲醇(色谱级)梯度洗脱,流速:控制在0.5m L/min~1.0m L/m in。
1.2.9 结构解析
1.2.9.1 活性组分的HPLC-TOF-MS分析 将检测到的活性组分通过HPLC-TOF-MS进一步确认分析。质谱检测条件为:电喷雾离子源(ESI)的雾化气压为35psi;氮气流速为12.0L/m in,温度为325℃;阳离子模式离子化电压为4000V,碎片电压215V;阴离子模式离子化电压为3500V,碎片电压175V。
色谱条件:色谱柱:waters 4.6mm×250mm,紫外检测波长:190~400nm全波长下扫描,流动相:0.005%甲酸水与甲醇(色谱级)梯度洗脱,流速:控制在0.5~1.0m L/m in。
1.2.9.2 核磁共振(1H-NMR) 采用500M核磁共振测量化合物的1H-NMR图谱,待溶解化合物Lwzf和Lwzc的溶液自然挥发至干后,分别取样品干粉2mg溶于氘代甲醇和氘代氯仿中,转移至洁净的核磁管中,在常温下测试核磁共振1H-NMR氢谱。
2 结果与分析
2.1 乙酸乙酯提取脂溶相清除自由基活性的定性分析
乙酸乙酯提取物清除DPPH自由基活性定性实验结果如图1所示。

图1 清除DPPH自由基活性的定性分析Fig.1 DPPH-TCL assay of Inonotus obliquus extracts
样品带有多条黄色(黑白图片中为白色)色带呈现,说明桦褐孔菌菌株发酵液乙酸乙酯提取物中含有清除DPPH自由基的活性成分。该样品中活性成分有一种极性较低(Rf值>0.7)化合物,多种成分为极性较强(Rf值<0.5)化合物。
2.2 乙酸乙酯提取脂溶相经反相柱(Summetryshield RP18)的粗分离

图2 Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ五个组分的DPPH自由基清除率Fig.2 Free radical scavenging rate ofⅠ、Ⅱ、Ⅲ、ⅣandⅤ
由图2可以看出,5.8g样品经反相柱的粗分离,得到Ⅰ(2.2484g)、Ⅱ(1.81534g)、Ⅲ(340.26mg)、Ⅳ(178.16mg)、Ⅴ(169.52mg)5个组分。其中,Ⅰ、Ⅱ、Ⅲ3个组分都有较强的清除DPPH自由基作用,而Ⅳ、Ⅴ两个组分几乎没有清除DPPH自由基的作用,Ⅰ组分极性太大通常很难分离,因此,选取Ⅱ和Ⅲ两个组分作为进一步分离的两个组分。
2.3 凝胶柱层析(SephadexLH-20)法对粗分样品的分离
将粗分样品Ⅱ和粗分样品Ⅲ分别通过1.2.5实验方法进一步分离,粗分样品Ⅱ分离得出A、B、C、E、F五个组分,粗分样品Ⅲ分离得出D组分,各组分清除DPPH自由基的活性分析见图3。C、F组分具有较强的清除DPPH自由基的能力,其他组分清除自由基的能力较弱,选择C和F两组分进行硅胶柱分离和纯化。
2.4 硅胶层析和重结晶对样品的纯化
对C组分样品采用1.2.6方法进行纯化,得到化合物LWZc,对F组分样品依次采用1.2.6和1.2.7方法进行梯度洗脱和重结晶,得到化合物LWZf。对化合物LWZc和LWZf配制浓度为0.2mg/m L甲醇溶液,DPPH用甲醇配成浓度为0.4mg/m L的试剂,进行清除DPPH自由基活性的分析,对DPPH自由基的清除率分别为51.2%和71.5%。

图3 A、B、C、D、E、F六个组分的DPPH自由基清除率Fig.3 DPPH free radical scavenging rate of A,B,C,D,E and F
2.5 纯度鉴定
采用薄层层析法(TLC)和高效液相色谱法(HPLC)对LWZc和LWZf进行纯度鉴定。
2.5.1 薄层层析法(TLC) LWZc和LWZf的TLC图见图4和图5。由图4、图5可以看出,样品LWZC、LWZf在薄层板上都只有一个斑点,可以初步认定两种化合物均为单一化合物。
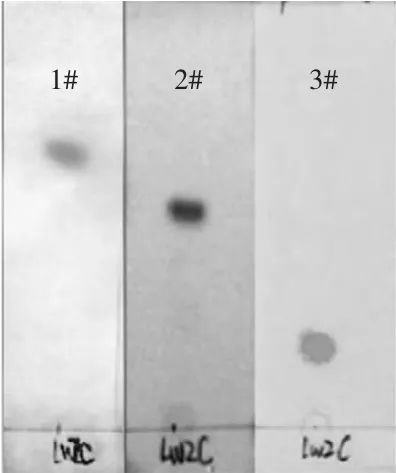
图4 LWZC在三种不同展开剂中的TLC图谱Fig.4 Chromatogram of the Lwzc in differentmobile phase

图5 LWZf在两种不同展开剂中的展开效果Fig.5 Chromatogram of the Lwzf in differentmobile phase
2.5.2 高效液相色谱法(HPLC) 通过190~400nm全波长扫描,LWZc和LWZf在254nm条件下吸收峰值高且溶剂峰干扰小,其他波段也有该物质的吸收峰(出峰时间相同),但是峰值不明显或溶剂峰干扰大。图6、图7分别为样品LWZc和LWZf在254nm条件下的吸收峰,该样品为单一组分。

图6 样品LWZf的HPLC图谱Fig.6 HPLC chromatogram of the purified components LWZf
2.6 纯组分的结构解析
本文采用液质联用结合1H核磁共振谱对化合物LWZf和LWZc的结构进行解析。
2.6.1 LWZf的结构解析
2.6.1.1 化合物LWZf的HPLC-TOF-MS图谱分析 从HPLC-MS的HPLC图6中可以看到一个主峰,其保留时间为3.25m in。从MS阴离子图谱(图8)可看出该化合物[M-H]-离子峰为137.0254,所以该化合物的分子量应为138.0254,而且从阴离子模式的MS图谱上可以看出该物质有一个[M-COOH]-碎片峰为93.0362,说明该化合物含有一个羧基。

图8 LWZf的阴离子液质联用谱图Fig.8 The HPLC-TOF-MSatlas of LWZf in negative ion condition
2.6.1.2 化合物LWZf的1H核磁共振图谱分析 由化合物LWZf的1H-NMR图谱(图9)可知,化合物仅在位移值为6.8和7.8处有两个相互偶合的峰,偶合常数8.2左右,可能是苯环上两个偶位偶合的氢,也可能是苯环对位取代后两组相互偶合的氢。结合液质联用图谱分析结果可推测出该化合物为对羟基苯甲酸,分子式为:C7H6O3。结构式为:

图9 样品LWZc的1H-NMRFig.9 The 1H-NMR atlas of the purified compound Lwzc
已知化合物对羟基苯甲酸为代表性酚酸类物质,能抗氧化、清除氧自由基。本实验中对化合物LWZf的检测结果与化合物对羟基苯甲酸的理化性质相一致,且从桦褐孔菌中分离得到该化合物是首次报道。
2.6.2 LWZc的结构解析
2.6.2.1 化合物LWZc的HPLC-TOF-MS图谱分析 从MS阳离子质谱图(图10)可看出该化合物[M+H]-离子峰为284.5,所以该化合物的分子量应为283.5,根据氮规则可知,该化合物至少含有一个氮,且从该化合物分解之后的质谱图可以看出,该化合物分解之后的阳离子离子峰为136.0313,所以该化合物被分解之后的分子量应为135.0313,且从图11都可以看出该化合物有一个丢失了[M-COOH]-的碎片峰108.0530,说明该化合物含有一个羰基。

图10 LWZc的阳离子质谱图Fig.1 0 The HPLC-TOF-MSatlas of LWZc in postive ion condition

图11 LWZc分解后阳离子质谱图Fig.1 1 The HPLC-TOF-MSof LWZc decomposition in negative ion condition
2.6.2.2 化合物LWZc的1H核磁共振图谱分析 由化合物LWZc的1H-NMR图谱(图12)可知,该化合物有一个位移值为6.21的芳氢可能是邻位上有一个氨基,从位移值4.48推断该化合物可能为一糖甙类化合物,且从位移值6.21、6.908、7.325推断甙元部分可能为一个三取代苯环氢,取代的位置分别为邻位和间位。
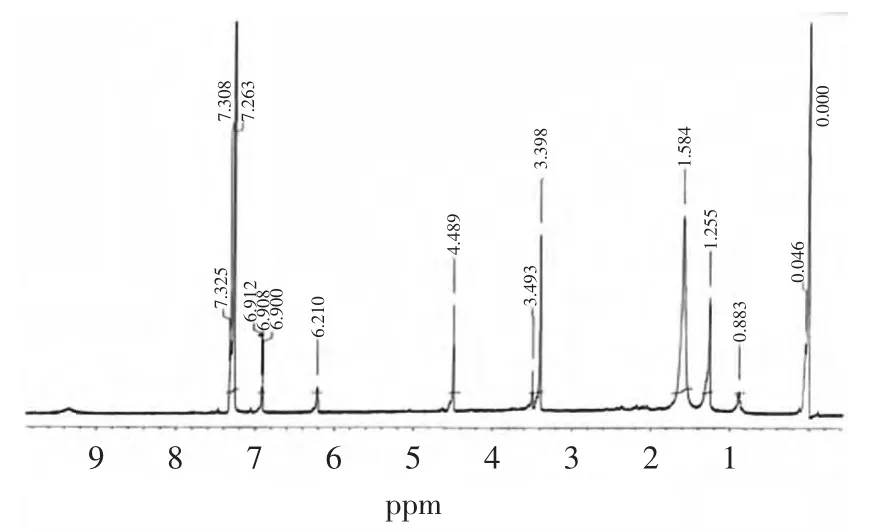
图1 2样品LWZc的1H-NMRFig.1 2 The 1H-NMR atlas of the purified compound Lwzc
综合以上分析,可初步推断该化合物的分子式为C13H17NO6,可能的结构式为:
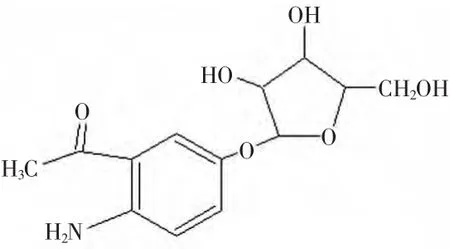
该结构式是新的结构。由于缺少碳谱和二维谱图,所以该化合物的结构式还需要进一步的验证。
3 结论
本研究通过对桦褐孔菌发酵液中清除自由基活性成分的分离,得出两种纯化合物LWZf和LWZc,通过对LWZf和LWZc的结构式进行分析,化合物LWZf为对羟基苯甲酸,是一种代表性酚酸类物质,能抗氧化、清除氧自由基。尽管LWZf为一已知化合物,但从桦褐孔菌中分离得到该化合物是首次报道。通过对化合物LWZc可能的结构式的推测,该化合物结构可能是一种新的结构,化合物LWZc的纯品清除自由基的能力相对较弱,可能是因为粗样中含有其他成分和杂质的协同作用,也可能是在分离的过程中活性成分被氧化。
[1]陈艳秋,李玉.桦褐孔菌的研究进展[J].微生物学通报,2005,32(2):124-127.
[2]YOO K P,HYANG B L,EUN-J J,et al.Chagamushroom extract inhibits oxidative DNA damage in human lymphocytes as assessed by comet assay[J].Bio Factors,2004,21:109-112.
[3]Kim Y O,Park H W,Kim JH,et al.Anti-cancer effect and structural characterization of endo-polysaccharide from cultivated mycelia of Inonotus obliquus[J].Life Science,2006,79(1):72-80.
[4]陈义勇,顾小红,汤坚.桦褐孔菌多糖的抗肿瘤活性[J].食品与生物技术学报,2011,30(1):65-69.
[5]Chen H,Zhang M,Qu Z,et al.Antioxidant activities of different fractions of poly-saccharide conjugates from green(Camellia sinensis)[J].Food Chemistry,2008,106(2):559-563.
[6]Asker M M S,Ahmed Y M,Ramadam M F.Chemical characteristics and antioxidant activity of exopolysaccharide fractions from Microbacterium rerregens[J].Carbohydrate Polymers,2009,77(3):563-567.
[7]Hu H,Zhang Z,Lei Z,et al.Comparative study of antioxidant activity and antiproliferative effect of hot water and ethanol extracts from the mushroom Inonotus obliquus[J].Journal of Bioscience and Bioengineering,2009,107(1):42-48.
[8]Xu X,Wu,Chen H.Comparative antioxidative characteristics of poly-saccharide-enriched extracts from natural sclerotia and cultured mycelia in submerged fermentation of Inonotus obliquus [J].Food Chemistry,2011,127(1):74-79.
[9]梁丽雅,张泽生,孙玮,等.桦褐孔菌醇提物的萃取分离及抗氧化活性研究[J].中北大学学报,2009,30(2):153-158.
[10]梁丽雅,张泽生,王玉本,等.桦褐孔菌抗氧化提取物体内抗氧化作用研究[J].食品科技,2009,30(7):146-148.
[11]回晶,宋雅娜,孙秀娟,等.桦褐孔菌多糖的体外抗氧化作用研究[J].食用菌学报,2006,13(2):29-31.
[12]张惠丽,杨松,李玉,等.桦褐孔菌多糖的提取及对肝癌细胞SMMC7721的抗增殖的研究[J].中国食用菌,2006,25(2):31-33.
[13]高晗,周婧琦,高雪丽,等.桦褐孔菌多酚的抗氧化性及其在食用油脂中的应用[J].食品科学,2008(12):39-42.
[14]高愿军,高雪丽,司俊娜.桦褐孔菌多酚清除自由基作用的稳定性研究[J].食品科学,2009,30(10):107-109.
[15]卢雪明,陈海霞,曲志爽,等.桦褐孔菌提取物抗氧化与糖苷酶抑制活性研究[J].天然产物研究与开发,2009,21:132-135.
[16]胡丰林,樊美珍.一种白僵菌代谢产物中生物活性物质的研究.菌物系统,2000,19(4):522-528.
[17]陆瑞利,胡丰林.一些裸子植物鲜叶提取物清除自由基的活性研究.西北植物学报,2003,23(6):982-986.
[18]王文东,杨宏伟,祝万鹏,等.凝胶层析-荧光分光光度法联用分析饮用水中铝的形态[J].环境化学,2007,26(1):79-81.
[19]翟爱华,王丽杰,张东杰,等.利用硅胶柱层析分离纯化平贝总碱的研究[J].食品科学,2009,30(1):119-121.

