华蟾素和顺铂对骨肉瘤 MG-63 细胞联合杀伤作用的研究
宋科官 张涛 严峰 孙远新 王海 周永飞
华蟾素和顺铂对骨肉瘤 MG-63 细胞联合杀伤作用的研究
宋科官 张涛 严峰 孙远新 王海 周永飞
目的探讨比较华蟾素 ( cinobufagin ) 协同顺铂 ( cisplatin ) 对人骨肉瘤细胞株 MG-63 的杀伤作用。方法体外培养骨肉瘤细胞株 MG-63 细胞,取对数生长期细胞进行实验;采用 MTT 比色法测定MG-63 细胞的生长抑制作用并计算细胞抑制率;流式细胞仪检测骨肉瘤细胞的凋亡率和细胞周期,观察细胞凋亡率的变化情况和药物对细胞周期的抑制作用;原位末端标记法 ( TUNEL ) 观察骨肉瘤细胞的凋亡情况并检测细胞凋亡率;相差显微镜观察骨肉瘤细胞生长状况及形态学上的改变。结果华蟾素和顺铂均对骨肉瘤细胞有生长抑制作用,华蟾素组、顺铂组及华蟾素+顺铂组在药物浓度不同时对骨肉瘤细胞的生长抑制作用各不相同,在药物浓度低于 80 µg / ml 时,各实验组药物对细胞的生长抑制作用随药物浓度的增加而上升;当药物浓度达到 80 µg / ml 时,华蟾素组和顺铂组药物对骨肉瘤细胞的生长抑制作用不再增加,但华蟾素+顺铂组药物对细胞的生长抑制作用在药物浓度达到 160 µg / ml 时,抑制作用仍强于其浓度为 80 µg / ml 时。各实验组在药物浓度相同时华蟾素+顺铂对骨肉瘤细胞的生长抑制作用明显强于单独应用华蟾素或者顺铂。结论华蟾素+顺铂对骨肉瘤 MG-63 细胞的联合杀伤作用明显强于单独应用顺铂或者华蟾素;在抑制骨肉瘤 MG-63细胞生长方面,华蟾素协同顺铂对细胞的杀伤作用效果显著,并且具有时间和浓度依赖性。
骨肉瘤;顺铂;细胞凋亡;骨肿瘤
华蟾素系传统中药中华大蟾蜍皮的水制剂,其主要成分为吲哚生物碱、还原糖、氨基酸以及蟾蜍毒素等。华蟾素具有清热解毒,利水消肿,化瘀溃坚等作用,已列为国家级的中药保护品种。近年来随着对华蟾素的药理作用和临床应用的深入研究,已证实华蟾素具有强心 、抗肿瘤、抗病毒、麻醉、止痛、促进骨髓增生等作用,并可调节肿瘤患者的细胞免疫和体液免疫功能[1]。华蟾素作为抗肿瘤中药制剂,在肿瘤治疗方面应用很广,对肝癌[2]、胃癌[3]、肺癌[4]等多种肿瘤都有一定的治疗作用[5-6]。毒理试验及临床实践证明其具有毒副作用小、使用安全可靠等优点。本研究主要通过体外培养骨肉瘤MG-63 细胞,分别将不同浓度的顺铂和华蟾素作用于该细胞株,并将二者协同对 MG-63 细胞的杀伤作用的效果同单独应用华蟾素或顺铂的效果作比较,为华蟾素在骨肉瘤化疗中的应用提供一定的依据。
材料与方法
一、材料
小牛血清 ( 杭州四季青生物工程材料研究所 )、二甲基亚砜 ( DMSO ) ( 江苏洪声化工厂 )、RPMI 1640培养粉 ( GIBCOBRL 公司 )、MTT ( 美国 Sigma 公司 )、Annexin V-FITC 细胞凋亡检测试剂盒 ( 碧云天生物科技研究所 )、细胞周期检测试剂盒 ( 碧云天生物科技研究所 )、Tunel 试剂盒 ( 普利来生物工程材料研究所 )、华蟾素注射液 [ 安徽金蟾药业公司,皖卫药准字 ( 1996 ),第 201597 号,药物批号:9803031 ]、顺铂注射液 ( 江苏豪森药业股份有限公司 )、流式细胞仪 ( 美国 Becton Dickinson 公司 )。
二、方法
1. 细胞培养:将 MG-63 骨肉瘤细胞株 ( 哈尔滨医科大学神经生物学教研室李呼伦教授提供 ),培养于含 10% 胎牛血清的 RPMI 1640 培养液中,置37 ℃、5% CO2孵箱中培养,并取对数生长期细胞进行实验。
2. 细胞形态学观察:相差显微镜下观察分别由华蟾素+顺铂、华蟾素及顺铂作用后的细胞生长状况及形态学上的改变。
3. MTT 法检测细胞的生长抑制作用:取对数生长期的 MG-63 细胞,制备细胞数为 4×104个 / ml的细胞悬液,设华蟾素组、顺铂组、华蟾素+顺铂组及空白对照组,接种于 96 孔的细胞培养板中,每孔 200 µl,每组 5 个复孔,培养过夜。于第 2 天上午分别加入 100 µl 含不同浓度的华蟾素、顺铂、华蟾素+顺铂 ( 20 µg / ml,40 µg / ml,80 µg / ml,160 µg / ml ) 及生理盐水,在加入药物后 48 h 后终止培养。各孔加入浓度为 5 mg / ml 的 MTT 20 µl 并继续培养 4 h,之后加入二甲基亚砜 ( DMSO ) 150 µl,37 ℃ 下避光置于摇床低速振荡 15 min,使结晶充分溶解。将 96 孔板放入酶联免疫检测仪中,以空白孔调零,测各孔 OD 490 nm 的吸光度值 ( A490 )。计算细胞抑制率:抑制率= ( 1 一实验孔测定 A 值 / 对照孔测定 A 值 ) ×100%。
4. Annexin V-FITC 检测细胞凋亡率:将 MG-63骨肉瘤细胞浓度调整至 5×105个 / ml,用普通细胞培养瓶培养,各个培养瓶中加入 1 ml 细胞悬液,并设华蟾素组、顺铂组、华蟾素+顺铂组及空白对照组。细胞贴壁盖度达 50% 左右时进行药物处理,分别在药物处理 12、24、48、96 h 后终止培养,收集对照组和处理组细胞。取 10~50 万重悬的细胞液,1500 r / min 离心 5 min,离心半径 16 cm,弃上清,用 195 µl Annexin V-FITC 结合液悬浮细胞,加入 5 µl Annexin V-FITC,轻轻摇匀后于 20~25 ℃ 避光条件下孵育 10 min。再将细胞液 1500 r / min 离心5 min,离心半径 16 cm,弃上清,加入 190 µl Annexin V-FITC 结合液悬浮细胞,之后加入 10 µl 碘化丙啶染色液,冰浴避光放置,随即进行流式细胞仪检测。计算并对比细胞凋亡率。
5. 细胞周期检测:将 MG-63 细胞以 5×105个 / ml 的浓度接种于 24 孔板中,每孔 100 µl 细胞悬液,并分为华蟾素组、顺铂组、华蟾素+顺铂组及空白对照组。置 37 ℃、5% CO2培养箱中培养,待细胞贴壁后,对照组换上新鲜培养液,处理组换上浓度为 80 µg / ml 的华蟾素、顺铂、华蟾素+顺铂培养液。分别继续培养 6、12、24、48 h 后,收集对照组和处理组细胞。分别用 PBS 洗涤细胞 2 次,再将细胞重悬于 75% 冰冻乙醇中 -20 ℃ 固定 1 h。之后用冷 PBS 洗涤细胞 1 次,再用 200~500 μl 冷PBS 重悬细胞,加入 RNase A 溶液 20 μl,37 ℃ 水浴 30 min,200 目筛网过滤,加入 400 μl 碘化丙啶( PI ) 染液,轻轻混匀后 4 ℃ 避光孵育 10~30 min。随即流式细胞仪分析细胞周期分布,最大激发波长为 488 nm。
6. 原位末端标记法 ( TUNEL ) 观察骨肉瘤细胞凋亡:将 MG-63 骨肉瘤细胞数调整至 5×105个 / ml,分别用华蟾素、顺铂及华蟾素+顺铂 ( 浓度均为160 μg / ml ) 及生理盐水作用于骨肉瘤 MG-63 细胞,并分别于 12、24、48、96 h 后取样,染色步骤按Tunel 试剂盒说明书进行。光镜下观察细胞染色呈棕褐色者为凋亡细胞,随机选择 5 个视野,计数至少800 个细胞,观察单位面积内细胞凋亡情况。
三、统计学处理
结 果
1. 相差显微镜下观察对照组细胞及药物作用:48 h 后不同实验组细胞生长状况及形态学的改变。对照组:细胞形态呈梭形,细胞核呈圆形,细胞曾单层贴壁生长,生长良好 (图1A );华蟾素+顺铂组:细胞大部分变小,变圆,染色质固缩且较多细胞发生死亡 (图1B );顺铂组可见细胞形态发生变形,呈不规则状,部分细胞脱壁发生死亡 (图1C );华蟾素组可见细胞形态改变较顺铂组类似,但死亡细胞的数量少于顺铂组 (图1D )。
2. MTT 检测法检测细胞的生长抑制作用:较空白对照组比较,华蟾素和顺铂均对骨肉瘤 MG-63细胞具有抑制作用,顺铂的抑制作用较华蟾素强;华蟾素+顺铂对细胞抑制作用明显强于华蟾素或顺铂。不同浓度药物的抑制作用各不相同,在药物浓度低于 80 µg / ml 时,各实验组的抑制作用随药物浓度的上升而抑制作用增加,在药物浓度达到 80 µg / ml,华蟾素和顺铂的抑制作用不再增加,但华蟾素+顺铂组的抑制作用在药物浓度为 160 µg / ml时,其抑制作用仍强于 80 µg / ml (表1~3 )。
表1 不同浓度华蟾素作用于 MG-63 细胞 48 h 后的 A 值和抑制率 (±s )Tab.1 A values and inhibitory rates of cinobufagin- at various concentrations on MG-63 cells 48hr after the treatment (±s )
华蟾素 µg/ml A490 抑制率 ( % ) 0 0.738±0.012 0 20 0.531±0.016 30±2.22 40 0.352±0.013 51±1.81 80 0.283±0.009 59±1.25 160 0.275±0.006 63±0.84
表2 不同浓度顺铂作用于 MG-63 细胞 48 h 后的 A 值和抑制率(±s )Tab.2 A values and inhibitory rates of cisplatin- at various concentrations on MG-63 cells 48hr after the treatment (±s )
顺铂组 µg/ml A490 抑制率 ( % ) 0 0.742±0.013 0 20 0.529±0.008 32±1.11 40 0.288±0.007 58±0.97 80 0.206±0.012 72±1.66 160 0.185±0.009 74±1.25
表3 不同浓-度华蟾素 + 顺铂作用于 MG-63 细胞 48 h 后的 A 值和抑制率 (±s )Tab.3 A values and inhibitory rates of cinobufagin + cisplatin at various concentrations on MG-63 cells 48hr after the treatment (±s )
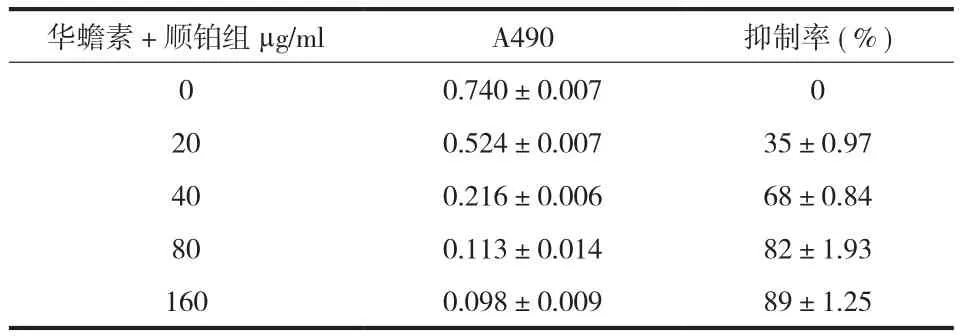
表3 不同浓-度华蟾素 + 顺铂作用于 MG-63 细胞 48 h 后的 A 值和抑制率 (±s )Tab.3 A values and inhibitory rates of cinobufagin + cisplatin at various concentrations on MG-63 cells 48hr after the treatment (±s )
华蟾素+顺铂组 µg/ml A490 抑制率 ( % ) 0 0.740±0.007 0 20 0.524±0.007 35±0.97 40 0.216±0.006 68±0.84 80 0.113±0.014 82±1.93 160 0.098±0.009 89±1.25
3. 流式细胞仪分析细胞在不同时间点的凋亡率变化情况:将华蟾素组、顺铂组、华蟾素+顺铂组 ( 浓度均为 80 µg / ml ) 及空白对照组进行比较,观察在不同时间点 MG-63 细胞株的凋亡情况。华蟾素组和顺铂组在 12、24、48、96 h,细胞凋亡率均高于空白对照组;华蟾素+顺铂组的作用效果在12 h 时,并不强于华蟾素或顺铂组;在 24 h 时华蟾素+顺铂组作用效果强于华蟾素或顺铂组 ( P=0.03 );在 48、96 h 时华蟾素+顺铂组的效果明显强于空白对照组 ( P=0.00 ) (表4 )。
4. 流式细胞仪分析细胞周期:将华蟾素组、顺铂组、华蟾素+顺铂组 ( 浓度均为 80 µg / ml ) 及空白对照组进行比较,观察在 6、12、24、48 h 等不同时间后细胞周期阻滞与凋亡的关系。流式细胞仪分析表明 80 µg / ml 的华蟾素与 MG-63 细胞株共培养对细胞周期的 S 期有抑制作用,与空白对照组比较有显著统计学意义 ( P=0.000 );顺铂对细胞抑制作用发生在 G0/ G1期,其抑制率较空白对照组比较有显著统计学意义 ( P=0.000 );而华蟾素+顺铂共同作用下的 MG-63 细胞在 G0/ G1、S 期均受抑制,其中 G0/ G1期抑制作用较空白对照组比较有显著统计学意义 ( P=0.001 ),S 期抑制作用较空白对照组比较有统计学意义 ( P=0.011 ) (表5 )。
5. 原位末端标记法 ( TUNEL ) 检测骨肉瘤细胞凋亡率:光镜下 ( Tunel×200 ) 用数字法随机选择 5 个视野进观察细胞凋亡情况,其中凋亡细胞的细胞核被染成为深棕色,阴性细胞则为淡绿色。将 MG-63骨肉瘤细胞分别用 160 µg / ml 浓度的华蟾素、顺铂及华蟾素+顺铂进行处理,经过 96 h 后,发现凋亡细胞的数量 ( 深棕色细胞 ) 随时间变化而出现不同。三个实验组的凋亡细胞数量均随着时间的延长而逐渐增加。在 12 h 时,细胞出现少量凋亡,但视野下的细胞仍以阴性细胞为主,三个实验组凋亡细胞的数量并没有明显的差异。在 48 h 时,华蟾素+顺铂组细胞的凋亡数量明显增多,凋亡率达到>56%,其余两实验组的细胞凋亡数量亦出现较多,但其凋亡分别为 41%、36%。在 96 h 时,华蟾素+顺铂组的细胞基本全部凋亡 ( 凋亡率为 96% ),细胞核全部染成深棕色,视野下未见淡绿色的阴性细胞,而其余两组仍可见部分阴性细胞被染成淡绿色,其凋亡率分别为 86% ( 顺铂组 )、80% ( 华蟾素组 ) (图2 )。
讨 论

图2 TUNEL 法分别检测华蟾素和顺铂作用下 12、24、48、96 h 各个时间点骨肉瘤细胞凋亡情况 A~D:为华蟾素 + 顺铂;E~H:分别为顺铂;I~L:为华蟾素;M~P:为阴性对照组 ( Tunel ×200 )Fig.2 The osteosarcoma apoptosis under the effects of cinobufagin and cisplatin were detected by TUNEL at 12, 24 48 and 96 hr A-D: Showed the effects of cinobufagin + cisplatin; E-H: Showed the effects of cisplatin; I-L: Showed the effects of cinobufagin; M-P: Was the negative control group ( Tunel ×200 )
骨肉瘤是最常见的骨骼系统恶性肿瘤之一,易发于青少年,不仅恶性程度高,而且远处转移早。尽管早期手术治疗结合新的辅助化疗已很大程度提高患者的 5 年生存 ( 50%~65% ),但目前仍有20%~40% 的患者死于骨肉瘤的远处转移。对于远处转移,目前化疗是唯一有效的方法[7-8]。目前临床上主要的化疗药物有顺铂、甲氨蝶呤、异环磷酰胺、阿霉素等,但这些药物均存在一定的副作用,长期化疗对患者机体造成较大的伤害。此外,这些化疗药物还具有耐药性的特点。因此,寻找一种新的药物,其能够协助或者替代这些化疗药物促进骨肉瘤细胞的凋亡,以减少化疗药物的使用时间和使用剂量,从而提高骨肉瘤患者的长期生存率显得尤为重要。
表4 华蟾素和顺铂在不同时间点导致的细胞凋亡率 ( %,±s, n = 4 )Tab.4 Apoptosis rates caused by cinobufagin and cisplatin at different time points ( %,±s, n=4 )
分组 凋亡率12 h 24 h 48 h 96 h空白组 12.21±0.63 15.21±0.56 16.24±0.78 14.25±0.56顺铂 23.61±1.73 36.09±1.21 44.91±1.62 35.32±1.23华蟾素 25.21±0.23 30.22±0.56 31.24±1.53 24.26±1.23华蟾素+顺铂 27.32±0.56 41.54±0.89 58.59±1.24 51.32±0.51
表5 华蟾素和顺铂在不同时间点对 MG-63 细胞周期的影响(±s )Tab.5 Effects of cinobu-fagin and cisplatin on the MG-63 cell cycle at different time points (±s )
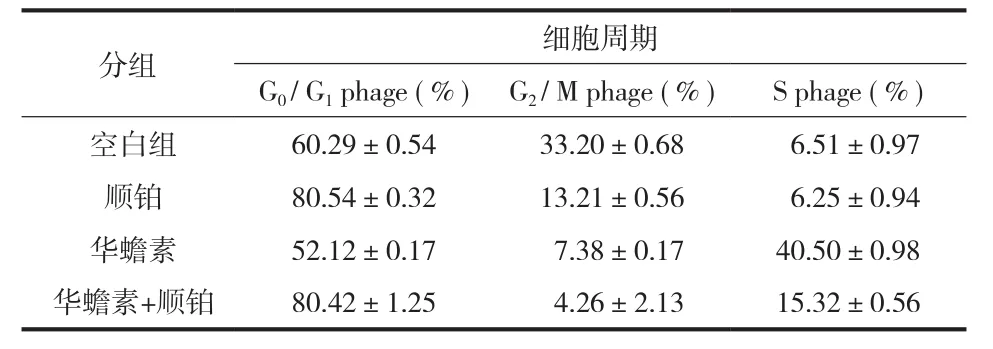
表5 华蟾素和顺铂在不同时间点对 MG-63 细胞周期的影响(±s )Tab.5 Effects of cinobu-fagin and cisplatin on the MG-63 cell cycle at different time points (±s )
分组 细胞周期G0/ G1phage ( % ) G2/ M phage ( % ) S phage ( % )空白组 60.29±0.54 33.20±0.68 6.51±0.97顺铂 80.54±0.32 13.21±0.56 6.25±0.94华蟾素 52.12±0.17 7.38±0.17 40.50±0.98华蟾素+顺铂 80.42±1.25 4.26±2.13 15.32±0.56
华蟾素作为抗肿瘤中药制剂,在肿瘤治疗方面应用很广,对肝癌[2]、胃癌[3]、肺癌[4]等多种肿瘤都有一定的治疗作用[5-6]。此外,相关毒理研究还证实其具有副作用小,使用安全的特点。在应用华蟾素治疗骨肉瘤的研究方面,相关研究较少,目前有研究[9]证实华蟾素能够将 MG-63 细胞阻断在 S 期,从而诱导骨肉瘤细胞凋亡。本研究首先通过 MTT检测法发现,华蟾素抑制骨肉瘤细胞的作用弱于顺铂,但其对顺铂具有共同抑制骨肉瘤细胞的作用,且呈现一定的浓度依赖性;华蟾素+顺铂的共同作用效果明显强于单独应用华蟾素或者顺铂。因此,在顺铂药物浓度相同的情况下,添加华蟾素可达到更佳的肿瘤抑制效果。此外,我们推测在华蟾素共同作用的条件下,亦可适当减少顺铂的药物浓度而达到相同的临床化疗效果,从而减少顺铂的毒副作用,但这需要进一步的相关毒理研究。
此外,我们还发现,在顺铂、华蟾素药物浓度达到 80 µg / ml,华蟾素和顺铂对 MG-63 细胞的抑制作用不再增加,但华蟾素+顺铂组的抑制作用在药物浓度为 160 µg / ml 时,其抑制作用仍强于80 µg / ml。因此,在顺铂药物浓度达到一定的情况下,其化疗效果不再增加,而在这种情况下,加入华蟾素能使其化疗效果在其原有的基础上继续上升。这就可能为顺铂的耐药性问题提供一定的解决方法,但二者相互作用下毒性作用是否增加仍有待于进一步研究。
细胞凋亡 ( apoptosis ) 是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。凋亡与肿瘤的发生、发展有很大关系,诱导肿瘤细胞凋亡,对肿瘤治疗有重要意义。有研究表明华蟾素对 HL-60细胞诱导细胞凋亡是通过 Bcl-2 和 PKC 途径[10-11],该机制可能与诱导 p53 基因介导的细胞周期阻滞和细胞凋亡有关[12]。盛秀胜等[13]研究认为,华蟾素能提高 Caspase-3 的表达,从而诱导白血病细胞 K562的凋亡,提示华蟾素可能通过改变凋亡相关基因的表达来实现诱导肿瘤细胞凋亡的作用。本研究通过原位末端标记法发现华蟾素、顺铂及华蟾素+顺铂作用下的细胞其凋亡率均随着时间的增加而升高,在 24 h 前,三个实验组的细胞凋亡率没有明显的差异,而在 48 h 后,华蟾素+顺铂组细胞凋亡率明显高于顺铂、华蟾素组,经统计学分析有意义。此外,我们通过流式细胞仪检测法亦证实了华蟾素+顺铂、顺铂、华蟾素促 MG-63 细胞的凋亡作用均具有时间依赖性,并且在 24 h 时,较其它各实验组比较,华蟾素+顺铂组的细胞凋亡率已有统计学意义。在 48、96 h 时,结果有明显的统计学意义。因此,顺铂、华蟾素及华蟾素+顺铂促骨肉瘤细胞的凋亡作用均有时间依赖性,但华蟾素+顺铂促骨肉瘤细胞的凋亡作用随着时间延长而增强的幅度明显高于华蟾素或者顺铂,这也证实了华蟾素具有协同顺铂促进骨肉瘤细胞凋亡的作用。
综上所述,华蟾素作为一种中药制剂,其对骨肉瘤细胞具有一定的抑制作用,其效果次于顺铂。但如将华蟾素结合顺铂共同作用于骨肉瘤细胞,其抑制作用明显增强,效果明显优于单独应用华蟾素或者顺铂,其抑制细胞增殖的机制可能与诱导细胞凋亡有关。因此,我们认为华蟾素可作为一种化疗药物的辅助治疗药物,能够和顺铂起共同抑制骨肉瘤细胞的作用,从而增强其抗肿瘤效果。
[1] 张磊, 齐刚, 张莉, 等. 高效液相色谱法测定大鼠血清中华蟾素浓度. 中国医院药学杂志, 2006, 26(6):692-694.
[2] 陈华, 孙宇, 崔晓楠. 华蟾素注射液对人肝癌HepG-2细胞DNA拓扑异构酶I的影响. 中国癌症杂志, 2010, 20(3): 197-201.
[3] 张爱霞, 耿桂香. 华蟾素联合化疗治疗消化道恶性肿瘤近期疗效观察. 医学理论与实践, 2007, 20(6):678.
[4] 熊良庚, 李琳琳. 华蟾素联合化疗治疗晚期非小细胞肺癌的临床观察. 实用肿瘤学杂志, 2005, 19(4):294.
[5] 左小东, 秦叔逵, 陈惠英, 等. AO/EB染色观察华蟾素诱导体外肿瘤细胞凋亡. 临床肿瘤学杂志, 1999, 4(3):35-39.
[6] Lau CB, Ho CY, Kim CF. Cytotoxic activities of Coriolus versicolor (Yunzhi) extract fll human leukemia and lymphoma cells by induction of apoptosis. Life Sci, 2004, 75(7):797-808.
[7] Ferrari S, Smeland S, Mercuri M, et al. Neoadjuvant chemotherapy with high-dose ifosfamide, high-dose methotrexate, cisplatin and doxorubicin for patients with localized osteosarcoma of the extremity: a joint study by the italian and scandinavian sarcoma groups. J Clin Oncol, 2005, 23(34):8845-8852.
[8] Longhi A, Fabbri N, Donati D, et al. Neoadjuvant chemotherapy for patients with synchronous multifocal osteosarcoma: results in eleven cases. J Chemother, 2001, 13(3):324-330.
[9] 宋科官, 马德胜, 王洪智, 等. 华蟾素对MG-63骨肉瘤细胞杀伤作用的实验研究. 中国骨肿瘤骨病, 2010, 9(3):231-235.
[10] Malla R, Gopinath S, Alapati K, et al. Downregulation of uPARand cathepsin B induces apoptosis via regulation of Bcl-2 and Bax and inhibition of the PI3K/Akt pathway in gliomas. PLoSOne, 2010, 5(10):13731.
[11] Tian X, Wang PP, Liu YP, et a1. Effect of bufalin-inducing apoptosison Bcl-2 and PKC in HL-60 cells. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2007, 15: 67-71.
[12] Goel A, Fuerst F, Hotchkiss E, et a1. Selenomethionine induces p53 mediated cell cycle arrest and apoptosis in human colon cancer cells. Cancer Biol Ther, 2006, 5(5):529-535.
[13] 盛秀胜, 徐玲娟. 华蟾素诱导人红白血病细胞K562凋亡及对Caspese-3表达的影响. 实用肿瘤杂志, 2007, 22(1):32-35.
( 本文编辑:王永刚 )
欢迎订阅 2014 年《中国骨与关节杂志》( 月刊 )
《中国骨与关节杂志》为国家卫生部主管,中国医疗保健国际交流促进会和北京中科康辰骨关节伤病研究所主办的骨与关节专业学术期刊,为中国科技论文统计源期刊( 中国科技核心期刊 )。刊号:CN10-1022/R,ISSN 2095-252X。本刊以广大从事骨与关节疾病临床和基础研究的工作者为主要读者对象。报道国内外有关骨与关节疾病的最新学术动态、临床诊治经验和基础科研成果。贯彻理论与实践、普及与提高、临床与基础密切结合的方针,反映国内外骨与关节疾病临床科研工作的重大进展,促进国内外专业学术交流。栏目为专家述评、专题、临床论著、基础研究、综述、病例报告等形式。采用在线审编系统,不接受纸质投稿。投稿请登录《中国骨与关节杂志》网站( http://www.cjb304.com ) 进入远程稿件采编系统进行操作,稿件全文应采用 word 格式。欢迎广大从事骨与关节疾病临床与基础研究的工作者踊跃投稿。
本刊为月刊,大 16 开本,国内外公开发行。每期定价 15.00 元,全年 180.00 元。热忱欢迎广大作者、读者直接向当地邮局订阅或向本编辑部订购杂志 ( 免邮寄费 )。
邮发代号:82-759
银行汇款:户名:北京中科康辰骨关节伤病研究所
开户行:北京银行阜裕支行
账号:0109 0373 1001 2010 5079 186
邮寄汇款:北京市阜成路 51 号解放军总医院第一附属医院《中国骨与关节杂志》编辑部收
邮编:100048
电话:010-66848868
传真:010-68989098
投稿网址:http://www.cjb304.com
E-mail:1022gk@sina.com
A study of combined killing effects of cinobufagin and cisplatin on osteosarcoma MG-63 cells
SONG Ke-guan, ZHANG Tao, YAN Feng, SUN Yuan-xin, WANG Hai, ZHOU Yong-fei. Department of Orthopedics, the frst Affliated Hospital of Harbin Medical University, Harbin, Heilongjiang, 150001, PRC
ObjectiveTo investigate and compare killing effects of cinobufagin and cisplatin on human osteosarcoma MG-63 cell lines.MethodsOsteosarcoma MG-63 cell lines were cultured in vitro, and logarithmic growth phase cells were selected for experiments. The methyl thiazolyl tetrazolium ( MTT ) colorimetry assay was used to determine the growth inhibitory effects on MG-63 cells and to calculate the cell inhibitory rate. The flow cytometry was used to detect the apoptosis rate and cell cycle of osteosarcoma cells, and to observe the changes of cell apoptosis rates and the inhibitory effects of drugs on cell cycles. The in situ terminal deoxynucleotidyl transferase ( TdT ) - mediated dUTP-X nick end labeling ( TUNEL ) was used to observe the apoptosis rate of osteosarcoma cells and to detect the cell apoptosis rate. The osteosarcoma cell growth status and morphological changes were observed by the phase contrast microscope.ResultsBoth cinobufagin and cisplatin could inhibit the growth of osteosarcoma cells. In the cinobufagin group, cisplatin group and cinobufagin + cisplatin group, the inhibitory effects on the osteosarcoma cell growth were not identical at different drug concentrations. When the drug concentration was less than 80 µg/ml, the cell growth inhibitory effects in all experimental groups would become greater with the increase of drug concentration. When the drug concentration reached 80 µg/ml, the cell growth inhibitory effects in the cinobufagin group and cisplatin group would not increase. And when the drug concentration reached 160 µg/ml, the cell growth inhibitory effects in the cinobufagin + cisplatin group were greater than the effects at the concentration of 80 µg/ml. In all experimental groups, the growth inhibitory effects of drugs at the same concentration on osteosarcoma cells in the cinobufagin + cisplatin group were greater than that in the single cinobufagin or cisplatin group.ConclusionsThe combined killing effects of cinobufagin + cisplatin on osteosarcoma MG-63 cells are obviously greater than thatof the single cisplatin or cinobufagin. In the inhibition of osteosarcoma MG-63 cell growth, the cell killing effects of cinobufagin combined with cisplatin are signifcant, with a time- and concentration- dependence.
Osteosarcoma; Cisplatin; Apoptosis; Bone neoplasms
10.3969/j.issn.2095-252X.2014.03.016
R738.1
黑龙江省教育厅资助项目 ( 11521165 )
150001 哈尔滨医科大学附属第一医院骨科
周永飞,Email: jingzyfei@sina.com
2013-04-06 )

