应用主成分和聚类分析法探索慢性阻塞性肺疾病表型的临床研究
吴饶仙,况九龙
随着对慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)炎性反应的深入研究,发现COPD是一个全身炎性反应疾病,不仅可以累及肺脏,同时还可以引起很多的肺外效应[1],如恶病质、肌肉萎缩、骨质疏松、心血管疾病等[2]。Han[3]等提出了COPD表型的概念,其含义是指能反映COPD不同患者间差异的一种或几种疾病特征,与临床预后(症状、疾病加重、对治疗的反应、疾病进展率或者病死率)相关。早在50年代将肺气肿分为红喘型(PP型)、紫肿型(BB型)两种[4],但这些都是基于患者临床特征的主观判断。目前COPD表型研究尚处于起步阶段,大多数的研究都是从一个临床表现或生理变化的特征进行分类,如临床症状表型、1 s用力呼气容积(FEV1)快速下降表型、气道疾病和肺气肿表型、频发急性加重表型、全身炎性反应表型等,这些不同的表型说明了COPD的异质性[5]。实际上,各表型间存在交叉和交互现象,所以COPD表型的研究就显得十分复杂和困难,并成为目前COPD研究的热点。本研究旨在通过对江西籍COPD患者临床特点,包括吸烟指数、年龄、性别、呼吸困难程度、气流受限程度、合并症、血清炎性因子水平等资料进行主成分分析(PCA)和聚类分析,可能将患者分为不同临床表型,以期发现COPD患者间的差异性,从而区分出具有独特预后或治疗特征的COPD患者,为使用更为恰当的治疗方法提供依据,实现个体化管理。
1 对象与方法
1.1 研究对象 选取南昌大学第二附属医院2011—2012年呼吸内科收治住院的主要诊断为COPD的患者157例,均符合中华医学会呼吸学会制定的《慢性阻塞性肺疾病诊治指南》2011修订版的标准[6]。排除:(1)诊断明确的其他肺部疾病患者,如肺炎、哮喘、支气管扩张等;(2)妊娠、哺乳期患者。
1.2 研究方法 所有患者均于清晨抽取空腹肘静脉血5 ml,置于无菌玻璃试管内,静置30 min,再给予1 000 r/min离心15 min,离心半径为0.5 cm,分离血清,-20 ℃低温冰箱中保存待测。白介素8(IL-8)、白介素-32(IL-32)和肿瘤坏死因子α(TNF-α)的测定采用酶联免疫吸附法(ELISA),IL-8和TNF-a试剂盒由深圳晶美生物工程有限公司(美国Genzyme公司特许分装)提供,严格按照药品说明书进行操作。
1.3 分析指标 年龄、性别、吸烟指数、呼吸困难程度〔根据国际呼吸困难程度量表(MMRC):0分,只在剧烈运动时呼吸困难;1分,快走或上坡时感到呼吸困难;2分,由于呼吸困难比同龄人走得慢或者以自己的速度在平地上行走时需要停下来呼吸;3分,在平地上行走100米或数分钟后需要停下来呼吸;4分,明显呼吸困难而不能离开房屋或换衣服时也感到气短〕、合并症(包括冠心病、高血压、心力衰竭、糖尿病)、1 s用力呼气容积占用力肺活量比值(FEV1/FVC)(GOLD分级根据气流受限程度:1、FEV1/FVC<70%,FEV1占预计值%>80%;2、FEV1/FVC<70%,50%≤FEV1占预计值%<80%;3、FEV1/FVC<70%,30%≤FEV1占预计值%<50%;4、FEV1/FVC<70%,FEV1占预计值%<30%或FEV1占预计值%<50%合并呼吸衰竭)、IL-8、IL-32、TNF-α。
1.4 统计学方法 采用SPSS 19.0统计软件进行统计分析。参与此次横断面研究的研究对象共157例,8项变量数据资料搜集完全有122例,余35例因缺乏肺功能资料而未进行分析。在聚类进行之前先根据反映各类特性的变量对原始数据进行预处理。因变量之间存在相互作用,故进行PCA分析,特征值≥1作为主要成分,减少变量间的相互作用,然后在PCA基础上进行最小方差聚类分析法分析得出树状图,获取COPD表型分类,以P<0.05为差异有统计学意义。
2 结果
2.1 根据GOLD分级进行分类 122例研究对象参与分析,其中94例为男性患者;年龄为53~89岁,平均年龄为(72±7)岁。不同GOLD分级FEV1占预计值%、FEV1/FVC、呼吸困难程度间差异有统计学意义(P<0.05),而年龄、性别、吸烟指数及IL-8、IL-32、TNF-α水平间差异无统计学意义(P>0.05,见表1)。
2.2 8个临床变量聚类分析法分析 所有变量可分成3类(见图1),说明变量之间并非完全独立。
2.3 8个变量的PAC分析 将8个指标所有数据进行PAC分析,得出3个主要成分(特征值>1,见表2),在所有变量中方差累积贡献率约为73.1%。主成分1包括 IL-8、IL-32、TNF-α;主成分2包括年龄、FEV1占预计值%;主成分3包括年龄、合并症、呼吸困难程度;成分4~8因特征值<1不继续分析。
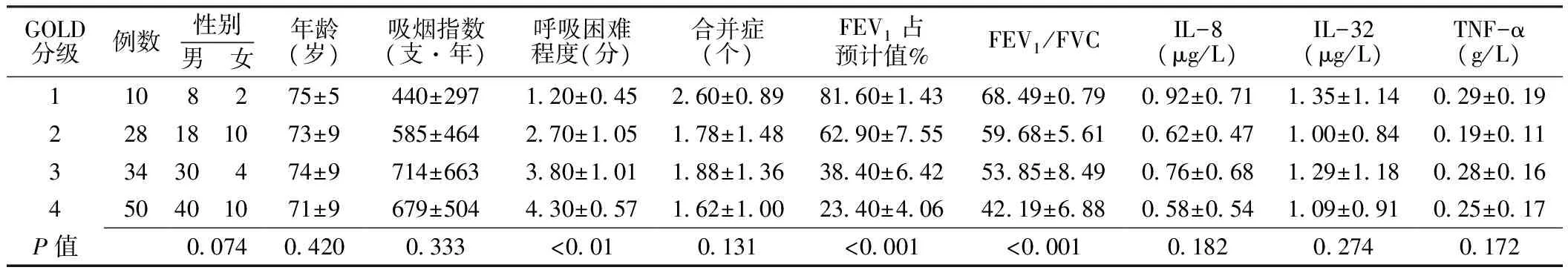
表1 122例COPD患者的特征按GOLD分级结果Table 1 Characteristics of the 122 chronic obstructive pulmonary disease subjects according to GOLD stage
注:FEV1占预计值%=1 s用力呼气容积占预计值百分比,FEV1/FVC=1 s用力呼气容积占用力肺活量比值,IL-8=白介素8,IL-32=白介素32,TNF-α=肿瘤坏死因子α
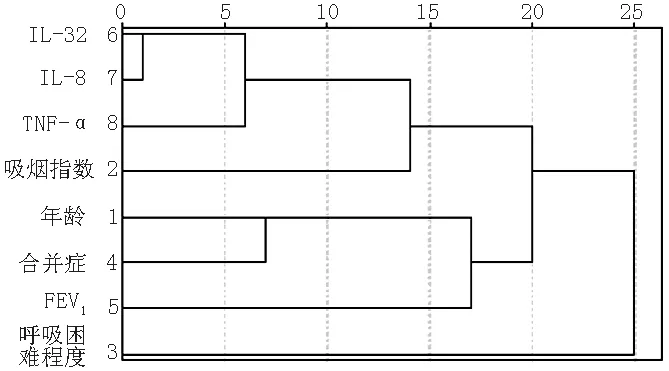
注:水平长度表示变量之间的相似程度;FEV1=1 s用力呼气容积,TNF-α=肿瘤坏死因子α,IL-8=白介素8,IL-32=白介素32
图1 8个临床变量系统聚类所得树状图
Figure1 Dendrogram illustrating the results of the cluster analysis of clinical variables
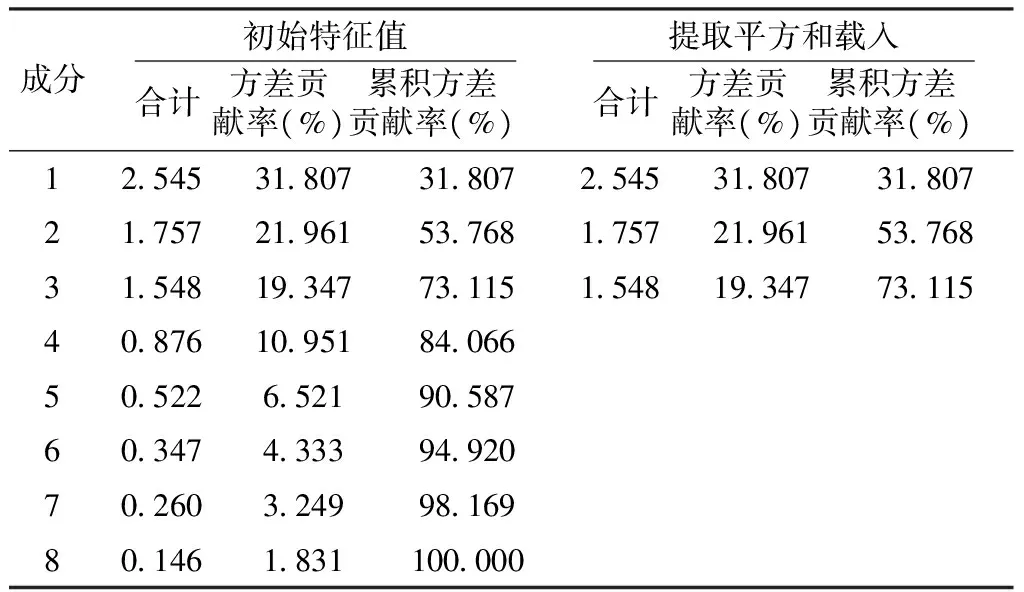
表2 主成分分析各成分的总方差Table 2 The total variance of the main components of PCA
注:特征值>1为主成分

表3 主成分分析3个主成分的矩阵Table 3 The matrix of three main components of PCA
2.4 122例COPD患者的聚类分析 122例COPD患者在PCA分析得到三个主要成分的基础上进行聚类分析得到的树状图(见图2)。经过伪F和伪t2检验将所有研究对象分为四类(见表4),从表中我们可获知不同的表型之间存在明显的差异。(1)相对老年患者,吸烟指数高,中重度气流受限,重度呼吸困难,合并症少,炎症指标明显升高;(2)老年患者,中度气流受限,中度呼吸困难,吸烟指数低,合并症多,炎症指标明显升高;(3)与第2类比较,第3类为相对年轻患者,重度气流受限,重度呼吸困难,合并症少,吸烟指数低,炎症指标轻度升高;(4)与第1类比较,第4类患者吸烟指数低,合并症少,轻度呼吸困难,炎症指标升高不明显。1组与4组用FEV1不能区分,进行独立样本t检验,除年龄外余指标P<0.05,均有统计学意义。2组与3组除年龄外,余指标P<0.05,均有统计学意义。
3 讨论
COPD是一个高发病率的呼吸系统慢性病,起病隐匿,临床表现不典型,难以让患者引起重视,而COPD的患病率、死亡率均逐年攀升。在全球范围内,COPD在所有慢性病中高居第4位[7],预计到2030年,COPD将成为全球第3位死亡原因[8]。2011年COPD全球策略修订版对COPD的定义进行了更新[9]:COPD是一种可以预防和治疗的常见疾病,其特征为持续存在的气流受限,气流受限呈进行性发展,伴有气道和肺对有害颗粒或气体导致的慢性炎性反应的增加,急性加重及合并症影响患者整体疾病的严重程度。慢性炎症是目前患者发病机制的主流观点。无论是在稳定期、还是在急性加重期,系统性的炎症可能是COPD患者产生全身效应的原因。
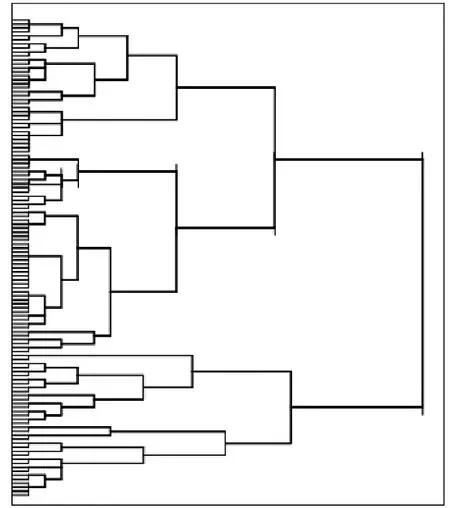
注:每个小格表示1例患者,水平长度表示患者之间特征的相似程度
图2 122例COPD患者系统聚类所得的树状图
Figure2 Dendrogram illustrating the results of the cluster analysis in 122 chronic obstructive pulmonary disease subjects
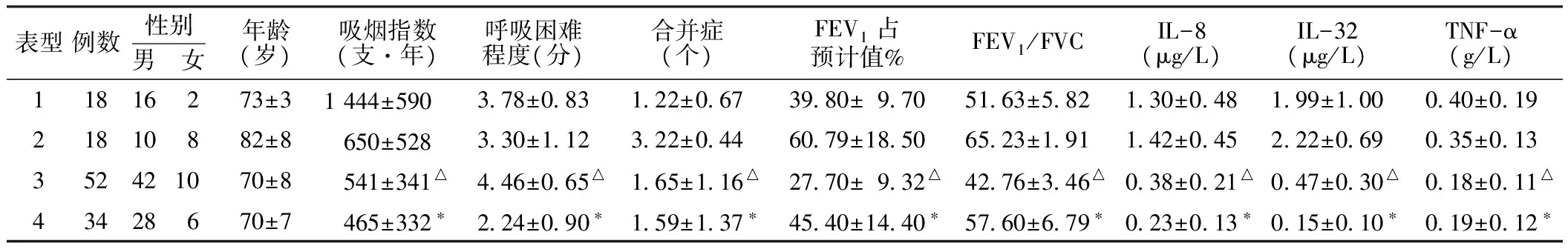
表4 基于主成分分析后122例COPD患者聚类分析结果Table 4 Characteristics of the 122 chronic obstructive pulmonary disease subjects according to the four phenotypes identified using principal component analysis-based cluster analys
注:*表示与1组比较,P<0.05;△表示与2组比较,P<0.05
慢性炎症让COPD的临床表现愈发复杂、多样,使COPD呈现出异质性。为了更好地研究COPD,从纷杂的临床表现中发现COPD的个体化差异而进行个体化治疗。然而临床上COPD的诊断,仍主要以肺功能为金标准,在评估方面,也仅仅以FEV1作为单一的评估指标。2011版GOLD在评估COPD患者方面,做出了巨大的调整,综合多个指标对COPD进行多维的评估,以便尽可能地对COPD患者实现个体化治疗。
聚类分析是将相似的研究对象归类的过程。在此之前,很少研究使用聚类分析评估呼吸道疾病表型。本研究采用聚类分析方法的研究目的是利用这种方法对COPD患者进行归类研究,探索GOLD分类不能识别的表型。曾有学者建议使用传统的分类方法识别COPD表型,其实2型和3型描述的特征类似于传统分类,我们也识别了GOLD不能识别的表型(1型和4型)。然而这些表型后续的纵向研究对提高了解COPD的发生发展过程非常重要。
PCA也称主分量分析,是从多个数值变量之间的相互关系入手,利用降维的思想,将多个变量化为少数几个互不相关的综合变量的统计方法。这种方法最早应用于气道疾病,特别适用于消除变量间重叠导致集群结构可能损坏的问题[10]。在聚类分析前,本研究使用PCA方法平均转化并确认聚类分析中的变量。同时本研究在聚类分析前未使用PCA分析变量,对另一个群集初始变量的总数进行分析,获得了三个表型,然而其中几个变量重叠非常明显,包括年龄、呼吸困难、炎症指标、吸烟指数。这种重叠表明,没有初始PCA聚类的表型鉴定可能没有临床意义,故PCA是聚类分析确认变量之前非常必要的转化方式。
本研究采用这两种方法对临床收集的大量数据进行分析,结果与按GOLD分级进行的分类有明显的区别,结果可以将研究对象分成4类:(1)相对老年患者,吸烟指数高,中重度气流受限,重度呼吸困难,合并症少,炎症指标明显升高;(2)老年患者,中度气流受限,中度呼吸困难,吸烟指数低,合并症多,炎症指标明显升高;(3)与第2类比较,第3类为相对年轻患者,重度气流受限,重度呼吸困难,合并症少,吸烟指数低,炎症指标轻度升高;(4)与第1类比较,第4类患者吸烟指数低,合并症少,轻度呼吸困难,炎症指标升高不明显。
本研究发现部分呼吸困难程度明显不同的患者,气流受限程度却相似,分布在同一GOLD分类中。这说明COPD患者之间存在异质性,故临床我们需要合多维指标对COPD患者进行分析。聚类分析临床变量之间的关系,呼吸困难与FEV1仅表现为中度相关[11]。比较那些不能基于FEV1区别的受试者(表型1和4无法区分),研究发现受试者随着年龄的增加,呼吸困难程度加重,慢性心衰发病率增加,炎症指标升高。推测,慢性心脏衰竭和体力活动的减少,或许影响呼吸困难程度加重。事实上,其他研究发现,受试者即使轻中度的气流受限,也会导致日常活动下降,这与呼吸困难加重,慢性心脏衰竭和死亡率增加相关联[12-13]。
本研究还发现GOLD分级相似的患者临床特征大相径庭,包括症状、合并症和呼吸困难程度,但危险因素或死亡原因不同,患者使用吸入疗法的效果可能不同。事实上,相对减少死亡率的风险不仅取决于有效的治疗,同时也受死亡率基线分布的人群数量和各种共存的条件(如年龄、合并症和吸烟)[14]。目前临床通常根据气流受限程度制定治疗方案,我们认为这种策略适合以肺内疾病为主,如使用支气管扩张剂后评估FEV1和症状,但不适合有严重肺外疾病的患者。因此,综合患者自身情况制定个体化治疗方案比以单一疾病为临床指标指导合并多种慢性病患者的治疗更为适宜。
随着研究的深入还发现,COPD是一种以肺部炎症为核心伴全身炎性反应的综合征,多种生物标志物可能可以用来描述疾病不同时间段的发病机制及特征。我们也可以选择生物标志物来解决疾病的具体问题或治疗。TNF-α是一种与感染密切相关的细胞因子,具有多种前炎性递质的功能,是免疫反应和炎性反应中的重要递质,主要由单核细胞、巨噬细胞产生,可以诱导中性粒细胞释放IL-8递质[15-16]。IL-8趋化作用使气道管腔内中性粒细胞聚集及管壁T淋巴细胞浸润,并使其活性增加,从而在COPD气道炎症的发生发展过程中以及气道阻塞中发挥重要作用。同时,中性粒细胞弹性蛋白酶的释放又能诱导气道上皮细胞IL-8基因的表达,引起其进一步分泌,形成恶性循环,导致气道慢性炎症和持续损伤[17]。
2005年,美国科罗拉多大学Dinarello等[18]在用基因芯片方法研究IL-18可诱导基因时发现了一种新型IL-32,简称IL-32。IL-32作为一种新发现的炎症细胞因子,主要是由自然杀伤细胞、T细胞上皮细胞及周围血中的单核细胞产生分泌[18-19]。2008年,Calabrese等[19]首次利用免疫组化技术研究了IL-32对COPD炎症及病情发展的影响,研究结果表明IL-32在COPD患者中表达增加,参与了COPD特殊的免疫反应,并有可能影响疾病的进展。本研究发现IL-8、IL-32、TNF-α与年龄及吸烟指数呈正相关,与FEV1%呈负相关。但是IL-32的功能、在气道反应中的作用途径及各个亚型之间的相互作用仍不清楚。因此,IL-32在气道炎症中的更进一步研究可能为气道炎症治疗提供新的切入点。
总之,目前根据GOLD分级不能准确地将COPD患者进行分层和指导治疗,因为它不能区分患者明显不同的表型。我们认为未来的临床研究根据风险评估分析结果(如死亡率风险),而不是某一个的参数(例如FEV1)。本研究使用PCA和聚类分析方法综合评估COPD患者并将其进行分类,与先前应用单一的气流受限指标分级进行疾病分期相比较,具有明显的优越性,也说明了COPD的复杂性。这种方法还可以应用于其他具有不同特征的COPD患者进行分组。本研究认为使用PCA和聚类分析方法能更好地描述COPD的异质性,为临床实践和研究提供更有力的证据,最终的目的是为了寻找更优更适宜的个体化治疗方法。
本研究前瞻性收集临床资料,基于肺功能标准诊断COPD,联合实验室检测COPD患者IL-8、IL-32、TNF-α水平,受试者包含GOLD所有分期病例,并且本研究使用的聚类分析法在PCA分析的基础上分析,从而得出四个表型。但是,也存在很多的限制与不足:(1)数据不完整的研究对象不能参与分析。(2)由于时间和条件的限制,本研究的对象全部来自南昌大学第二附属医院呼吸内科,样本含量有限,研究所得到的结果尚不能代表COPD患者的整体情况。(3)由于时间的局限,本研究只进行了横断面调査,没有纵向评估各指标对COPD的长期效果。(4)根据临床变量,肺功能检查和实验室检测确定表型,没有影像或问卷调查进行分析。扩大样本含量,对表型的鉴定过程加入更多的其他相关变量如COPD发病机制(如支气管扩张可逆性、峰流量变化、遗传性过敏症、α1-抗胰蛋白酶、肺气肿或痰生产嗜酸粒细胞性气道炎症、呼出气一氧化氮分数或其他生物标志物)可能会增加我们识别表型的准确性。目前临床治疗效果或一些治疗反应,也有可能影响到我们临床表型的鉴定。这些假说需要我们进一步的研究探索。
1 Zhong N,Wang C,Yao W,et al.Prevalence of chronic obstructive pulmonary disease in China:A large,population-based survey[J].Am J Respir Crit Care Med,2007,176(8):753-760.
2 Mannino DM,Diaz-Guzman E.Interpreting lung function data using 80% predicted and fixed thresholds identifies patients at increased risk of mortality[J].Chest,2012,141(1):73-80.
3 Han MK,Agusti A,Calverley PM,et al.Chronic obstructive pulmonary disease phenotypes:The future of COPD[J].Am J Respir Crit Care Med,2010,182(5):598-604.
4 Dornhorst AC.Respiratory insufficiency(Frederick Price Memorial Lecture)[J].Lancet,1955,265(6876):1185-1187.
5 陈亚红,姚婉贞.慢性阻塞性肺疾病表型的研究进展[J].中华结核和呼吸杂志,2011,34(8):619-622.
6 Nussbaumer-Ochsner Y,Rabe KF.Systemic manifestations of COPD[J].Chest,2011,139(1):165-173.
7 Smolonska J,Wijmenga C,Postma DS,et al.Meta-analyses on suspected chronic obstructive pulmonary disease genes:A summary of 20 years′ research[J].Am J Respir Crit Care Med,2009,180(7):618-631.
8 Miravitlles M,Calle M,Soler-Catalua JJ.Clinical phenotypes of COPD:Identification,definition and implications for guidelines[J].Arch Bronconeumol,2012,48(3):86-98.
9 Vogt W,Nagel D.Cluster analysis in diagnosis[J].Clin Chem,1992,38(2):182-198.
10 Ben-Hur A,Guyon I.Detecting stable clusters using principal component analysis[J].Methods Mol Biol,2003,224:159-182.
11 Curtis JR,Deyo RA,Hudson LD.Pulmonary rehabilitation in chronic respiratory insufficiency:Health-related quality of life among patients with chronic obstructive pulmonary disease[J].Thorax,1994,49(2):162-170.
12 Garcia-Aymerich J,Serra I,Gómez FP,et al.Physical activity and clinical and functional status in COPD[J].Chest,2009,136(1):62-70.
13 Watz H,Waschki B,Boehme C,et al.Extrapulmonary effects of chronic obstructive pulmonary disease on physical activity:A cross-sectional study[J].Am J Respir Crit Care Med,2008,177(7):743-751.
14 Kent DM,Hayward RA.Limitmions of applying summary results of clinical trials to individual patients:The need for risk stratification[J].JAMA,2007,298(10):1209-1212.
15 刘慧芳,李风森,杜丽娟.AECOPD病情严重程度与痰中IL-8、TNF-α水平的关系研究[J].临床肺科杂志,2008,13(9):1122-1123.
16 朱哗涵,蒋军红,黄建安.哮喘、慢性阻塞性肺病(COPD)急性加重期患者痰中炎性标志物变化以及与肺功能的关系研究[J].苏州大学学报:医学版,2005,25(2):317-319.
17 Williams TJ,Jose PJ.Neutrophils in chronic obstructive pulmonary disease[J].Novartis Found Symp,2001,234:136-141.
18 Dinarello CA,Kim SH.IL-32,a novel cytokine with a possible role in disease[J].Ann Rheum Dis,2006,65(Suppl 3):iii61-64.
19 Calabrese F,Baraldo S,Bazzan E,et al.IL-32,a novel proinflammatory cytokine in chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2008,178(9):894-901.

