黑灵芝多糖对小鼠腹腔巨噬细胞甘露糖受体的影响
帅小雪,李文娟,刘丹凤,王玉婷,朱科学,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
黑灵芝多糖对小鼠腹腔巨噬细胞甘露糖受体的影响
帅小雪,李文娟,刘丹凤,王玉婷,朱科学,谢明勇*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
目的:研究黑灵芝多糖(polysaccharides from Ganoderma atrum,PSG-1)对体外培养的小鼠腹腔巨噬细胞甘露糖受体(mannose receptor,MR,CD206)的影响。方法:不同质量浓度的PSG-1作用巨噬细胞后,用流式细胞仪测定细胞表面MR的表达,反转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)检测巨噬细胞MR的mRNA表达水平;以MR抑制剂甘露聚糖预处理细胞后加入PSG-1,用流式细胞仪检测巨噬细胞的吞噬功能,酶联免疫法测定培养上清液中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)的含量,RT-PCR检测细胞TNF-α、IL-1β的mRNA表达水平。结果:PSG-1可上调巨噬细胞表面MR的表达及MR mRNA水平;与单独PSG-1处理组相比,甘露聚糖预处理可明显抑制PSG-1增强的巨噬细胞吞噬功能和诱导细胞分泌IL-1β,对TNF-α的分泌则无影响。结论:MR能部分介导PSG-1对小鼠腹腔巨噬细胞的免疫调节作用。由此推测,MR可能是PSG-1发挥调节免疫作用的受体之一。
黑灵芝多糖;巨噬细胞;甘露糖受体;吞噬功能;细胞因子
黑灵芝既是我国传统的药用真菌也是民间常见的食品配料,它具有多方面的生物活性。研究表明食用黑灵芝可补肾强精、延缓衰老、增强免疫力,对肿瘤、炎症、糖尿病等有很好的疗效[1]。现代研究认为,从黑灵芝中提取的水溶性成分黑灵芝多糖是黑灵芝生物学作用的主要功效成分[2]。多糖具有免疫调节、抗肿瘤、抗炎、抗病毒、抗氧化、抗辐射、降血糖、降血脂、保肝等多种功能[3],其中多糖的免疫调节作用是多糖类物质的最基本作用,研究发现多糖激活免疫细胞发挥免疫调节作用是通过与细胞表面的受体相结合而介导免疫反应[4]。
甘露糖受体(mannose receptor,MR,CD206)属于C型凝集素样受体,是钙依赖性Ⅰ型跨膜蛋白受体,可识别和结合以D-甘露糖、L-岩藻糖和N-乙酰葡萄糖胺等糖残基为末端的糖类物质[5]。本实验室从黑灵芝中分离纯化出一种由甘露糖、半乳糖和葡萄糖组成的水溶性黑灵芝多糖(polysaccharides from Ganoderma atrum,PSG-1),3 种单糖的物质的量比为1∶1.28∶4.91[6]。前期研究已证明PSG-1具有调节小鼠腹腔巨噬细胞免疫功能的作用[7],甘露糖作为PSG-1的三大组分之一,提示PSG-1与MR具有潜在的结合能力。但是PSG-1对机体免疫的调节作用是否与MR结合有关,含有甘露糖的PSG-1是否可作为MR的候选配体从而激活细胞内信号通路,调节机体免疫功能,这些内容仍有待进一步的研究。因此,在前期研究的基础上,本实验采用体外培养小鼠腹腔巨噬细胞,研究PSG-1对巨噬细胞MR的影响及其是否通过MR影响细胞的吞噬功能和细胞因子的分泌。
1 材料与方法
1.1 动物、材料与试剂
BALB/c清洁级小鼠,雌性,体质量(22±2)g,购自南昌大学医学院动物房;水溶性黑灵芝多糖PSG-1(纯度>99.8%)由本实验室自制。
RPMI-1640培养基 北京索莱宝科技有限公司;胎牛血清 美国HyClone公司;甘露聚糖 美国Sigma公司;FITC-大鼠抗小鼠CD206抗体 英国AbD Serotec公司;异硫氰酸荧光素标记的葡聚糖(FITC-dextran)美国Sigma公司;反转录试剂盒 美国Fermentas公司;聚合酶链式反应(polymerase chain reaction,PCR)试剂盒 北京全式金公司;小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒、白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒 武汉博士德生物工程有限公司。
1.2 仪器与设备
Varioskan Flash多功能酶标仪 美国Thermo公司;3K15-高速冷冻离心机 美国Sigma 公司;FACSCaliburTM流式细胞仪 美国Becton Dickinson公司;MyCycler PCR扩增仪、ChemiDoc XRS+凝胶显像系统 美国Bio-Rad公司。
1.3 方法
1.3.1 小鼠腹腔巨噬细胞的分离、纯化及培养
小鼠分笼饲养于空调温室内,温度(22±2)℃,相对湿度50%~60%,自动调控昼夜各12 h,饲料喂养,自由饮水,实验前静养1 周。小鼠颈椎脱臼处死,75%乙醇中浸泡3~5 min,取出小鼠,至于无菌培养皿中,腹腔注入6~8 mL预冷的RPMI-1640培养基,用棉球轻揉腹部2~3 min后吸出腹腔液置于离心管中,重复洗2 次,收集以上培养基,1 400 r/min离心5 min,弃上清液收集巨噬细胞,用含体积分数10%胎牛血清的RPMI-1640培养基重悬巨噬细胞并接种于培养瓶中,置于CO2培养箱(5% CO2、37 ℃)培养4 h后,轻轻吸弃培养液,用RPMI-1640培养基洗去未贴壁细胞,重复洗涤2 次,即得到纯化的腹腔巨噬细胞。台盼蓝拒染法检测其活性(>95%),分别按每孔1×106个细胞接种于6 孔细胞培养板中。
1.3.2 流式细胞仪检测巨噬细胞表面MR的表达
不同质量浓度PSG-1刺激6 孔板中细胞24 h后进行收集,移入标记好的 EP管中,1 400 r/min离心5 min,弃尽培养液,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞2 次,加100 μL PBS重悬细胞;加入10 μL FITC标记的大鼠抗小鼠CD206抗体,同型对照管加入10 μL对照试剂FITC-IgG2a,4 ℃避光孵育30 min;孵育结束后,用PBS洗2 次,去除游离的抗体;重悬细胞成单个细胞悬液,将细胞液定量在1 mL左右,上流式细胞仪检测,记录各标本的阳性细胞百分率。
1.3.3 反转录PCR(reverse transcription PCR,RT-PCR)检测巨噬细胞MR mRNA表达水平
细胞处理方法同1.3.2节,收集各组细胞以Trizol法提取总RNA,在20 μL反应体系中进行反转录为cDNA,每组取2 μL cDNA 用于PCR扩增,将得到PCR产物进行电泳,电泳后的凝胶通过凝胶成像仪观察,并对条带进行灰度分析,以β-actin为内参,测定其mRNA的相对表达量。
1.3.4 FITC-dextran测定巨噬细胞吞噬功能
用甘露聚糖2.5、5.0、10.0 mg/mL分别预处理巨噬细胞30 min,再予以160 μg/mL PSG-1刺激,另设空白对照组和160 μg/mL PSG-1组,刺激细胞24 h后弃去培养液并以PBS洗涤2 次,加100 μL PBS重悬细胞,加入FITC-dextran(5 mg/mL)2 μL,37 ℃继续孵育1 h。用PBS终止反应,洗涤细胞2次,并重悬细胞。流式细胞仪分析细胞对FITC-dextran的吞噬作用。
1.3.5 ELISA法测定TNF-α、IL-1β的含量
细胞处理方法同1.3.4节,刺激结束后,收集巨噬细胞上清液,采用ELISA法测定TNF-α、IL-1β的含量,具体操作方法参照相应的试剂盒说明书进行。
1.3.6 RT-PCR检测巨噬细胞TNF-α、IL-1β mRNA表达水平
细胞处理方法同1.3.4节,处理后的各组细胞进行RT-PCR,以β-actin为内参,测定TNF-α、IL-1β mRNA的相对表达量。实验中用到的引物序列及退火温度如表1所示。
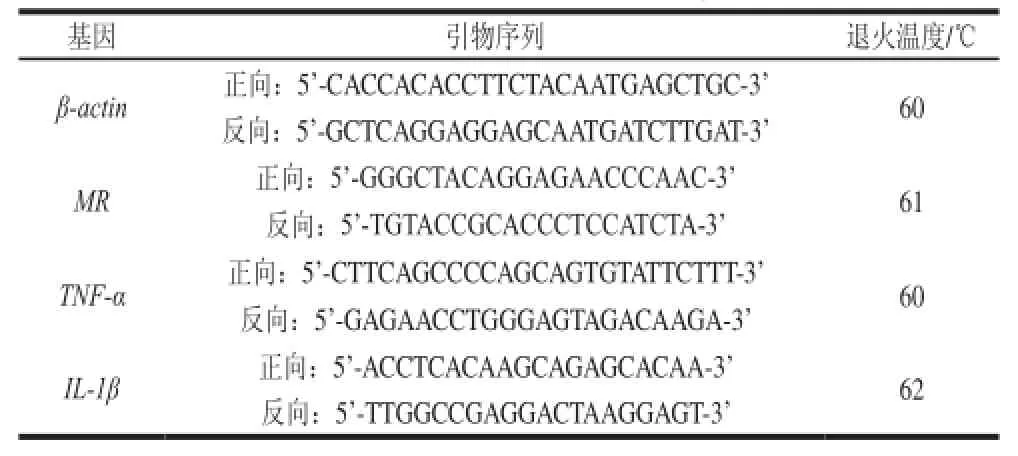
表1 引物序列及退火温度Table1 Primer sequences and annealing temperatures
1.4 数据分析
采用GraphPad Prism 5.0软件作图,实验数据以±s表示,采用统计软件SPSS Statistics 19.0对实验结果进行单因素方差分析,P<0.05时,组间差异具有统计学意义。
2 结果与分析
2.1 PSG-1对小鼠腹腔巨噬细胞表面MR表达的影响
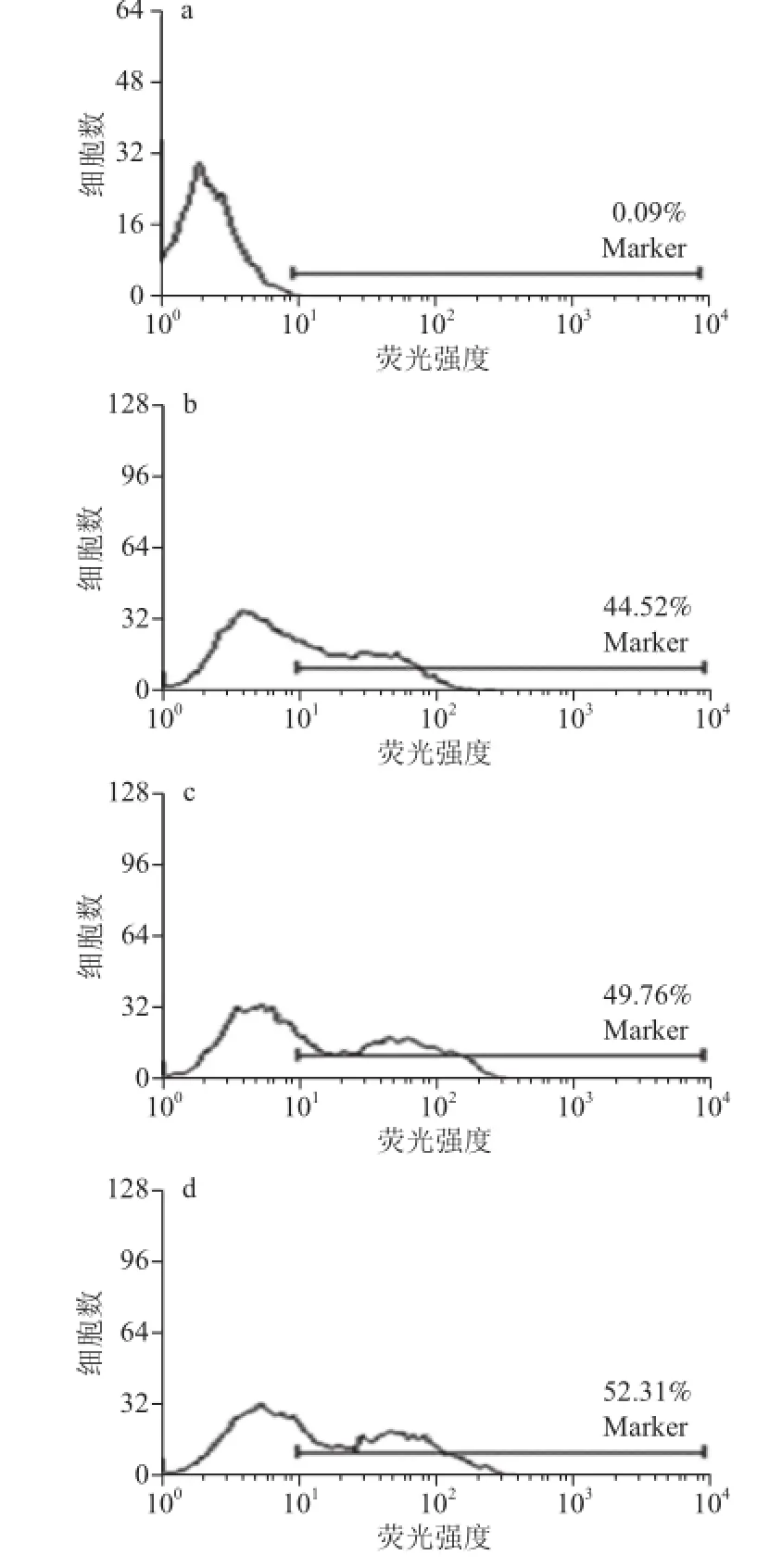

图1 PSG-1对小鼠腹腔巨噬细胞表面MR表达的影响Fig.1 Effect of PSG-1 on the expression of MR on the surface of mouse peritoneal macrophages
使用FITC-大鼠抗小鼠CD206抗体对巨噬细胞表面MR进行标记,流式细胞仪检测阳性细胞率以反映PSG-1对小鼠腹腔巨噬细胞表面MR表达的影响。如图1所示,正常巨噬细胞表面有MR的表达,加入PSG-1后,细胞表面MR表达呈剂量依赖性的增加,其中160 μg/mL PSG-1组比空白对照组上升了26.71%。
2.2 PSG-1对小鼠腹腔巨噬细胞MR mRNA表达水平的影响
如图2所示,RT-PCR进一步检测腹腔巨噬细胞MR mRNA表达水平,结果发现与流式细胞仪检测的结果相似,加入PSG-1处理细胞后,MR mRNA表达量随着PSG-1质量浓度的升高而上升。
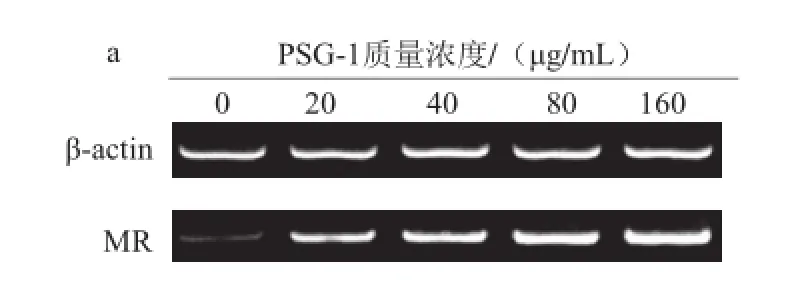

图2 PSG-1对小鼠腹腔巨噬细胞MR mRNA表达水平的影响Fig.2 Effect of PSG-1 on the mRNA expression level of MR in mouse peritoneal macrophages
2.3 MR抑制剂对PSG-1诱导小鼠腹腔巨噬细胞吞噬功能的影响


图3 PSG-1通过MR影响小鼠腹腔巨噬细胞吞噬FITC-dextran的能力Fig.3 E ffect of PSG-1 on the phagocytosis of FITC-dextran by mouse peritoneal macrophages via MR
流式细胞仪检测各处理组细胞吞噬FITC-dextran的能力,如图3所示,与空白对照组相比,PSG-1能显著增强小鼠腹腔巨噬细胞吞噬FITC-dextran的能力;预先给予甘露聚糖2.5、5.0、10.0 mg/mL预处理细胞30 min后,再予以PSG-1作用,与PSG-1单独刺激相比,细胞的吞噬能力显著或极显著下降,且10.0 mg/mL甘露聚糖处理组对PSG-1诱导的细胞吞噬能力抑制作用最强。
2.4 MR抑制剂对PSG-1诱导小鼠腹腔巨噬细胞分泌TNF-α、IL-1β的影响
由表2可知,正常腹腔巨噬细胞培养上清液中TNF-α和IL-1β的含量极低,PSG-1刺激后上清液中TNF-α和IL-1β的含量极显著增加,远高于空白对照组;提前30 min给予甘露聚糖2.5、5.0、10.0 mg/mL预处理细胞后再加入PSG-1,与PSG-1单独刺激相比,IL-1β的含量显著或极显著降低,TNF-α的含量稍有降低,但与PSG-1单独刺激相比无显著差异。
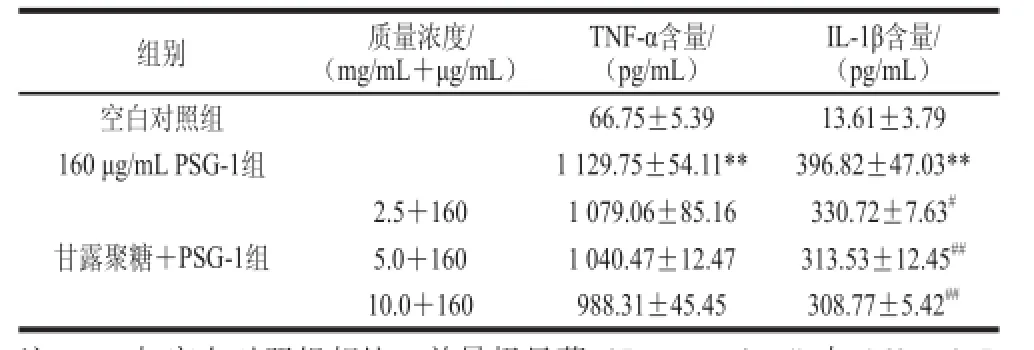
表2 甘露聚糖对PSG-1诱导小鼠腹腔巨噬细胞分泌TNF--α、IL--1β的影响Table2 Effect of PSG-1 on the secretion of TNF- and IL-1 in mouse peritoneal macrophages via MR
2.5 MR抑制剂对PSG-1诱导小鼠腹腔巨噬细胞TNF-α、IL-1β mRNA的表达水平的影响

图4 甘露聚糖对PSG-1诱导小鼠腹腔巨噬细胞TNF--α、IL--1β mRNA表达水平的影响Fig.4 Effect of PSG-1 on the mRNA expression levels of TNF-α and IL-1β in mouse peritone al macrophages via MR
如图4所示,空白对照组小鼠腹腔巨噬细胞TNF-α、IL-1β mRNA的水平较低,给予PSG-1刺激后,TNF-α、IL-1β mRNA的水平显著增加;预先加入甘露聚糖2.5、5、10 mg/mL处理细胞,再加入PSG-1刺激,IL-1β mRNA的表达被抑制,且抑制作用与甘露聚糖的质量浓度呈剂量依赖性,TNF-α mRNA的表达略有降低,但与PSG-1单独刺激相比无显著性差异。
3 讨 论
近年来的研究表明多糖的免疫调节作用主要是通过细胞表面相关受体介导的,这些受体称为模式识别受体[8](pattern recognition receptor,PRR)。PRR是多糖发挥免疫调节作用的枢纽,识别多糖后,与之结合引发一系列的信号级联反应,从而诱导免疫基因的表达,激活免疫反应,发挥免疫调节作用[9]。因此对PRR的研究极大地促进了对多糖免疫调节作用机制的研究。目前发现的PRR主要包括Toll样受体[10](Toll-like receptors,TLRs)、树突状细胞相关C型凝集素-1[11](dendritic cell-associated C-type lectin-1,Dectin-1)、MR[12]、补体受体3[13](complement receptor,CR3)、清道夫受体[14](scavenger receptor,SR)等。多糖与这些受体结合后可以激活细胞内的信号通路,进而活化免疫细胞,促进细胞因子的释放调节免疫反应[8]。MR是PRR中的一种,可特异性地识别以甘露糖、岩藻糖或N-乙酰葡糖胺为末端的配体并与之结合,研究表明MR在病原体的识别、吞噬与清除[15]、感染[16]等许多过程中都发挥着重要的作用。
Yu Qiang等[17]研究表明PSG-1可能是通过活化NF-κB途径激活巨噬细胞从而发挥免疫调节作用,随后,Zhang Shenshen等[18]证明PSG-1能通过TLR4依赖的信号转导通路提高机体免疫力,抑制肿瘤生长,其中TLR4是具有代表性的一种PRR。最新研究表明,PSG-1可以通过TLR4/ROS/PI3K/Akt/MAPKs/NF-κB信号通路发挥其对巨噬细胞的活化作用[19]。然而,PSG-1能否通过影响巨噬细胞MR的表达从而增强巨噬细胞的吞噬功能,以及通过MR诱导细胞因子TNF-α、IL-1β的分泌,目前尚未见报道,本实验对此进行了研究。
在腹腔巨噬细胞表面有大量MR的表达,表明其在早期的免疫应答反应中发挥重要作用。MR已被证明参与病原体的吞噬作用,如甲型流感病毒[20]。芦荟多糖[12]可经MR激活巨噬细胞,上调巨噬细胞表面MHC-Ⅱ(主要组织相容性抗原Ⅱ类分子)和FcγR (IgGFc段受体)的表达,MHC-Ⅱ可以提高巨噬细胞的抗原呈递能力,FcγR则能增强巨噬细胞清除抗原抗体复合物或者抗体肿瘤细胞复合物的能力。Liu Li等[21]研究表明大黄多糖可明显地升高结肠炎大鼠腹腔巨噬细胞MR的活性和吞噬能力。本实验结果表明,经PSG-1处理后小鼠腹腔巨噬细胞表面MR的表达量呈剂量依赖性的升高, RT-PCR进一步测定结果表明PSG-1处理后MR mRNA表达水平随着PSG-1质量浓度的增加而升高。由此推断,PSG-1可以通过上调小鼠腹腔巨噬细胞MR mRNA表达水平从而促进细胞表面MR的表达。MR与多糖配体结合后,可增强巨噬细胞的吞噬活性,产生活性氧,激活转录因子NF-κB,并诱导细胞因子的分泌[22]。PSG-1可激活巨噬细胞的吞噬作用[17],流式细胞仪检测各处理组细胞吞噬FITC-dextran的能力,结果表明PSG-1促进的巨噬细胞吞噬功能被MR的竞争性抑制剂甘露聚糖剂量依赖性地减弱。由此可知,PSG-1可以通过上调MR的表达从而增强巨噬细胞的吞噬功能,抑制MR后,PSG-1对吞噬功能的促进作用减弱。壳寡糖可通过与巨噬细胞表面的MR结合,产生IL-1β和TNF-α[23]。郭振军等[24]研究表明含有近50%甘露糖的大黄多糖和含有N-乙酰葡萄糖胺残基的当归多糖通过MR介导大鼠腹腔巨噬细胞TNF-α的分泌,而对IL-4的表达无影响。TNF-α主要由活化的单核-巨噬细胞产生,具有极为广泛的生物学活性。例如调节巨噬细胞活性、免疫应答、调节造血、抗肿瘤、介导炎症反应等。已有研究证明在RAW264.7巨噬细胞中,PSG-1能通过PI3K/Akt/MAPK/NF-κB信号转导途径诱导TNF-α的分泌[25]。本实验检测PSG-1单独刺激的细胞与甘露聚糖预处理30 min后再加PSG-1刺激的细胞培养上清液中TNF-α的含量,结果显示,甘露聚糖抑制MR后,对PSG-1诱导的TNF-α分泌无影响,且TNF-α mRNA的相对表达水平也无明显差异,因此可以说明MR在PSG-1诱导的TNF-α分泌过程中无明显作用。PSG-1诱导升高的另一细胞因子IL-1β的分泌量和mRNA表达水平则被甘露聚糖剂量依赖性地抑制,说明PSG-1对IL-1β的调节与MR有关。
综上所述,相关研究表明组分中含有甘露糖的多糖可通过MR激活巨噬细胞从而调节免疫反应,考虑到PSG-1中含有部分甘露糖,本实验通过体外培养小鼠腹腔巨噬细胞用于探讨PSG-1对MR的影响,以及PSG-1是否能通过影响巨噬细胞MR的表达从而调节巨噬细胞的免疫功能,可为完善黑灵芝多糖免疫调节的分子机制提供理论依据。结果显示,PSG-1可以上调巨噬细胞MR的表达,从而增强巨噬细胞的吞噬功能和相关细胞因子IL-1β的分泌,抑制剂抑制MR后,细胞吞噬功能减弱,IL-1β的分泌量减少。由此推测,PSG-1的免疫调节作用可能至少部分由MR介导。
[1] 黄璞. 黑灵芝孢子粉的化学组成及其破壁新工艺研究[D]. 南昌: 南昌大学, 2007: 1-2.
[2] 鄢嫣, 张汇, 聂少平, 等. 黑灵芝子实体水溶性多糖的理化性质及抗氧化活性的研究[J]. 食品科学, 2009, 30(19): 55-60.
[3] LEUNG M Y K, LIU C, KOON J C M, et al. Polysaccharide biological response modif ers[J]. Immunology Letters, 2006, 105(2): 101-114.
[4] 余国庆, 陈晓明. 多糖免疫受体研究进展[J]. 温州医学院学报, 2012, 42(4): 396-401.
[5] GAZI U, MARTINEZ P L. Inf uence of the mannose receptor in host immune responses[J]. Immunobiology, 2009, 214(7): 554-561.
[6] CHEN Yi, XIE Mingyong, NIE Shaoping, et al. Purification, composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J]. Food Chemistry, 2008, 107(1): 231-241.
[7] 张莘莘, 李文娟, 聂少平, 等. 黑灵芝多糖对体外培养的小鼠腹腔巨噬细胞功能的影响[J]. 中国药理学通报, 2010, 26(9): 1139-1142.
[8] 宫存杞, 张君, 谢建新. 多糖免疫调节作用的受体研究进展[J]. 西部医学, 2007, 19(2): 290-292.
[9] 谢燕霞, 安利国, 杨桂文. 植物多糖对巨噬细胞的免疫调节作用[J].中国生物化学与分子生物学报, 2008, 24(4): 307-314.
[10] ANDO I, TSUKUMO Y, WAKABAYASHI T, et al. Safflower polysaccharides activate the transcription factor NF-κB via Tolllike receptor 4 and induce cytokine production by macrophages[J]. International Immunopharmacology, 2002, 2(8): 1155-1162.
[11] GUO Liang, XIE Jianhui, RUAN Yuanyuan, et al. Characterization and immunostimulatory activity of a polysaccharide from the spores of Ganoderma lucidum[J]. International Immunopharmacology, 2009, 9(10): 1175-1182.
[12] LIU C, LEUNG M Y K, Koon J C M, et al. Macrophage activation by polysaccharide biological response modif er isolated from Aloe vera L. var. chinensis (Haw.) Berg[J]. International Immunopharmacology, 2006, 6(11): 1634-1641.
[13] LEE K Y, YOU H J, JEONG H G, et al. Polysaccharide isolated from Poria cocos sclerotium induces NF-κB/Rel activation and iNOS expression through the activation of p38 kinase in murine macrophages[J]. International Immunopharmacology, 2004, 4(8): 1029-1038.
[14] YANG J W, YOON S Y, OH S J, et al. Bifunctional effects of fucoidan on the expression of inducible nitric oxide synthase[J]. Biochemical and Biophysical Research Communications, 2006, 346(1): 345-350.
[15] RAMIREZ-GARCIA A, ARTETA B, ABAD-DIAZ-de-CERIO A, et al. Candida albicans increases tumor cell adhesion to endothelial cells in vitro: intraspecif c differences and importance of the mannose receptor[J]. PLoS One, 2013, 8(1): e53584. doi: 10.1371/journal. pone.0053584.
[16] LIU Zhihua, MA Yanlei, MOYER M P, et al. Involvement of the mannose receptor and p38 mitogen-activated protein kinase signaling pathway of the microdomain of the integral membrane protein after enteropathogenic Escherichia coli infection[J]. Infection and Immunity, 2012, 80(4): 1343-1350.
[17] YU Qiang, NIE Shaoping, LI Wenjuan, et al. Macrophage immunomodulatory activity of a purified polysaccharide isolated from Ganoderma atrum[J]. Phytotherapy Research, 2013, 27(2): 186-191.
[18] ZHANG Shenshen, NIE Shaoping, HUANG Danfei, et al. Polysaccharide from Ganoderma atrum evokes antitumor activity via Toll-like receptor 4-mediated NF-κB and mitogen-activated protein kinase signaling pathways[J]. Journal of Agricultural and Food Chemistry, 2013, 61(15): 3676-3682.
[19] YU Qiang, NIE Shaoping, WANG Junqiao, et al. Toll-like receptor 4-mediated ROS signaling pathway involved in Ganoderma atrum polysaccharideinduced tumor necrosis factor-α secretion during macrophage activation[J]. Food and Chemical Toxicology, 2014, 66: 14-22.
[20] UPHAM J P, PICKETT D, IRIMURA T, et al. Macrophage receptors for inf uenza A virus: role of the macrophage galactose-type lectin and mannose receptor in viral entry[J]. Journal of Virology, 2010, 84(8): 3730-3737.
[21] LIU Li, GUO Zhenjun, LV Zhengguang, et al. The beneficial effect of Rheum tanguticum polysaccharide on protecting against diarrhea, colonic inf ammation and ulceration in rats with TNBS-induced colitis: the role of macrophage mannose receptor in inflammation and immune response[J]. International Immunopharmacology, 2008, 8(11): 1481-1492.
[22] SCHEPETKIN I A, QUINN M T. Botanical polysaccharides: macrophage immunomodulation and therapeutic potential[J]. International Immunopharmacology, 2006, 6(3): 317-333.
[23] HAN Yanping, ZHAO Luhang, YU Zhijun, et al. Role of mannose receptor in oligochitosan-mediated stimulation of macrophage function[J]. International Immunopharmacology, 2005, 5(10): 1533-1542.
[24] 郭振军, 刘莉, 张维璐, 等. 大黄、当归多糖对巨噬细胞甘露糖受体作用的研究[J]. 细胞与分子免疫学杂志, 2008, 24(5): 514-516.
[25] YU Qiang, NIE Shaoping, WANG Junqiao, et al. Polysaccharide from Ganoderma atrum induces tumor necrosis factor-α secretion via phosphoinositide 3-kinase/Akt, mitogen-activated protein kinase and nuclear factor-κB signaling pathways in RAW264.7 cells[J]. International Immunopharmacology, 2012, 14(4): 362-368.
Effect of Polysaccharides from Ganoderma atrum on Mannose Receptor of Mouse Peritoneal Macrophages
SHUAI Xiao-xue, LI Wen-juan, LIU Dan-feng, WANG Yu-ting, ZHU Ke-xue, XIE Ming-yong*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Objective: To explore the effect of polysaccharides from Ganoderma atrum (PSG-1) on the mannose receptor (MR) of mouse peritoneal macrophages. Methods: After the macrophages were treated with PSG-1 at various concentrations, the MR expression on the macrophage surface was analyzed by f ow cytometry, and then the mRNA expression level of MR was evaluated by reverse transcription polymerase chain reaction (RT-PCR). After the cells were pretreated with mannan (an MR inhibitor) and then exposed to PSG-1, the phagocytosis of macrophages was assayed by f ow cytometric method, the contents of tumor necrosis factor-α (TNF-α) and interleukin-1β (IL-1β) in cell culture supernatant were measured by enzyme-linked immunosorbent assay (ELISA), and the mRNA expression levels of TNF-α and IL-1β were determined by RT-PCR. Results: PSG-1 could increase the protein and mRNA expression levels of MR. Compared with the group treated with PSG-1 alone, the phagocytosis of macrophages and the secretion of IL-1β in cells pretreated with mannan were signif cantly inhibited and no effect on the secretion of TNF-α was observed in the presence of PSG-1. Conclusion: MR can partly mediate the immunoregulatory effect of PSG-1 on peritoneal macrophages in mice. Therefore, MR may be one of the receptors of PSG-1 associated with the immunomodulatory function.
polysaccharides from Ganoderma atrum; peritoneal macrophages; mannose receptor (MR); phagocytosis; cytokine
TS201.4
A
1002-6630(2014)23-0262-06
10.7506/spkx1002-6630-201423051
2014-06-27
国家自然科学基金重点项目(31130041);国家自然科学基金青年科学基金项目(31201326)
帅小雪(1989—),女,硕士研究生,研究方向为营养代谢与分子营养学。E-mail:shuaisnow@163.com
*通信作者:谢明勇(1957—),男,教授,博士,研究方向为食品营养学、食品安全、功能保健食品。E-mail:myxie@ncu.edu.cn

