海南黎族肺腺癌患者胸苷酸合酶mRNA表达水平对培美曲塞化疗预后的影响
高炳玉,刘 玉,夏立平,郑武平,苏洁之,陈峙霖
TYMS(thymidylate synthase)基因定位于第18号染色体上(18p11.32),其编码的胸苷酸合酶(TS)是嘧啶核苷酸合成的限速酶,是肿瘤生长的重要因子[1]。TS作为催化胸苷酸合成的关键酶,在细胞的生长和DNA复制过程中具有关键作用,是抗肿瘤的重要靶点之一。部分临床研究表明,在胃癌、原发性直肠癌等癌症中,TS表达水平与患者的化疗预后呈负相关,因此TS表达情况有望成为评估肿瘤预后的一个重要指标。然而目前本文创新点——培美曲塞可作为治疗局部或转移性非小细胞肺癌(NSCLC)的二线治疗药物,以往部分研究表明胸苷酸合酶(TS)mRNA表达水平与培美曲塞疗效有一定相关性,但对培美曲塞单药疗效与TS mRNA表达水平相关性研究较少。本研究观察了培美曲塞单药治疗海南黎族晚期肺腺癌的疗效及其与TS mRNA表达水平的相关性,并比较了患者癌组织与癌旁组织的TS mRNA表达水平差异。
对肺腺癌癌组织和癌旁组织中TS表达差异以及与药物敏感性和生存预后的相关性研究较少,尤其是对于黎族人群的研究更是空白。本研究通过观察海南黎族肺腺癌患者癌组织和癌旁组织中TS mRNA表达水平及探讨其与培美曲塞化疗后预后的相关性,以期为黎族肺腺癌患者的化疗及预后评估提供参考。
1 资料与方法
1.1 一般资料 选取2008年6月—2009年4月在我院手术治疗的病理诊断为晚期肺腺癌患者52例,TNM分期T4期,其中男42例,女10例;年龄为44~80岁,中位年龄为62岁。患者术后均进行化疗,化疗前血常规、肝肾功能均正常,心电图无明显异常。患者对化疗方案知情同意,给予培美曲塞二钠单药的化疗方案:注射用培美曲塞二钠500 mg/m2,静脉滴注,第1天;同时口服地塞米松、叶酸和肌肉注射维生素B12,21 d为1个治疗周期,4个治疗周期为药物研究治疗周期。
1.2 方法 选取患者手术切除的癌组织和癌旁组织,置于液氮中保存备用。采用反转录聚合酶链反应(RT-PCR)和相对定量的方法检测癌组织和癌旁组织中TS mRNA表达水平。然后随访观察患者的疗效及安全性,随访时间截至2012-03-30。
1.2.1 TS mRNA表达水平检测
1.2.1.1 总RNA提取 采用miRNeasy Mini Kit(QIAGEN)分别提取癌组织和癌旁组织总RNA,采用NanoDrop 2000微量紫外分光光度计(Thermo Scientific公司)检测RNA提取质量和浓度。
1.2.1.2 反转录合成cDNA 采用cDNA Synthesis Kit(TAKARA公司)将总RNA反转录成cDNA,反转录体系为:反转录缓冲液 4 μl,dNTP 混合物1 μl,RNA酶抑制剂1 μl,随机引物2 μl,M-MLV反转录酶 1 μl,提取总RNA 2 μg,无RNA酶水补足体积至20 μl。反应条件为:95 ℃ 5 min,42 ℃ 60 min,72 ℃ 5 min。cDNA模板保存于-20 ℃。
1.2.1.3 引物设计和扩增效率检测 GAPDH上游引物:5′-CTTGTCATCAATGGAAATCC-3′,下游引物:5′-GCAGAGATGATGACCCTTTTG-3′,扩增产物长度170 bp;TS上游引物:5′-AAATTCAGCTTCAGCGAGAAC-3′,下游引物:5′-GACTGACAATATCCTTCGAGCTC-3′,扩增产物长度182 bp。引物由上海英俊生物技术有限公司合成,经琼脂糖凝胶电泳检测PCR产物特异性。采用染料法(SYBR Green)分别扩增TS和内参基因GAPDH,进行相对定量(ΔΔCt法)。取反转录好的模板cDNA,分别进行2、4、8、16倍稀释,制作标准曲线。定量PCR体系为:SYBR定量试剂10 μl,上游引物(10 μmol/L) 0.4 μl,下游引物(10 μmol/L)0.4 μl,DNA模板1.5 μl,灭菌蒸馏水补足至20 μl。反应条件为:98 ℃预变性5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,收集荧光,40个循环。
1.2.2 预后情况分析 从患者手术日截至2012-03-30,记录患者无复发生存期(RFS)和总生存期(OS)。RFS为患者根治性手术到复发或末次随访的时间;OS为患者根治性手术到死亡或末次随访的时间。
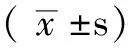
2 结果
2.1 扩增效率标准曲线 将cDNA模板进行倍数稀释后,制作标准曲线(见图1、图2)。TS与GAPDH基因标准曲线的斜率(M值)分别为-3.552和-3.502,两者的差值<0.1,表明两个基因的扩增效率非常接近,故本体系可用于TS mRNA表达水平相对定量检测。

图1 TS基因扩增效率标准曲线

图2 GAPDH基因扩增效率标准曲线
2.2 TS mRNA表达水平检测结果 52例肺腺癌患者组织标本中,35例(67.3%)癌组织TS mRNA表达水平低于其癌旁组织,17例(32.7%)癌组织TS mRNA表达水平高于其癌旁组织。癌组织与癌旁组织中TS mRNA表达水平〔cut-off值分别为(4.46±1.89)和(5.77±1.29)〕间差异有统计学意义(t=0.53,P<0.05)。
52例肺腺癌患者癌组织中TS mRNA表达水平相差67倍,以cut-off均值为界,TS mRNA高表达患者29例(55.8%),低表达患者23例(44.2%)。癌旁组织中TS基因mRNA表达水平相差54倍,以cut-off均值为界,TS基因mRNA高表达患者32例(61.5%),低表达患者20例(38.5%)。
2.3 TS mRNA表达水平与预后的关系 随访结束时,52例肺腺癌患者中位RFS为14.67个月,中位OS为19.14个月。癌组织TS mRNA高表达组中位RFS为11.50个月,中位OS为18.21个月;低表达组中位RFS为18.00个月,中位OS为23.72个月。
癌组织TS mRNA低表达组患者的无复发生存率和总生存率分别为61.0%和56.5%,与癌组织TS mRNA高表达组的39.0%和43.5%比较,差异有统计学意义(χ2分别为7.63和4.35;P<0.05,见图3、图4)。

图3 TS mRNA低表达者与高表达者无复发生存曲线
Figure3 The relapse-free survival curves of patients with low TS mRNA expression and patients with high TS mRNA expression

图4 TS mRNA低表达者与高表达者总生存曲线
Figure4 The survival curves of patients with low TS mRNA expression and patients with high TS mRNA expression
3 讨论
人类TS是由两个相同亚单位组成的二聚体蛋白,其基因定位于第18号染色体上(18p11.32)。其是DNA生物合成的关键酶,TS的表达与肿瘤的恶性生物学行为密切相关[2]。培美曲塞是临床常用的治疗肺癌的药物之一,用于二线治疗的前期临床研究显示具有较好的缓解率和生存优势,特别是在非鳞状非小细胞肺癌(NSCLC)的分析中体现了培美曲塞的治疗优势[3]。
以往研究显示,TS mRNA或蛋白的表达水平与肿瘤患者化疗药物的敏感性及生存预后呈负相关[4-9],但是对癌组织和癌旁组织TS表达差异以及与药物敏感性和生存预后的种族差异性研究较少。在最近的一项研究中,Yamane等[4]通过对55例结直肠癌患者的TS mRNA表达水平研究发现,低TS表达水平的患者,其中位生存时间大于高TS表达患者(3.77年与2.39年),提示TS mRNA表达水平可以作为患者的一个预后因子。Nakagawa等[5]通过RT-PCR和免疫组化的方法检测了46例结直肠癌患者中TS mRNA表达水平和蛋白表达水平,结果发现TS蛋白表达水平与mRNA表达水平具有一定的相关性,但是患者OS与TS mRNA表达水平无相关性,而TS蛋白表达阴性的患者OS明显高于阳性表达患者,提示TS蛋白表达水平可以作为患者的一个预后判定因子。
患者个体和种族的差异常会影响其对肿瘤的易患性以及癌症患者对化疗药物的敏感性甚至预后,以往研究中未见种族的差异是否会影响TS mRNA表达水平作为预后的指导价值。本研究选择海南黎族肺腺癌患者作为研究对象,探讨了TS mRNA表达水平作为判定海南黎族肺腺癌患者药物敏感性和预后指标的临床价值。初步的研究结果显示,癌组织TS mRNA低表达组患者的无复发生存率和总生存率均高于高表达组,提示TS mRNA低表达的患者更能从培美曲塞为主的辅助化疗方案中受益,可用于其预后预测。因此,早期检测患者癌组织内的TS mRNA表达水平,可能有助于个体化选择化疗药物。但是由于本研究病例数较少、随访时间较短,因此要全面理解TS mRNA表达水平对患者接受培美曲塞药物辅助化疗肺腺癌患者预后的影响,仍需进一步扩大样本量,延长随访时间,同时设立未化疗或其他方案化疗的对照组。
1 Ofi T,Takahashi E,Ayuzawa D,et al.Regional assignment of the human thymidylate synthasc(TS) gene to chromosome band 18pl1.32 by nonisetopic in situ by hybridization[J].Hum Genet,1990,85(6):576-580.
2 Ancey J,Shepherd RA,Gralla RJ,et al.Quality of life assessment of second-line docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum.Based chemotherapy:restllts of a prospective,randomized phase III trial[J].Lung Cancer,2004,43:183-194.
3 Tassinari D1,Carloni F,Santelmo C,et al.Second line treatments in advanced platinum-resistant non small cell lung cancer.A critical review of literature[J].Rev Recent Clin Trials,2009,4(1):27-33.
4 Yamane T,Seshimo A,Kameoka S.Analysis of the mRNA expression levels of thymidylate synthase(TS),dihydropyrimidine dehydrogenase(DPD) and orotate phosphoribosyl transferase(OPRT) in liver metastases from colorectal cancer[J].Hepato Gastroen Terology,2013,60(122):291-295.
5 Nakagawa T,Shimada M,Kurita N,et al.Thymidylate synthase(TS) protein expression as a prognostic factor in advanced colorectal cancer:a comparison with TS mRNA expression[J].Hepatogastroenterology,2012,59(116):1059-1062.
6 Fossella FV,DeVore R,Kerr RN,et al.Randomized phase Ⅲ trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small cell lung cancer previously treated with platinum-containing chemotherapy regimens.The TAX 320 Non-Small Cell Lung Cancer Study Group[J].J Clin Oncol,2000,18(12):2354-2362.
7 Schuette W,Nagel S,Blankenburg T,et al.Phase-study of second-line chemotherapy for advanced non-mallcell lung cancer with weekly compared with 3-weekly docetaxel[J].J Clin Oncol,2005,23(33):8389-8395.
8 Caponi S,Vasile E,Ginocchi L,et al.Second-Line Treatments for non-small lung cancer:One Size Does Not Fit All[J].Clinical Lung Cance,2010,11(5):320-327.
9 Smit E,Mattson K,von Pawel J,et al.ALIMTA(pemetrexed disodium)as second-line treatment of non-small cell lung cancer:a phase Ⅱ study[J].Ann Oncol,2003,14(3):455-460.

