汉族和维吾尔族结直肠癌患者K-ras基因突变情况及影响因素分析
刘 超,郑 超,才 层,穆振诺,阿丽亚·阿不都卡德尔,玛依努尔·艾力
结直肠癌是目前临床常见的恶性肿瘤,在全球范围内每年新发病例数超过120万,死亡人数超过60万。据美国国立癌症研究所统计,2012年美国新发结直肠癌患者为143 460人,死亡51 690人,居恶性肿瘤发病率和死亡率的第3位[1]。在我国结直肠癌的发病率和死亡率呈逐年增高的趋势,且晚期结直肠癌发病率较高。近年来,结直肠癌发病率迅速上升,已成为我国最常见的5大恶性肿瘤之一,5年生存率为60%左右,其治疗效果30年来无显著改善[2]。结直肠癌中K-ras基因的突变比ras家族中其他基因的突变更常见。结直肠癌也是目前研究K-ras基因突变最多、临床检测应用最多的肿瘤之一。K-ras基因突变的频率在结直肠癌中为14%~50%[1-3]。K-ras基因的激活在结直肠癌的发生发展中起重要作用,对于进行结直肠癌的分子靶向治疗具有重要的参考价值。在一些研究中,这种改变还被作为结直肠癌患者预后不良的1个指标[3-4]。
新疆维吾尔族与其他地区相比,除了社会文化、生活习惯存在差异外,与其他民族种族方面也存在不同的遗传背景。K-ras基因在世界各地不同种族结直肠癌中的突变有差异,在新疆维吾尔族结直肠癌中的突变情况以及与新疆维吾尔族结直肠癌发生发展相关的文献报道较少。研究表明:焦磷酸测序法检测结直肠癌K-ras基因外显子2第12和13密码子突变具有敏感、准确的优点,可用于临床个体化治疗中肿瘤基因突变检测[5]。本研究应用焦磷酸测序法对汉族和维吾尔族结直肠癌患者石蜡标本中K-ras基因外显子2第12、13密码子突变情况进行检测,并分析K-ras基因突变的临床病理学意义。
1 资料与方法
1.1 病例纳入和排除标准
1.1.1 纳入标准 (1)年龄18~80岁;(2)经肠镜病理诊断为结直肠癌的患者;(3)经术后病理确诊为结直肠癌的患者;(4)临床资料齐全的患者;(5)知情同意参加本研究者。
1.1.2 排除标准 (1)年龄<18或>80岁;(2)已经接受任何放疗、化疗、分子靶向药物抗肿瘤治疗的患者;(3)危重或伴有严重的高血压、糖尿病、心脑血管及呼吸系统等疾病的患者;(4)结直肠的转移性肿瘤患者;(5)拒绝参加本研究者。
1.2 临床资料 收集2010年1月—2013年3月新疆医科大学第一附属医院结直肠癌活检或手术切除病理标本91例为研究对象,其中汉族52例,维吾尔族39例;活检标本5例,手术标本86例,获取病理标本时,患者均未接受任何放化疗、分子靶向药物等治疗。收集相关临床及病理资料,两组患者性别、年龄、吸烟史、饮酒史、肿瘤部位、大体病理类型、分化程度、分期、浸润深度、淋巴结转移、远处转移情况比较,差异均无统计学意义(P>0.05,见表1)。
1.3 方法 应用焦磷酸测序法对汉族和维吾尔族结直肠癌患者石蜡切片标本中K-ras基因外显子2第12、13密码子突变情况进行检测。
1.3.1 收取石蜡包埋组织标本 每例标本切成5 μm厚的石蜡切片8张,并确保切片含有70%以上的肿瘤组织。样本均为室温保存、病理诊断明确含有肿瘤组织的石蜡切片,保存时间不超过3年。
1.3.2 石蜡切片组织基因组DNA提取 试剂盒购自基因科技(上海)有限公司。根据组织大小,选取适量切片,将切片放入二甲苯中浸泡1 min;再将切片放入95%乙醇溶液中浸泡1 min。将组织刮下,放入1.5 ml离心管中。根据组织量加入30~50 μl含0.01%十二烷基磺酸钠(SDS)裂解液和浓度为50 μg/ml的蛋白酶K(5 μl蛋白酶K/50 μl裂解液),振荡混匀,置56 ℃水浴中,反应1.5~2.0 h后100 ℃处理10 min,10 000×g离心10 min。取上清液作为PCR模板。
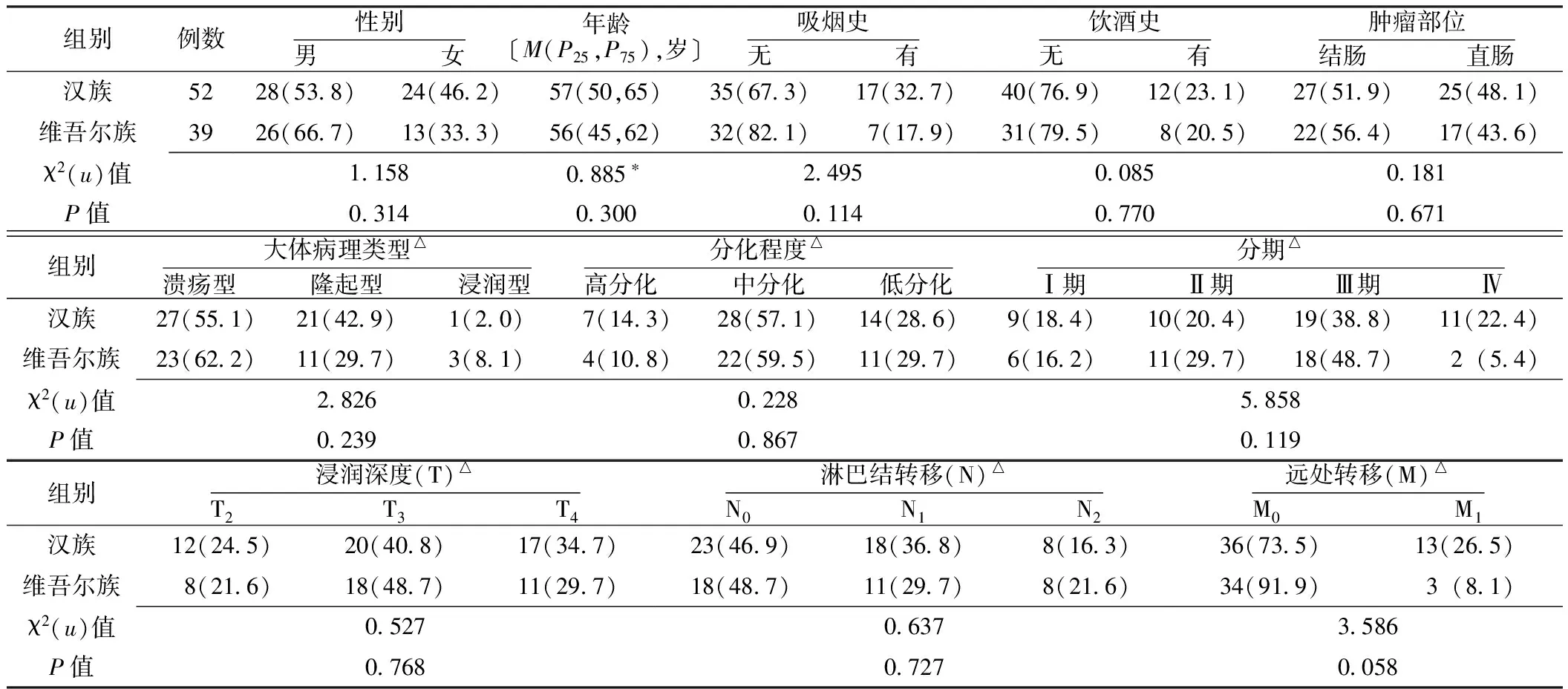
表1 汉族与维吾尔族结直肠癌患者的临床特征比较Table 1 Comparison of clinical characteristics of Han and Uyghur patients with colorectal cancer
注:*为u值;△缺失5例患者信息
1.3.3 引物设计 K-ras基因片段扩增所需引物由基因科技(上海)有限公司合成。上游引物:5′-biotin-TGACTGAATATAAACTTGTGGTAGTTG-3′(生物素标记5′端);下游引物:5′-TCGTCC-ACAAAATGATTCTGAA-3′,产物长度为91 bp;测序引物:5′-GCACTCTTGCCTACG-3′。
1.3.4 PCR扩增 按照PCR扩增试剂盒〔购自基因科技(上海)有限公司〕实验步骤进行PCR扩增,其中PCR反应条件设置如下:37 ℃保温5 min;95 ℃预变性3 min;95 ℃变性10 s,56 ℃退火20 s,72 ℃延伸30 s,共50个循环:最后72 ℃延伸5 min。PCR反应结束后,选择性地对PCR产物进行Agarose电泳分析,以验证PCR扩增效率。
1.3.5 焦磷酸测序法 (1)采用PyroMark ID型Pyrosequencing焦磷酸测序仪(瑞典Biotage AB公司生产)配套的单链纯化装置从PCR反应液中分离单链DNA。(2)将测序反应板放置于测序仪中进行测序。(3)数据分析:采用焦磷酸测序仪配套的分析软件进行,首先进行SNP分析,对于存在杂合子的位点,需进一步进行基因频率分析(见图1~5)。
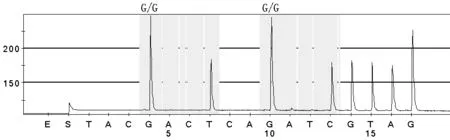
注:2个检测位点的结果均显示为G/G,表明K-ras基因为野生型,若结果均显示为G/A、G/C、G/T,表明K-ras基因发生突变
图1 K-ras野生型标准检测图谱
Figure1 K-ras gene wild-type standard test patterns

图2 检测样本中的K-ras基因野生型报告
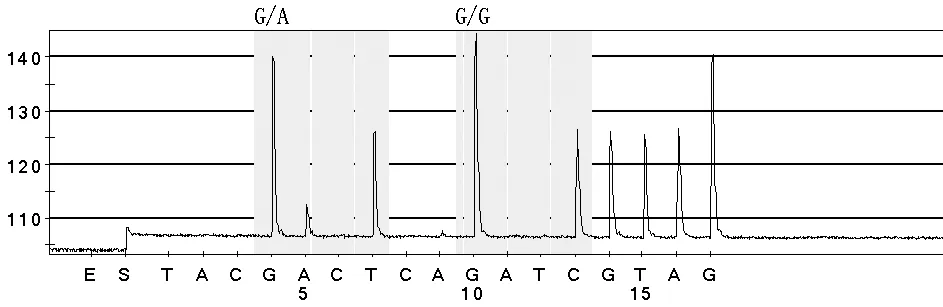
图3 检测样本中的K-ras基因突变型报告(12密码子GAT突变)
Figure3 K-ras gene mutation report of the samples(codon 12 GAT mutation)
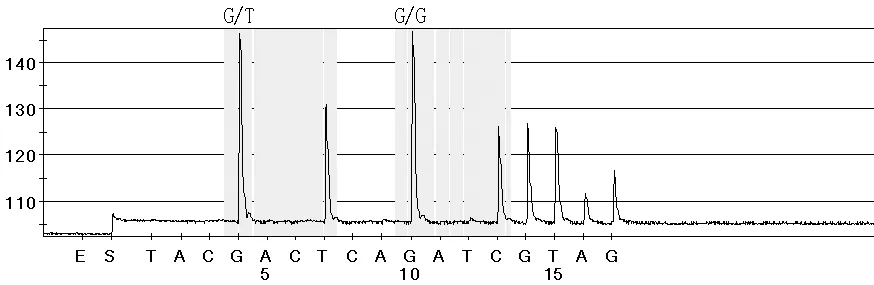
图4 检测样本中的K-ras基因突变型报告(12密码子GTT突变)
Figure4 K-ras gene mutation report of the samples(codon 12 GTT mutation)
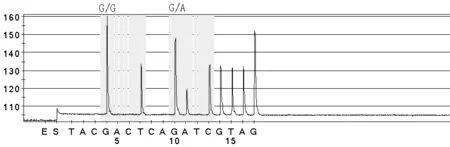
图5 检测样本中的K-ras基因突变型报告(13密码子GAC突变)
Figure5 K-ras gene mutation report of the samples(codon 13 GAC mutation)
1.4 统计学方法 应用SPSS 19.0统计软件进行统计处理,年龄不符合正态性分布采用中位数(上四分位数,下四分位数)表示,组间比较采用秩和检验;计数资料采用χ2检验;结直肠癌患者K-ras基因突变影响因素采用多因素Logistic回归分析法。检验水准α=0.05。
2 结果
2.1 两组结直肠癌患者K-ras基因突变情况比较 K-ras基因在33例(36.3%)结直肠癌患者中为突变型,单纯12密码子突变24例(占72.7%),单纯13密码子突变9例(占27.3%),无12、13密码子均突变病例。维吾尔族12密码子突变率明显高于汉族,差异有统计学意义(P<0.05),但两组总突变率及13密码子突变率比较,差异均无统计学意义(P>0.05,见表2)。
2.2 结直肠癌患者K-ras基因突变影响因素分析 单因素分析结果显示,不同性别、年龄、吸烟史、饮酒史、肿瘤部位、大体病理类型、分化程度、分期、浸润深度、淋巴结转移及远处转移结直肠癌患者K-ras基因总突变率比较,差异均无统计学意义(P>0.05,见表3)。
以结直肠癌患者K-ras基因突变为因变量,以性别、年龄、吸烟史、饮酒史、肿瘤部位、大体病理类型、分化程度、分期、浸润深度、淋巴结转移及远处转移为自变量(见表4),多因素Logistic回归法结果显示,性别、年龄、吸烟史、饮酒史、肿瘤部位、大体病理类型、分化程度、分期、浸润深度、淋巴结转移及远处转移与结直肠癌患者K-ras 基因突变无回归关系(P>0.05,见表5)。
表2 两民族结直肠癌患者K-ras基因突变情况比较〔n(%)〕
Table2 Comparison of K-ras gene mutation between Han and Uyghur patients with colorectal cancer
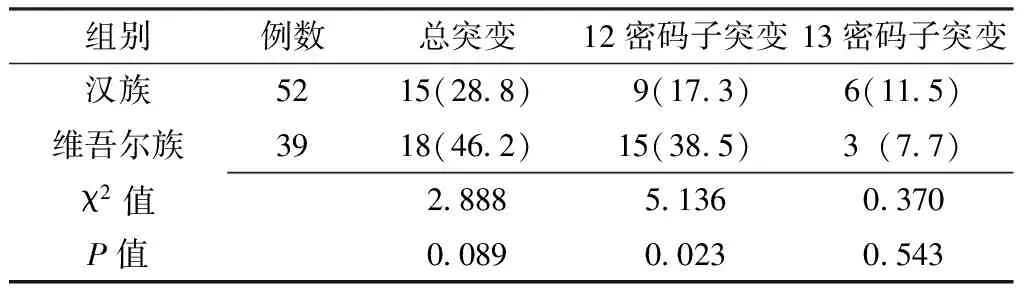
组别例数总突变12密码子突变13密码子突变汉族5215(28 8) 9(17 3) 6(11 5)维吾尔族3918(46 2)15(38 5)3(7 7)χ2值2 8885 1360 370P值0 0890 0230 543
表4 结直肠癌患者K-ras基因突变影响因素的赋值
Table4 Assignment of influencing factors for K-ras gene mutation in patients with colorectal cancer

变量 赋值性别男=0,女=1年龄(岁)原始数据吸烟不吸烟=0,吸烟=1饮酒不饮酒=0,饮酒=1肿瘤部位直肠=0,结肠=1大体病理类型溃疡型=1,隆起型=2,浸润型=3分化程度高分化=1,中分化=2,低分化=3分期Ⅰ期=1,Ⅱ期=2,Ⅲ期=3,Ⅳ期=4浸润深度(T)T2=1,T3=2,T4=3淋巴结转移(N)N0=1,N1=2,N2=3远处转移(M)M0=0,M1=1
3 讨论
目前,结直肠癌的发生发展机制仍未完全清楚,结直肠癌的发生是一个多基因、多步骤改变的复杂过程,涉及癌基因、抑癌基因和错配修复基因以及一些修饰基因。与结直肠癌有关的癌基因主要为ras基因和c-myc基因,其中K-ras基因突变与结直肠癌发生发展关系密切,且与抗表皮生长因子受体表达及靶向药物治疗相关。K-ras是ras原癌基因家族(包括K-ras、N-ras、H-ras)重要成员之一,与肿瘤的生成、增殖、迁移、扩散以及血管生成均有关系,对人类结直肠癌影响最大,K-ras基因分为突变型和野生型,常见突变位点为K-ras基因外显子2第12、13密码子上,外显子3第61密码子。世界各地不同区域、不同种族结直肠癌的突变有差异,美国的试验报道K-ras基因的突变率为30%~50%[6],欧洲的K-ras基因突变率为45%~48%[7-9],泰国、印度、韩国、日本的K-ras基因突变率为23.0%~35.4%[10-14]。我国K-ras基因突变率(14.3%~33.57%)较欧美国家的检出率偏低,与东亚国家的相近[15-21]。
表3 结直肠癌患者K-ras基因突变影响因素的单因素分析
Table3 Univariate analysis on risk factors for K-ras gene mutation in patients with colorectal cancer
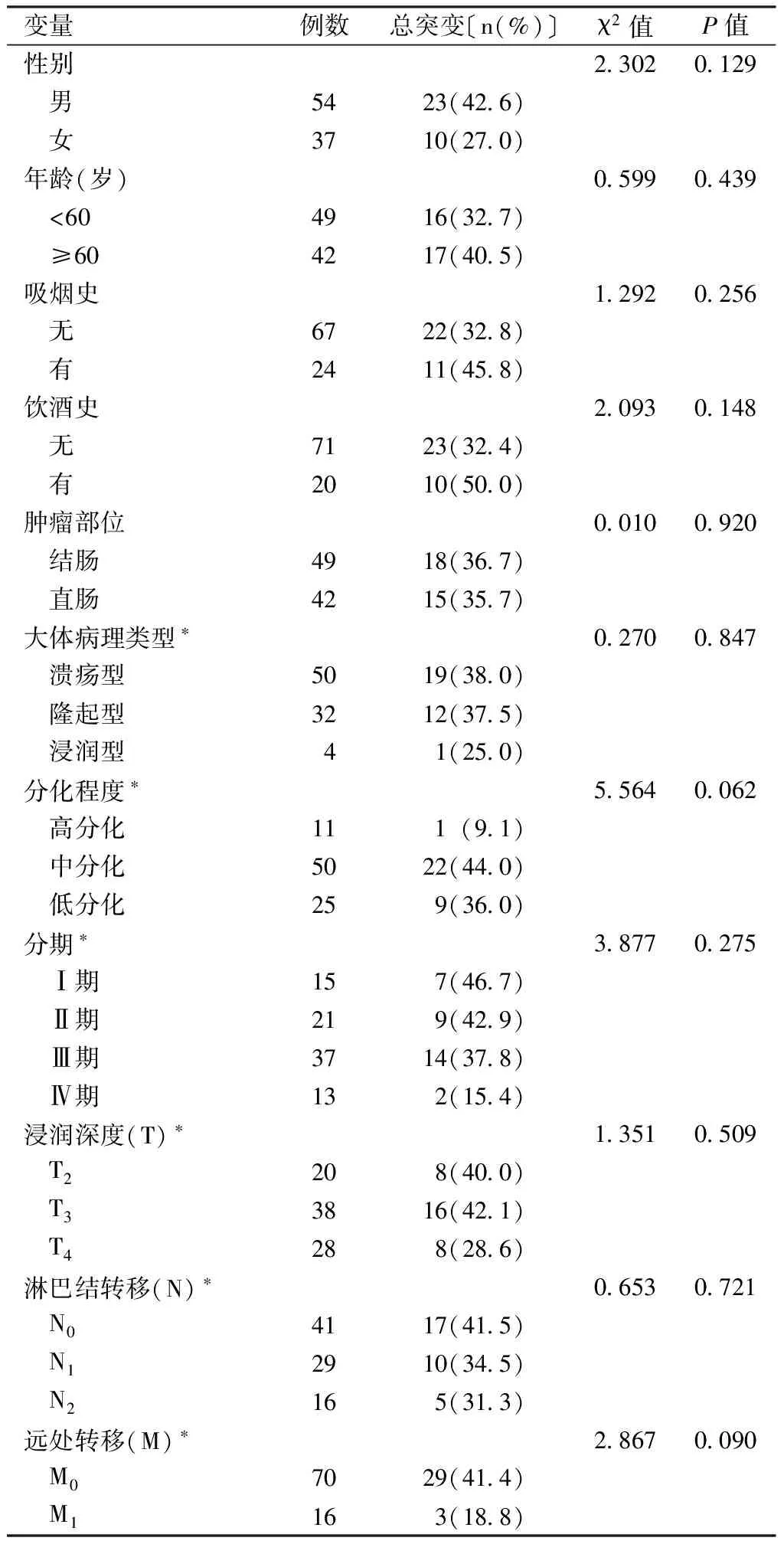
变量例数总突变〔n(%)〕χ2值P值性别2 3020 129 男5423(42 6) 女3710(27 0)年龄(岁)0 5990 439 <604916(32 7) ≥604217(40 5)吸烟史1 2920 256 无6722(32 8) 有2411(45 8)饮酒史2 0930 148 无7123(32 4) 有2010(50 0)肿瘤部位0 0100 920 结肠4918(36 7) 直肠4215(35 7)大体病理类型∗0 2700 847 溃疡型5019(38 0) 隆起型3212(37 5) 浸润型41(25 0)分化程度∗5 5640 062 高分化111(9 1) 中分化5022(44 0) 低分化259(36 0)分期∗3 8770 275 Ⅰ期157(46 7) Ⅱ期219(42 9) Ⅲ期3714(37 8) Ⅳ期132(15 4)浸润深度(T)∗1 3510 509 T2208(40 0) T33816(42 1) T4288(28 6)淋巴结转移(N)∗0 6530 721 N04117(41 5) N12910(34 5) N2165(31 3)远处转移(M)∗2 8670 090 M07029(41 4) M1163(18 8)
注:*缺失5例患者信息
本研究中K-ras基因总突变率为36.3%,单纯12密码子突变占72.7%,单纯13密码子突变占27.3%,与大部分研究结果相似[6,10,13-21]。两民族K-ras基因总突变率分别为维吾尔族46.2%、汉族28.8%,维吾尔族12密码子突变率(38.5%)高于汉族(17.3%),但两民族之间总突变率及13密码子突变率无差异,汉族K-ras基因突变率接近东亚国家,维吾尔族K-ras基因突变率接近欧洲国家,但付大鹏等[22]研究144例直肠癌患者中汉族与维吾尔族突变率分别为20.41%(20/98)和26.09%(12/46),本研究结果与付大鹏等研究维吾尔族基因突变率不同可能与样本来源及样本量有关。本研究中K-ras基因突变率与性别、年龄、吸烟史、饮酒史、肿瘤部位、大体病理类型、分化程度均无相关性,与国内外大部分报道相似[17],但刘伟等[16]研究中K-ras基因突变率在≥60岁的女性人群中较高,吴伟等[18]研究显示12、13密码子突变在原发部位、淋巴结转移上有差异。本研究中K-ras基因突变率与分期、浸润深度、淋巴结转移及远处转移无相关性,国内外大部分报道认为K-ras基因突变率与分期无关,吴文辉等[20]研究认为其与淋巴结转移、肝脏转移及TNM分期有相关性。
表5 结直肠癌患者K-ras基因突变影响因素的多因素Logistic回归分析
Table5 Multivariate Logistic regression analysis on risk factors for K-ras gene mutation in patients with colorectal cancer
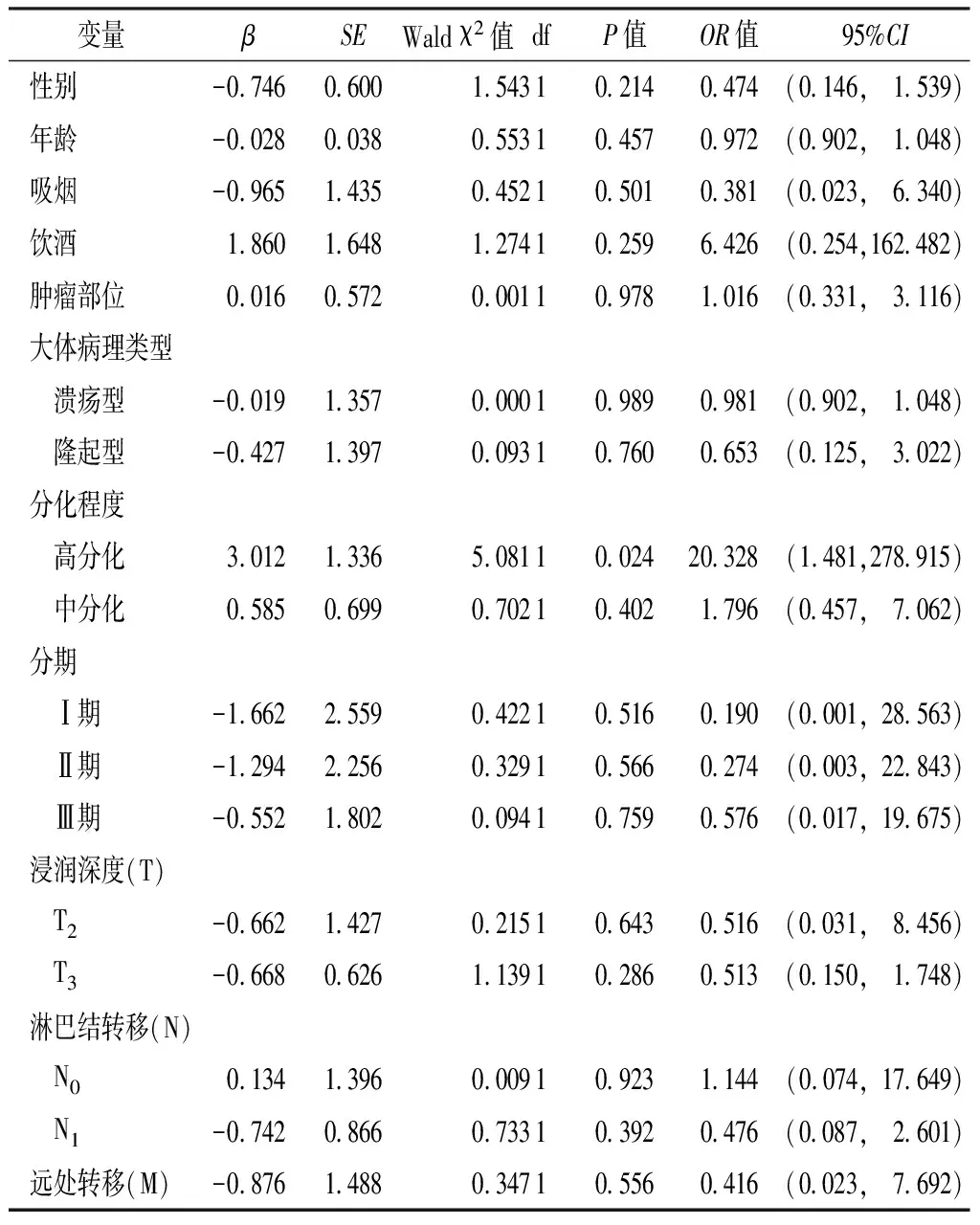
变量βSEWaldχ2值dfP值OR值95%CI性别-0 7460 6001 54310 2140 474(0 146, 1 539)年龄-0 0280 0380 55310 4570 972(0 902, 1 048)吸烟-0 9651 4350 45210 5010 381(0 023, 6 340)饮酒1 8601 6481 27410 2596 426(0 254,162 482)肿瘤部位0 0160 5720 00110 9781 016(0 331, 3 116)大体病理类型 溃疡型-0 0191 3570 00010 9890 981(0 902, 1 048) 隆起型-0 4271 3970 09310 7600 653(0 125, 3 022)分化程度 高分化3 0121 3365 08110 02420 328(1 481,278 915) 中分化0 5850 6990 70210 4021 796(0 457, 7 062)分期 Ⅰ期-1 6622 5590 42210 5160 190(0 001,28 563) Ⅱ期-1 2942 2560 32910 5660 274(0 003,22 843) Ⅲ期-0 5521 8020 09410 7590 576(0 017,19 675)浸润深度(T) T2-0 6621 4270 21510 6430 516(0 031, 8 456) T3-0 6680 6261 13910 2860 513(0 150, 1 748)淋巴结转移(N) N00 1341 3960 00910 9231 144(0 074,17 649) N1-0 7420 8660 73310 3920 476(0 087, 2 601)远处转移(M)-0 8761 4880 34710 5560 416(0 023, 7 692)
K-ras野生型是分子靶向治疗联合化疗疗效良好的预测指标,在靶向治疗前明确患者的K-ras基因状态有助于选择合适的患者,获得最佳疗效[23-25]。大量研究表明K-ras基因编码区的外显子2第12、13密码子的突变预示了对于靶向表皮生长因子受体(EGFR)的抗体治疗耐药[25-26]。因此美国国立综合癌症网络(NCCN)专家组在2013年最新指南强烈推荐所有结直肠癌患者在被诊断为Ⅳ期转移性时都应行肿瘤组织(原发肿瘤或转移病灶)的基因分析,早期确定K-ras基因状态可为后续治疗方案的选择做计划。
本研究中结直肠癌患者K-ras基因突变率维吾尔族为46.2%、汉族为28.8%,维吾尔族12密码子突变率高于汉族。K-ras突变率与性别、年龄、吸烟史、饮酒史、肿瘤部位、大体病理类型、分化程度、分期、浸润深度、淋巴结转移及远处转移无相关性。关于本研究K-ras基因突变与其他研究临床病理特征关系的报道不一,可能与检测方法、样本来源及样本量大小不同等原因有关,两民族突变率差别仍需大量的临床研究来进一步证实。
1 Hyodo I,Suzuki H,Takahashi K,et al.Present status and perspectives of colorectal cancer in Asia:Colorectal Cancer Working Group report in the 30th Asia-Pacific Cancer Conference[J].Jpn J Clin Oncol,2010,40(Suppl 1):38-43.
2 王琳,陈映霞,杨宁蓉,等.国人结直肠癌K-ras基因突变状态及其对抗EGFR单抗联合化疗的反应[J].肿瘤研究与临床,2010,22(7):458-460.
3 管莎莎,戴广海.K-ras基因突变对Ⅲ期大肠癌术后辅助化疗疗效的预测意义[J].军医进修学院学报,2012,33(3):211-214,218.
4 葛飞娇,刘建芝,李珊珊,等.K-ras基因型与转移性结直肠癌患者的疗效及预后的关系[J].中华肿瘤杂志,2013,35(4):273-276.
5 谢国化,姚晓虹,吴萍,等.焦磷酸测序法检测结直肠癌患者K-ras基因外显子2第12和13密码子点突变[J].中华检验医学杂志,2012,35(7):585-592.
6 Selcukbiricik F,Erdamar S,Ozkurt CU,et al.The role of K-RAS and B-RAF mutations as biomarkers in metastatic colorectal cancer[J].J BUON,2013,18(1):116-123.
7 Al-Allawi NA,Ismaeel AT,Ahmed NY,et al.The frequency and spectrum of K-ras mutations among Iraqi patients with sporadic colorectal carcinoma[J].Indian J Cancer,2012,49(1):163-168.
8 Segal G,Liebermann N,Klang S,et al.Identification of K-RAS mutations in colorectal cancer patients in Israel[J].Harefuah,2011,150(5):447-450,491.
9 周建红,李桂生,李高峰,等.伊立替康联合雷替曲塞在晚期结直肠癌二线化疗中的疗效及安全性研究[J].中国全科医学,2013,16(2):555-557.
10 Chaiyapan W,Duangpakdee P,Boonpipattanapong T,et al.Somatic mutations of K-ras and BRAF in Thai colorectal cancer and their prognostic value[J].Asian Pac J Cancer Prev,2013,14(1):329-332.
11 Malhotra P,Anwar M,Nanda N,et al.Alterations in K-ras,APC and p53-multiple genetic pathway in colorectal cancer among Indians[J].Tumour Biol,2013,34(3):1901-1911.
12 Lee WS,Baek JH,Lee JN,et al.Mutations in K-ras and epidermal growth factor receptor expression in Korean patients with stages Ⅲ and Ⅳ colorectal cancer[J].Int J Surg Pathol,2011,19(2):145-151.
13 Kinoshita H,Yanagisawa A,Watanabe T,et al.Increase in the frequency of K-ras codon 12 point mutation in colorectal carcinoma in elderly males in Japan:the 1990s compared with the 1960s[J].Cancer Sci,2005,96(4):218-220.
14 Tai CJ,Chang CC,Jiang MC,et al.Clinical-pathological correlation of K-Ras mutation and ERK phosphorylation in colorectal cancer[J].Pol J Pathol,2012,63(2):93-100.
15 朱晓丽,蔡旭,张玲,等.中国结直肠癌患者中KRAS与BRAF基因突变特征及其临床病理相关性[J].中华病理学杂志,2012,41(9):584-589.
16 刘伟,王丽,余英豪,等.K-ras基因在中国结直肠癌患者中的突变状态[J].世界华人消化杂志,2011,19(13):1367-1374.
17 张文娟,杨桂芳,杨赤兵,等.直肠癌患者中K-ras基因12位点突变及p21蛋白表达的研究[J].临床外科杂志,2010,18(12):826-828.
18 吴伟,胡锦林,鞠海星,等.散发性大肠癌K-ras基因点突变研究及其临床病理意义[J].医学研究杂志,2010,39(12):53-57.
19 徐向明,张国良,李敏伟,等.结直肠癌组织中K-ras基因的检测及其意义[J].中华医学杂志,2010,90(18):1268-1271.
20 吴文辉,肖隆斌,汤友珍,等.K-ras基因突变与结直肠癌生物学行为的关系[J].中国病理生理杂志,2009,25(11):2159-2162.
21 Van Cutsem E,Kihne CH,Hitre E,et al.Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer[J].N Engl J Med,2009,360(14):1408-1417.
22 付大鹏,龚旭晨,孔长青.维吾尔族和汉族直肠癌患者K-ras 基因第12、13 位密码子突变情况的研究[J].中国普外基础与临床杂志,2013,20(2):165-168.
23 Salazar R,Roepman P,Capella G,et al.Gene expression signature to improve prognosis prediction of stage Ⅱ and Ⅲ colorectal cancer[J].J Clin Oncol,2011,29(1):17-24.
24 王建飞,韩晓红,石远凯.kras基因突变检测对结直肠癌靶向治疗的临床指导意义[J].中华检验医学杂志,2012,35(3):286-288,291.
25 张彤,马晓,张蕊.替吉奥治疗老年或功能状态评分差晚期结直肠癌患者的疗效观察[J].中国全科医学,2013,16(1):305-307.
26 徐晨,刘亚岚,黄洁,等.结直肠腺癌KRAS基因突变的检测及其临床意义[J].中华病理学杂志,2012,41(10):667-670.

