混合血清自制多项目质控品与商品化质控品的应用评价
欧阳贵平,谢香萍,薛玉华,江海清,江萍,孔小青,吴煜
(赣州市南康区第一人民医院检验科,江西赣州341400)
·质量控制·
混合血清自制多项目质控品与商品化质控品的应用评价
欧阳贵平,谢香萍,薛玉华,江海清,江萍,孔小青,吴煜
(赣州市南康区第一人民医院检验科,江西赣州341400)
目的评价以冰冻患者混合血清自制多项目生化质控品的可靠性和稳定性及自制质控品联合商品化质控品应用于常规室内质量控制。方法收集日常工作中生化检验剩余标本,加万分之二叠氮钠、混匀、离心、分装、低温保存,多次重复检测自制质控品的12个项目,评价自制质控品在低温保存下的稳定性、室内差异、瓶间差异及与商品化质控品联合应用于室内质量控制的性能。结果自制质控品12个项目的批内和天间变异均在5%以内,符合质量控制要求;置-40℃保存9个月12个检测项目稳定性良好,常规9项生化项目偏移均符合1/2美国CLIA,88可接受性能指标,ASO、RF和CRP三项偏移均<±5%。瓶间分装差异在室内质控品要求的允许范围内;自制质控品与两个批号参考质控品由于质控品原因引起的失控次数占总失控次数的百分率比较,差异均无统计学意义(P>0.05),室内质量控制效果良好。结论自制质控品符合临床使用性能,可替代参考质控品(正常参考值)用于室内质量控制,联合商品化质控品(异常值)可满足临床实验室室内质量控制要求,避免和弥补全部使用商品化质控品成本高、质控项目不全面等缺点,实现检验科节约成本和提高检验质量的统一。
自制质控品;商品化质控品;室内质量控制
DOI∶10.3969/j.issn.1674-1129.2014.06.020
依据《医疗机构临床实验室管理办法》,临床检测项目都要进行室内质量控制(IQC),并应使用正常和异常至少两个浓度值质控品的要求。合格的质控物是开展室内质量控制的前提,在我国室内质控品主要采用进口冻干质控品,其优点主要是质控品项目多、储存时间长、便于运输,但存在价格昂贵、需要准确加入一定量的重蒸水复溶,复溶过程也容易因加水不准或干粉丢失等原因造成测值误差和瓶间差,部分检测项目的质控品难以购买等问题。国外有学者进行了液性质控品稳定性的研究[1],国内部分研究人员如姜慧芬[2]、钟志敏[3]、黎卓华[4]、王琳[5]、唐立萍[6]报道了自制室内质控品用于临床免疫分析、类风湿因子、临床凝血功能和血脂检测的室内质量控制,并得到了良好的验证,具有无基质效应、成本低、无须复溶等优点,但存在项目单一、异常值标本不易短期内大量收集,难以达到室内质量控制高、低两种浓度质控品的要求。我们根据实际工作需要利用患者混合血清制备(部分项目正常浓度、部分项目异常浓度)多项目质控品并联合商品化质控品(异常值浓度)用于IQC,现报道如下。
1 材料与方法
1.1 材料
1.1.1 试剂葡萄糖(GLU)氧化酶法、尿素(UREA)紫外-谷氨酸脱氢酶法、尿酸(UA)氧化酶法、天门冬氨酸氨基转移酶(AST)紫外-苹果酸脱氢酶法、C-反应蛋白(CRP)免疫比浊法、白蛋白(ALB)溴甲酚绿法、甘油三酯(TG)甘油磷酸氧化酶法、胆固醇(CHO)氧化酶法,试剂盒均为上海科华生物公司产品;抗链球菌溶血素O(ASO)胶乳增强免疫比浊法、类风湿因子(RF)胶乳增强免疫比浊法、淀粉酶(AMY)麦芽七糖苷法,试剂盒均为宁波美康生物公司产品;肌酐(CREA)肌氨酸氧化酶法,英科新创(厦门)科技有限公司产品。所有试剂均在有效期内使用。
1.1.2 仪器日立7180全自动生化分析仪,海尔低温冷冻冰箱,上海跃进数显式三用电热恒温水浴箱,鑫奥GENIUS 5K-D离心机。
1.1.3 自制质控品的制备收集实验室日常检测标本中的无污染、溶血、黄疸和脂血新鲜血清(CRP浓度>20mg/L、RF>50IU/ml、ASO>50IU/ml、AST>30U/ L)500ml,其大多数项目为正常参考值范围。所有标本经检测术前四项(HBsAg、抗-HCV、抗-HIV1/2、TP-Ab)均为阴性,储存于-40℃保存备用。复溶冰冻混合血清,初步检测相关物质的浓度是否与预期值(自制质控品正常项目值与881UN定值相近;异常项目值大于或小于634UE定值)相符合,加入万分之二的叠氮钠,将容器用薄膜封口,上下左右振摇15min,重复5次,每次间隔10min,混匀, 3800r/min离心10min,除去纤维蛋白沉淀物,用Eppendolf管按1ml分装,-40℃保存备用。
1.1.4 参考质控品用RANDOX生化质控品,采用RANDOX生化质控品HUM PREC CONTROL3,批号为∶634UE,HUM PREC CONTROL2,批号为∶881UN。
1.2 方法所有测试均是在仪器维护保养后,检测项目重新定标,有参考质控品的在室内质控在控的情况下测定。
1.2.1 室内差异评价批内重复性试验:取制备好的质控品在尽可能短的时间内进行20次连续检测,并求其x、s、和CV%。天间重复性试验:将自制质控品每天一次随机插入常规标本中检测,连续检测20天并求其x、s、和CV%。
1.2.2 稳定性评价低温冰冻贮存条件下的长期稳定性观察是血清样品稳定性研究的重要部分[7],自制质控品置-40℃0、3、6和9个月分别抽取20支自制质控品复溶并混匀,当天连续检测20次,当月x与初始x比较,计算偏移。偏移(%)=[(当月检测值-初始检测值)÷初始检测值]×100%。按1/2美国CLIA,88可接受性能指标规定进行评价,即CHO、GLU、ALB的偏移≤±5%,UREA的偏移≤±4.5%,CREA的偏移≤±7.5%,AMY的偏移≤±15%,TG的偏移≤±12.5%,UA的偏移≤±8.5%,AST的偏移≤±10%。其它三项(ASO、RF和CRP)由于方法学不同没有规定。
1.2.3 瓶间差异分析取20管自制质控品在仪器稳定的条件下,每管测定一次,为总不精密度,计算x总、S总和CV;取其中一管质控品连续测定20次,为测定不精密度,计算其x测、S测和CV,根据文献[8]推存的国外有关瓶间差评价方法对自制质控品瓶间差进行评价,按以下公式计算真实的瓶间差CV。

1.2.4 自制质控品与参考质控品应用于室内质量控制,其操作严格按照本室SOP文件进行。并对自制质控品与参考质控品用于室内质量控制的性能进行分析。
1.2.5 统计学分析采用SPSS11.5统计软件包处理,组间比较用χ2检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 室内差异评价自制质控品12个项目测定结果的批内和天间CV值均小于5%,重复性良好,结果见表1。
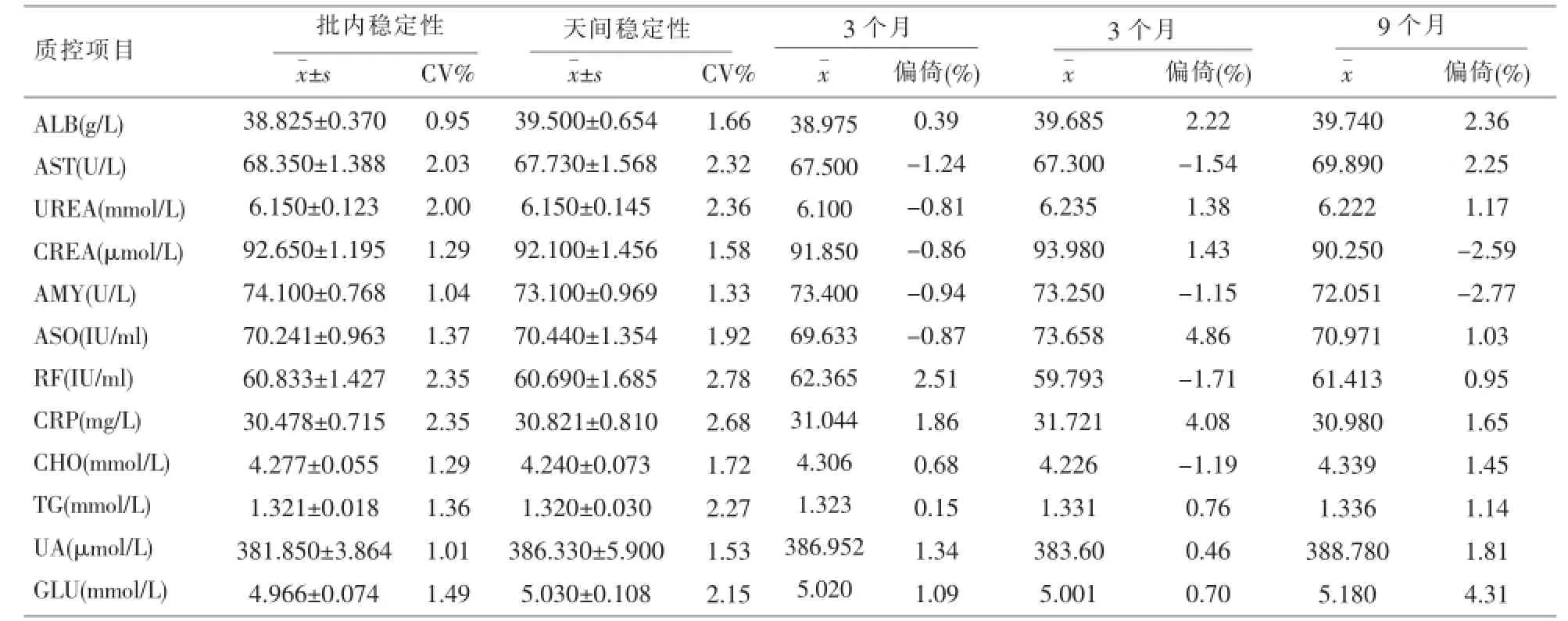
表1 自制质控品重复性测定结果和保存于-40℃置0、3、6和9个月测定结果比较(n=20)
2.2 稳定性评价自制质控品9个项目偏移结果均符合1/2美国CLIA,88可接受性能指标规定,置-40℃保存3、6、9个月9个检测项目稳定性均符合要求;其他三项ASO、RF和CRP的偏移均<±5%稳定性良好,能满足室内质量控制的要求,详见表1。
2.3 瓶间差异分析自制质控品12项检测项目瓶间差CV值均符合卫生部临床检验中心规定的质控品技术规格[9],结果详见表2。
2.4 联合应用自制质控品与参考质控品(两个批号)应用半年,二者对失控的检出有良好的一致性,自制质控品检出的98次失控中,UREA和GLU各出现一次由于质控品原因引起的失控,占2.04%;批号为881UN参考质控品检出64次失控,只有CREA出现一次失控占1.56%;批号为634UE参考质控品检出67次失控,GLU出现一次失控占1.49%;二者由于质控品原因引起的失控次数占总失控次数的百分率比较,差异无统计学意义(P>0.05)。室内质控Z-分数图显示自制质控品与两个批号参考质控品半年的平行日间质控数据走势、离散程度和对失控的检出非常相似。
3 讨论
从表1结果可以看出,自制质控品9个项目偏移结果均符合1/2美国CLIA,88可接受性能指标,ASO、RF和CRP的偏移均<±5%,据国外文献报道质控的标准是15%[10],稳定性良好。在-40℃放置9个月成份稳定,说明本实验室自制的多项目质控品12个检测项目有良好的重复性和稳定性,其瓶间差完全符合卫生部临床检验中心文件《临床化学质控血清一般技术要求》对于质控品瓶间差的要求:酶项目CV小于2%,其余项目CV小于1%,存放后不稳定成分(如胆红素、血糖和酶等)其CV值不能超过原来CV值的1.5倍。从自制质控品与参考质控品联合应用于室内质控的结果和室内质控图分析,显示两种质控品半年的平行日间质控数据走势、离散程度和对失控的检出都非常相似,二者由于质控品原因引起的失控与总失控次数百分率比较无统计学差异,进一步说明了自制质控品的性能稳定,可以替代相同或相近浓度的商品化质控品,完全能用于室内质量控制。需要指出的是,由于方法学的改进,如ASO、RF和CRP等免疫学检测项目,在多数基层医院采用生化分析仪检测,但很多试剂厂家暂时还不能提供相关质控品,自制质控品在这些项目室内质量控制中取得了良好的效果,弥补了商品化质控品不能覆盖的部分检测项目。由于时间和实验条件的限制,对此自制质控品更多的检测项目分析还有待进一步研究、完善。
综上,本实验室自制的质控品符合室内质控品应具有的分析物稳定、均一、瓶间差异小、合理的分析物浓度、特别是无基质效应等要求,自制的质控品主要以正常值为主,部分项目为异常值,具有原料来源便利,制作技术较为成熟的特点,有利于IQC和EQA的开展,联合异常值商品化质控品用于室内质量控制,能弥补基层医院对多项目质控品的需要;自制质控品还能解决商品化质控品价格昂贵、需要复溶、不能覆盖全部检测项目等缺点,使自制质控品和商品化质控品达到优势互补,实现检验科节约成本和提高检验质量的统一。

表2 自制质控品的瓶间差分析
[1]Goi G,Besozzi M,Bairati C,et al.Preparation of a stable liquid material for calibration and quality control for lysosomal enzymes in plasma.Assay of enzymes of lysosomal origin in plasma,I[J].Eur J Clin Chem Clin Biochem,1992,30(10)∶595-598.
[2]姜慧芬,张剑英,陈文虎.自制冻干多项目肿瘤标志物质控品的评价[J].浙江实用医学,2013,18(1)∶9-11.
[3]钟志敏,王维,莫云丹,等.自制肿瘤标志物复合质控血清稳定性的研究[J].临床和实验医学杂志,2011,10(15)∶1137-1141.
[4]黎卓华,李鄂,王希平,等.自制类风湿因子质控品应用及其质量的监控作用评价[J].国际检验医学杂志,2007,28(9)∶860-861.
[5]王琳,王笔金.自制凝血质控品用于室内质控的研究[J].实验与检验医学,2009,27(4)428-429.
[6]唐立萍,张瑞镐,居漪,等.复合血脂质控品的制备及性能评价[J].检验医学,2013,28(5)∶430-433.
[7]ISO Guide 35.Reference material general and statigtical principles for certifications[S].ISO,Geneva,Switzer,2006.
[8]王建中,汪润,袁家颖,等.流式细胞计数淋巴细胞亚群的全血质控品的研究[J].中华检验医学杂志,2005,2(9)∶897-901.
[9]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].第3版.南京∶东南大学出版社,2006∶88-89.
[10]Wilson JF.Survey of reference ranges and clinical measurements for psychoactive drugs in serum[J].Ther Drug Monit,2003,25(2)∶243-247.
R446.11+2
A
1674-1129(2014)06-0705-03
2014-03-09;
2014-09-25)
赣州市科技局计划项目(GZ2014ZSF383)

