LmbB2催化酪氨酸合成左旋多巴的工艺研究
马强强,赵广荣
(天津大学 化工学院制药工程系 系统生物工程教育部重点实验室 天津300072)
左旋多巴(L-DOPA)化学名为 β-3,4-二羟苯基-α-丙氨酸(3,4-2dihydroxylphenylalanine)(图 1),又名3-羟基-L-酪氨酸。其作用机理为左旋多巴能通过血脑屏障,到达中枢神经系统,在脱羧酶的作用下,转变为多巴胺,进而发挥治疗帕金森综合症的作用[1]。目前左旋多巴的制备方法主要有化学合成,植物提取,生物酶催化以及微生物发酵。由于化学合成和植物提取方法具有一定的局限性。20世纪60年代末,国内外一些学者开始探索生物酶法合成左旋多巴。左旋多巴的生物合成常用的酶有两种,其一是酪氨酸酚解酶[2],以邻苯二酚、丙酮酸和氨水为底物,催化形成;另外一种是一种羟化酶[3],在酪氨酸的临位羟基上直接羟化,形成左旋多巴。
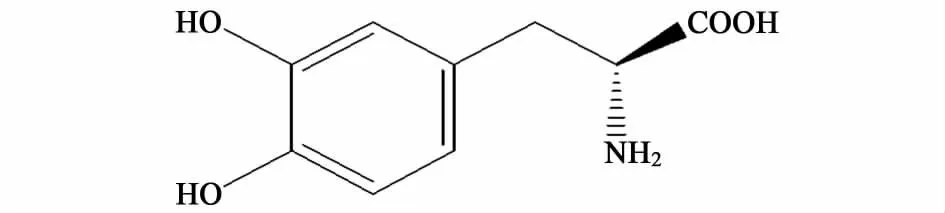
图1 左旋多巴Fig.1 L-DOPA
林可链霉菌中lmbB2基因编码的蛋白(LmbB2)具有酪氨酸酶的功能[4],可催化L-酪氨酸生成左旋多巴。本研究是以林可链霉菌的lmbB2为目的基因,连入pCDFDuet-1载体中,构建了表达载体,转化大肠杆菌BL21(DE3),合成了左旋多巴。并通过添加底物以及L-抗坏血酸,以提高左旋多巴的产量。
1 试验部分
1.1 实验材料
Streptomyces lincolnensis,大肠杆菌 Escherichia coli DH5a,E.coli BL21(DE3),本实验室保存;表达载体pCDFDuet-1购于 Novagen公司;pEASY-T3载体购于北京全式金生物技术有限公司;左旋多巴购于上海晶纯实业有限公司;酪氨酸购于上海生工生物工程有限公司。
1.2 载体构建
在MS固体培养基上活化林可链霉菌,转接在YEME培养基中,36 h后收获菌丝体。根据链霉菌遗传操作手册[5],采用Kriby-mix方法提取链霉菌基因组DNA。利用引物lmbB2-F:GCCGGAATTCGATGAGTTCACTCGAGGCACGC(下划线为 Eco RI酶切位点),lmbB2-R:GCCCAAGCTTAGCACTGCCTGACCAGGCT(下划线为Hin dⅢ酶切位点),扩增目的基因。TA克隆,转化DH5a感受态,测序。
从测序正确克隆菌中提取质粒,用 Eco RI和Hin dⅢ双酶切,回收片段连接到双酶切的载体pCDFDuet-1中,获得 pCDF-lmbB2表达载体,转化 BL21(DE3)感受态。
1.3 发酵培养
在M9培养基中,加入质量分数为0.4%的甘油,37 ℃,220 r/min,培养 BL21(DE3)/pCDF-lmbB2重组菌。菌体培养至OD600≈0.5,添加异丙基-β-D-硫代吡喃半乳糖苷(IPTG)诱导,终浓度为1 mmol/L。每4 h测定 OD600,取样1 m L。样品10 000 r/min离心5 min,取上清用0.22μm滤膜过滤,用HPLC检测左旋多巴含量。
1.4 左旋多巴的测定
使用Agilent 6310型HPLC,二极管阵列检测器(DAD),流动相为乙腈/0.08%甲酸为2.4/97.6,色谱柱 C18 柱(250 ×4.0,particle size,5 μm),柱温30℃,检测波长280 nm,流动相流速1 mL/min,进样体积10μL。
1.5 酪氨酸的添加对发酵的影响
酪氨酸在水中的溶解度低,为了研究酪氨酸对发酵的影响,选定培养基中酪氨酸浓度分别为100、200、300、400 mg/L。 菌体培养至 OD600≈0.5,添加IPTG诱导,终浓度为1 mmol/L。
1.6 L-抗坏血酸对发酵的影响
M9培养基,添加0.4%甘油,酪氨酸300 mg/L。添加抗坏血酸的终浓度分别成为 100、1 000、3 000 mg/L。菌体培养至OD600≈0.5,添加 IPTG诱导,终浓度为1 mmol/L。
2 结果
2.1 lmbB2基因表达载体构建与表达
林可链霉菌lmbB2基因的编码区长度954 bp,编码产物LmbB2的理论大小为31 KD。由于该基因3’-端连续GC,不能有效扩增。为此在终止密码下游204 bp处设计了反向引物,PCR扩增整个片段大小为1 177 bp。PCR产物的琼脂糖凝胶电泳如图2。连接到pEASY-T3载体上,经过酶切、测序鉴定,获得了lmbB2基因。进一步与pCDFDuet-1酶切连接,构建了pCDF-lmbB2表达载体(图3),转化BL21(DE3)感受态,获得了工程菌株。
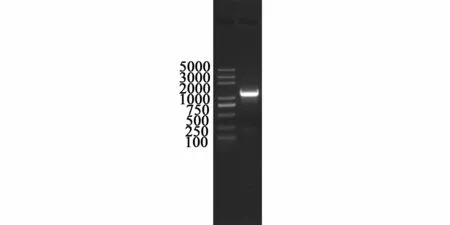
图2 lmbB2的PCR扩增产物Fig.2 Gel electrophoresis of PCR p roduct of lm bB2

图3 pCDF-lm bB2表达载体的酶切电泳图Fig.3 Gel electrophoresis of EcoRI/H ind II digestion of pCDF-lm bB2
IPGT诱导工程菌株后,LmbB2的蛋白质电泳如图4。LmbB2蛋白集中在上清部分,表明 lmbB2是可溶性表达。
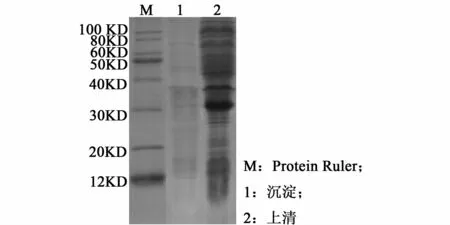
图4 重组菌表达产物的SDS-PAGE电泳Fig.4 SDS-PAGE of E.coli L21(DE3)/pCDF-lm bB2
2.2 重组菌合成左旋多巴的能力
用M9培养基,IPTG诱导后连续发酵培养36 h,生长曲线如图5。重组菌和对照菌(无 lmbB2基因)的生长没有明显差异,表明外源基因 lmbB2对菌体生长无显著影响。左旋多巴生成曲线如图6。发酵4 h就检测到左旋多巴的合成,到16 h时左旋多巴的产量达到最大,为 37 mg/L,随后产量下降。
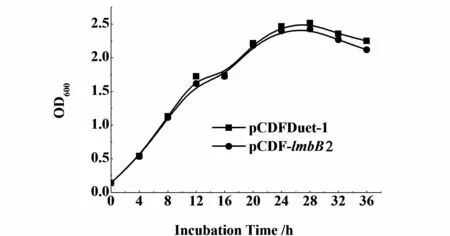
图5 重组菌的生长曲线Fig.5 G row th curve of the recom bination strains
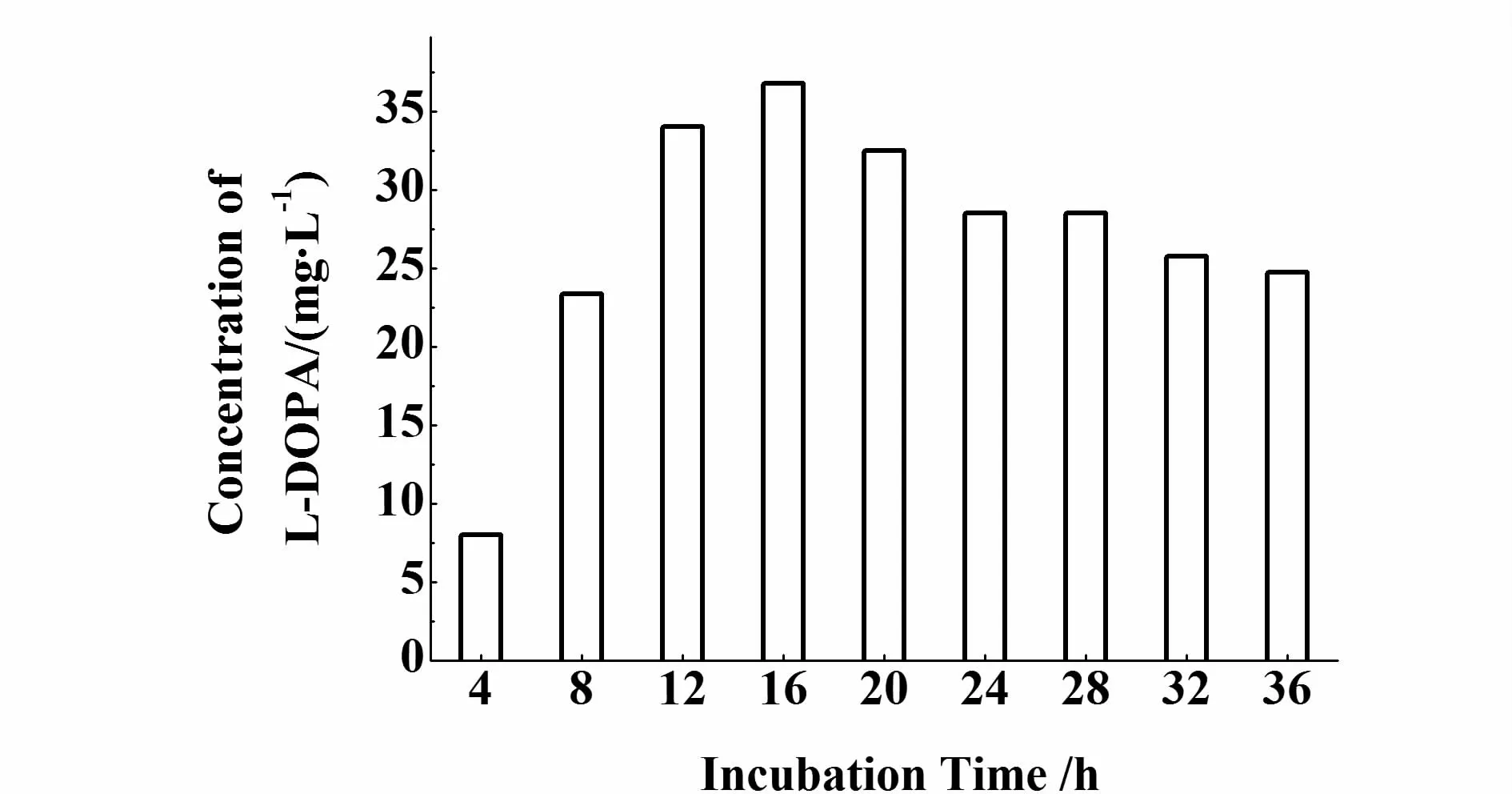
图6 发酵过程中左旋多巴的含量Fig.6 Concentration of L-DOPA in ferm entation p rocess
2.3 底物酪氨酸对左旋多巴产量的影响
酪氨酸是LmbB2催化的底物,直接影响左旋多巴产量。添加酪氨酸后,重组菌的生长速度明显变慢(如图7),左旋多巴的产量大大增加(图8)。当添加酪氨酸300 mg/L时,发酵32 h,发酵液中左旋多巴产量最高,为122 mg/L,与未添加组(15 mg/L)相比,提高了8倍,酪氨酸的转化率为40.67%。
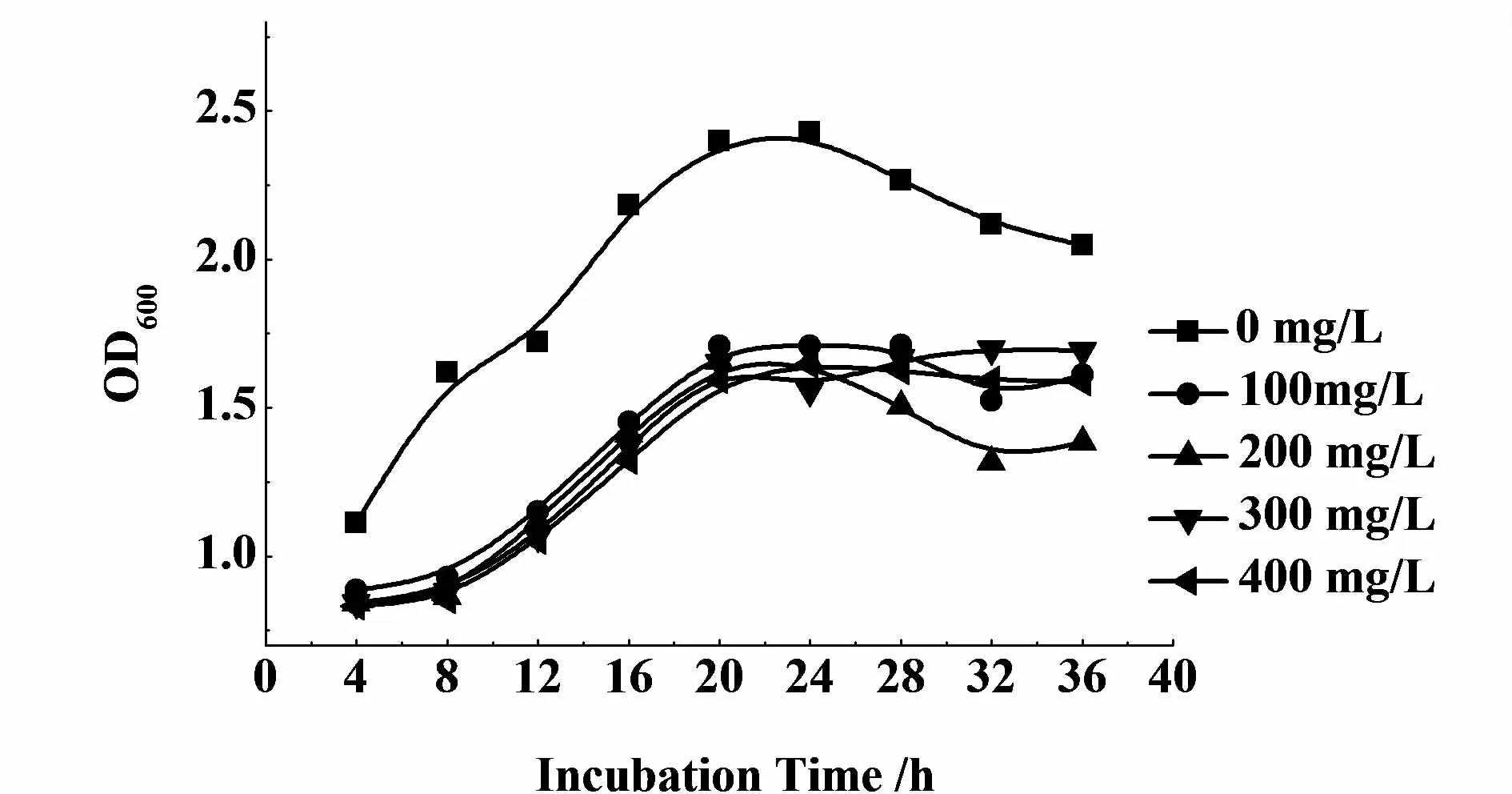
图7 添加不同浓度L-酪氨酸对重组菌细胞生长的影响Fig.7 Effects of concentration of L-tyrosine on cell grow th
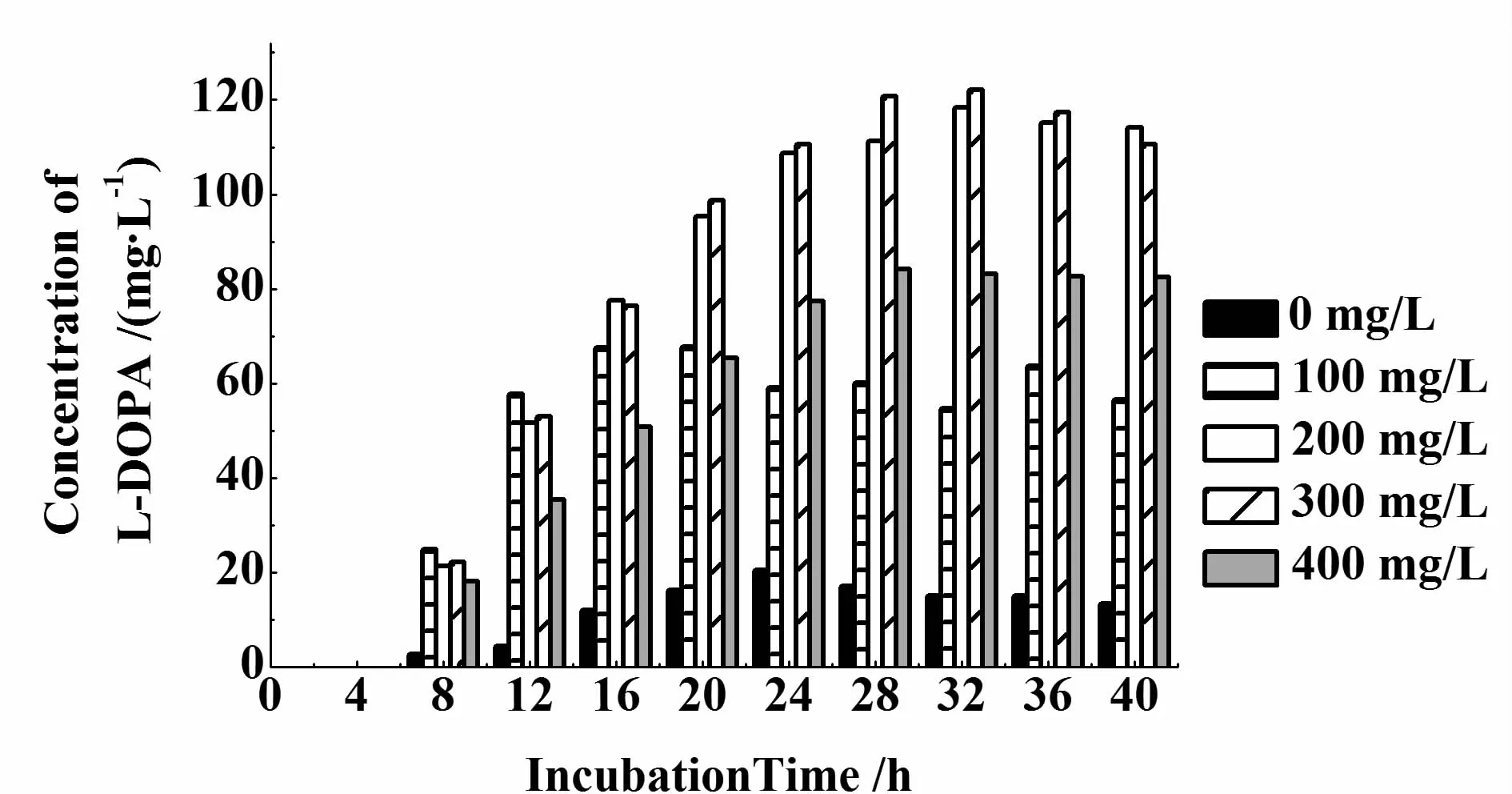
图8 添加不同浓度酪氨酸对左旋多巴的产量的影响Fig.8 Effects of concentration of L-tyrosine on yield of L-DOPA
2.4 L-抗坏血酸对左旋多巴合成的影响
在发酵过程中,发现左旋多巴的减少,伴随着培养液颜色变黑,可能左旋多巴被进一步氧化或聚合[6]。为此,添加还原剂抗坏血酸,左旋多巴的产量显著增强(图9),而对大肠杆菌的生长影响不明显(图10)。添加3 g/L抗坏血酸,发酵32 h时,左旋多巴的产量最大,达285 mg/L,酪氨酸的转化率达95%。
3 讨论
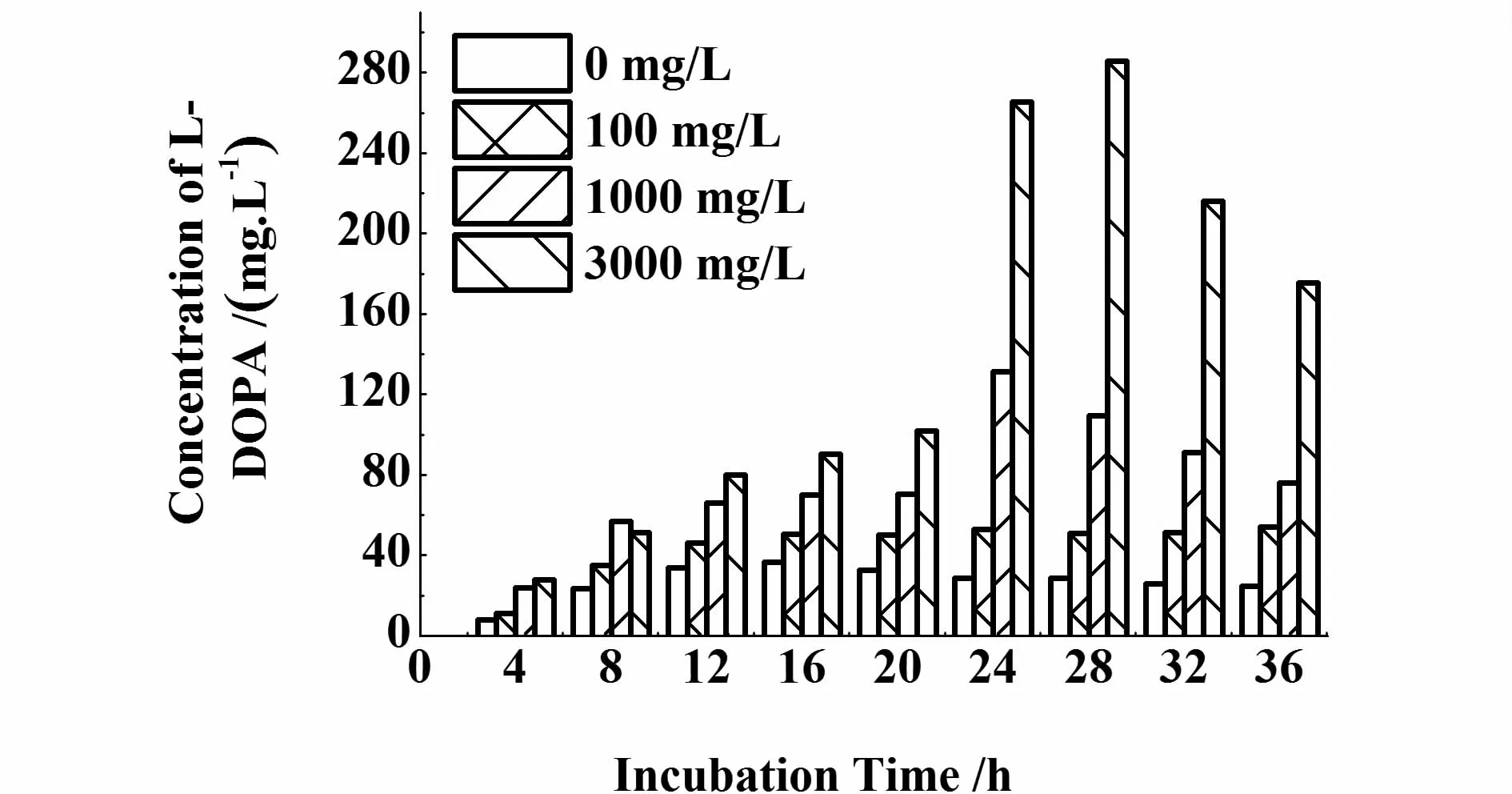
图9 添加不同浓度抗坏血酸对左旋多巴产量的影响Fig.9 Effects of concentration of L-ascorbic acid on yield of L-DOPA
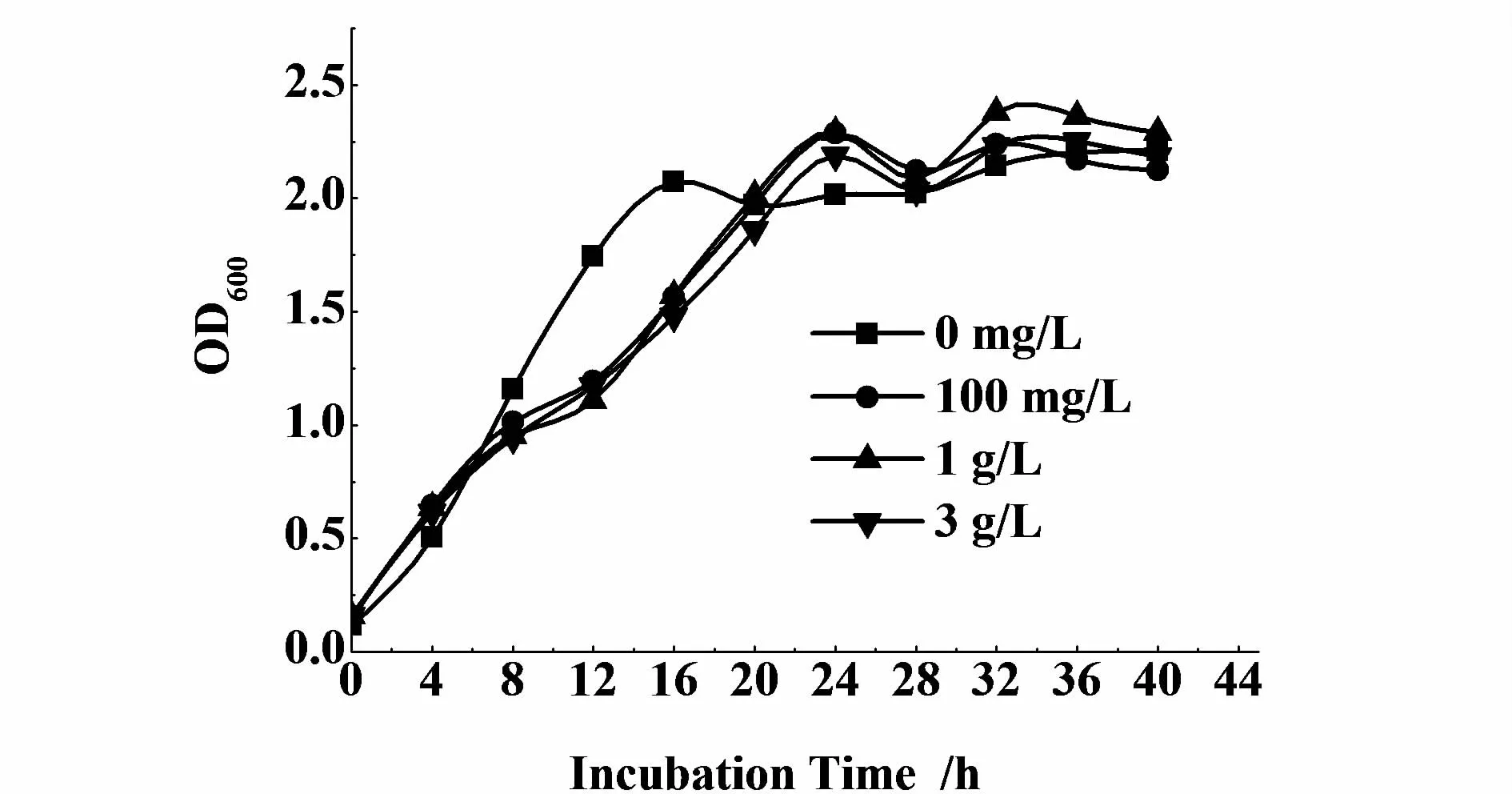
图10 添加不同浓度L-抗坏血酸时重组菌的生物量Fig.10 Effects of concentration of L-ascorbic acid on cell grow th
酪氨酸酶通常同时具有单酚氧化酶和二酚氧化酶活性,其中单酚氧化酶催化单酚羟基化,二酚氧化酶可将二酚类化合物氧化为醌类化合物。左旋多巴不稳定,在有氧条件下可自发氧化为多巴醌[7]。本实验结果表明,LmbB2可催化 L-酪氨酸转为左旋多巴,同时继续氧化多巴生成多巴醌,使培养液呈现黑色。为防止左旋多巴的氧化,可以加入还原剂。李华钟等[8]报道,以磷酸吡哆醛为辅酶,酪氨酸酚解酶催化邻苯二酚、丙酮酸和氨生成左旋多巴中,添加 Na2S2O3以及 EDTA,可以提高产率。本实验中添加Na2S2O3对LmbB2合成左旋多巴没有效果。Seetharam等[9]在生物合成左旋多巴中使用了NADH或者羟胺。
无论是在固定化酪氨酸酶中[10-11],还是在用菌体催化L-酪氨酸转化为左旋多巴,使用抗坏血酸效果最好。Mariam等[12]在米曲霉转化左旋多巴的反应体系中添加抗坏血酸,可以使酶从预先生长的菌丝体中游离出来,在体外直接参与催化活动,减少底物吸收进入细胞的过程。Ho等[13]研究表明,添加抗坏血酸可以使反应体系中生成的多巴醌重新还原为左旋多巴。在本实验中,抗坏血酸的添加效果显著,左旋多巴大量积累。但当抗坏血酸消耗完全之后,这种效应消失,如图8所示,在发酵36 h后,左旋多巴积累减少,发酵液开始变为棕黑色。
在L-酪氨酸转化为左旋多巴的生物合成中,由于产物已被酶促和非酶促氧化,而不稳定。添加抗坏血酸具有很好的稳定作用,其效应与转化酶或微生物、培养基组成、发酵条件等有密切关系。本论文以300 mg/L L-酪氨酸,表达 LmbB2的工程大肠杆菌,添加3.0 g/L L-抗坏血酸,37℃下发酵培养36 h,获得左旋多巴的产量最高,是适宜的工艺条件。然而,添加抗坏血酸,增加了成本和工艺控制的复杂程度。在今后研究中,应该从代谢工程角度,平衡细胞内的氧化还原,开发左旋多巴的新转化工艺。
[1]Poewe W,Antonini A,Zijlmans J,et al.Levodopa in the treatment of Parkinson’s disease:An old drug still going strong[J].Clinical Interventions in Ageing,2010,5:229-238
[2]Huang S,Shen Y,Chan H.Development of a bioreactor operation strategy for L-DOPA production using Stizolobium hassjoo suspension culture[J].Enzyme and M icrobial Technology,2002,30(6):779-791
[3]Krishnaveni R,Rathod V,Thakur M S,et al.Transformation of L-Tyrosine to L-DOPA by a novel fungus,Acremonium rutilum under submerged fermentation[J].Current M icrobiology,2009,58(2):122-128
[4]Neusser D,Schm idt H,Spizek J,et al.The genes lmbB1 and lmbB2 of Streptomyces lincolnensis encode enzymes involved in the conversion of L-tyrosine to propylprolane during the biosynthesis of the antibiotic lincomycin A[J].Archieve of Microbiology,1998,164(4):322-333
[5]Kiesr T,Bibb J,Chater K,et al.Practical streptomyces genetics [M].England:John Innnes Foundation,2002
[6]Seo SY,Sharma V K,Sharm N.Mushroom tyrosinase:Recent prospects[J].Agricultural and Food Chem istry,2003,51(10):2 837-2 853
[7]Korner A,Pawelek J.Mammalian tyrosinase catalyzes three reactions in the biosynthesis of melanin[J].Science,1982,217(4565):1 163-1 165
[8]李华钟,孙伟,王树英,等.重组大肠杆菌合成左旋多巴条件的优化[J].工业微生物,2002,32(2):5-9 Li Huazhong,Sun Wei,Wang Shuying,et al.Optim ization of L-DOPA synthesis by recombinant E.coli[J].Industrial Microbiology,2002,32(2):5-9(in Chinese)
[9]Seetharam G,Saville B A.L-DOPA production from tyrosinase immobilized on zeolite[J].Enzyme and M icrobial Technology,2002,31(6)747-753
[10]Tuncagil S,Kayahan SK,Bayramoglu G,et al.L-DOPA synthesis using tyrosinase immobilized on magnetic beads[J].Journal of Molecular Catalysis B:Enzymatic,2009,58:187-193
[11]Surwase SN,Jadhav JP.Bioconversion of L-tyrosine to L-DOPA by a novel bacterium Bacillus sp.JPJ[J].A-mino Acids,2011,41:495-506
[12]Mariam I,Ali S,Rehman A,et al.L-Ascorbate,a strong inducer of L-dopa(3,4-dihydroxy-L-phenylalanine)production from pre-grown mycelia of Aspergillus oryzae NRRL-1560[J].Biotechnology and Applied Biochemistry,2010,55(3):131-137
[13]Ho P Y,Chiou M S,Chao A C.Production of L-DOPA by tyrosinase immobilized on modified polystyrene[J].Applied Biochemistry and Biotechnology,2003,111(3):139-152

