他克莫司微生物合成的研究进展
万涛,黄笛,闻建平
(天津大学化工学院,系统生物工程教育部重点实验室,天津300072)
他克莫司(Tacrolimus,FK-506)是由筑波链霉菌(Streptomyces tsukubaensis)发酵产生的一种由二十三元环组成的大环内酯类抗生素。他克莫司广泛应用于特应性皮炎、变应性接触性皮炎、银屑病、红斑狼疮、扁平苔癣、白癜风、Nethenton综合症和抑制宿主病等自身免疫疾病的治疗[1]。他克莫司商品名为Protopic,于1994年被美国食品和药物管理局(FDA)批准上市,是治疗特异性皮炎早期缓解和长期控制的非甾体类药物[2],目前临床应用于预防肝脏或肾脏移植术后的移植物排斥反应,治疗肝脏、胰腺、肾脏、心脏、肺等实体器官移植术后应用其他免疫抑制药物无法控制的移植物排斥反应。由于在临床效果免疫抑制作用比环孢素A强10~100倍,因而大大降低了临床使用剂量,同时不良反应也明显降低。他克莫司市场大部分被欧美国家占领,开发具有我国自主知识产权的他克莫司生产技术十分必要。
本论文主要对他克莫司的理化特征和免疫抑制活性、他克莫司微生物发酵、合成基因簇的研究成果和前体代谢工程的研究状况进行了综述,同时结合系统生物学和合成生物学对他克莫司的生产及其基因组尺度代谢工程改造进行了展望。
1 他克莫司的理化特征和免疫抑制活性
他克莫司是从链霉菌属(Streptomyces)中分离出的发酵产物,包括 Streptomyces tsukubaensis,Streptomyces tacrolim icus,Streptomyces sp.ATCC 53770,Streptomyces sp.MA6949,Streptomyces kanamyceticus KCC-S0436,Streptomyces glaucescens,Streptomyces clavuligerus CKD1119。他克莫司是一种很有效的23元大环内酯类新型免疫抑制剂,分子式是 C44H69NO12,相对分子质量为804.02,化学结构式如图1,在常温下为无色晶体,难溶于水,易溶于甲醇、乙醇、乙酸乙酯、乙醚、氯仿和丙酮等有机溶剂。熔点为127~129℃,在不同贮存条件下稳定性都较高[2]。

图1 他克莫司(FK 506)分子式Fig.1 Form u la of Tacrolim us(FK 506)
研究发现,他克莫司可以有效抑制T淋巴细胞的诱导作用,能够抑制淋巴因子 IL-2,IL-3,IFN-Y的产生和IL-2受体的表达,同时他克莫司抑制了ConA活性和相同抗原诱导的淋巴细胞活化,以及淋巴细胞的增殖反应[3]。体内实验也证明他克莫司在免疫抑制方面有良好表现,它可以延长大鼠及狗的心脏、肝脏、肾脏和肢体等抑制器官的存活期,虽然抑制效果与与药物浓度存在相关性,但药物剂量过大会产生一定的副作用。小剂量的环孢霉素或强的松在与他克莫司共同使用时,可以降低他克莫司的用量,从而减弱其产生的毒性,进而增强其免疫抑制作用。临床发现,他克莫司能够明显减少肾脏移植后出现的急慢性排斥反应发病率,改善手术后肾脏的功能,并且降低高血脂和高血压等病症的发生率[3]。除此之外,他克莫司还被证实具有很好的抑制炎症作用[4],以及抑制人的肺肥大细胞或嗜碱性细胞的组胺或LTC4等炎症介质的释放。多种炎症性皮肤病的炎症介质为组胺和前列腺素D2,小剂量他克莫司可以抑制免疫球蛋白E激活人体皮肤肥大细胞释放组胺和前列腺素D2。
2 他克莫司的微生物发酵生产
由于他克莫司的重要医用价值,很多人尝试着用培养基优化的方法提高他克莫司的产量。1984年,日本藤泽公司研究所从日本筑波山土壤中分离的筑波链霉菌的发酵液中提取得到他克莫司的发酵产率很低,优化发酵条件之后,产率提高了10倍多。之后,进行了菌株的改良和发酵条件的进一步优化,生产能力提高了几十倍。1991年,Merck公司对菌株经过优化后,他克莫司7 d达到37.8 mg/L。Kumar等[5]从土壤中筛选出一株链霉菌,他克莫司产量较高而且副产物极少,诱变后发酵300 h他克莫司产量最高为5~10 mg/L,该研究组之后在高通气量的糊精培养基中通过补料分批发酵192~279 h,产量达到 300 ~310 mg/L[6]。
Yoon等[7]研究了初始培养基中添加磷酸盐、铵盐和氨基酸等对菌种合成他克莫司的影响,发现铵离子的添加虽然可以刺激菌丝生长、提高葡萄糖和磷酸盐吸收速率,但是对他克莫司合成具有阻遏作用,最终利用30 mmol/L的亮氨酸和24.5 mmol/L的乳酸为初始碳源,将他克莫司的产量由12.7 mg/L提高到了18.2 mg/L。Kim等[8]通过向初始培养基中添加3 g/L玉米油,发酵8 d将他克莫司的产量由145 mg/L提高到了235 mg/L。该研究还考察了他克莫司发酵过程中脂肪酶的酶活性变化,指出该酶在玉米油的诱导下合成,并且在添加葡萄糖后明显被抑制,证实脂肪酶与他克莫司发酵单位成正相关,暗示高的脂肪酶活性成为他克莫司合成过程中的重要因子,同时也证明了油脂作为前体的重要性。他们通过在200 L发酵罐放大后最高产量达到495 mg/L,比生产单位也达到0.34 g/g菌体干重。Singh等[9]研究了外源添加花生油、大豆油、棉籽油和氨基酸对于菌种Streptomyces spp.MA6858 B3178合成他克莫司的影响,外源添加30 g/L大豆油和0.2 g/L的赖氨酸,发酵5 d时产量由85.8 mg/L提高到103.1 mg/L。同时,该研究还得出他克莫司在不同碳源发酵条件下呈现双阶段行为---在开始24 h单糖主要用来合成菌体,36 h后豆油和赖氨酸添加不仅维持菌体生长,还提高了产物生成,并且培养基pH值起到关键作用。Jung等[10]通过逐渐提高培养基中他克莫司的浓度(600~1 600 mg/L)来增加菌株对产物的耐受性,最终获得的菌株产量达到972 mg/L。
目前,国内研究他克莫司主要围绕自然筛选,原始菌株诱变筛选,优化发酵培养基和发酵操作条件等。李玲等[11]采用抑菌圈法初筛得到71株能抑制白色假丝酵母生长的菌株,高效液相色谱法检测代谢产物复筛,获得一株他克莫司产生菌株。王秀琴等[12]采用通过复合诱变的方法对出发菌株筑波链霉菌08-6-9进行处理,得到一株高产菌株,其摇瓶发酵水平较出发菌株提高73.6%。郑军荣等[13]应用化学和物理诱变剂对他克莫司产生菌进行菌种诱变,并利用特定的选择剂(莽草酸和哌可酸及其相应的结构类似物)作为选择压力筛选出高产突变株,相对发酵效价比出发菌株提高了约2倍。刘忠[14]通过正交试验优化了他克莫司产生菌的发酵培养基,考察了不同的发酵条件对他克莫司合成的影响,研究发现,在5 m3发酵罐上发酵144 h他克莫司的的产量可以达到330 mg/L。
3 他克莫司合成基因簇及其代谢途径
他克莫司结构复杂,内酯环由5个甲基丙二酰、2个丙二酰、2个甲氧基丙二酰和1个烯丙基丙二酰延伸单元组成,环外的环己烷来自分支酸,哌可酸来自赖氨酸,甲氧基来自甲硫氨酸。目前,他克莫司生物合成基因簇基因产物的功能已基本得到阐明[15-17],他克莫司总的合成过程如图 2所示,由聚酮合酶(PKS)开始聚合前体物,PKS包括 3个部分---FkbB负责分支酸衍生物4,5-二羟基-1-烯基环己烷羧酸(DHCHC)以及4个延伸单位(2个甲基丙二酰辅酶A,1个丙二酰辅酶A,1个烯丙基丙二酰辅酶A)的连接和缩化;FkbC有2个延伸单位(2个甲基丙二酰辅酶A);FkbA有2个延伸单位(2个甲氧基丙二酰辅酶 A,1个甲基丙二酰辅酶 A,1个丙二酰辅酶A)。每个延伸单元伴随特别的β-酮基延伸步骤,聚酮链也对应增长。FkbA、FkbB和FkbC组成了I型PKS系统,每个模块单元包含了几个酶结构体:酮酰合酶(KS),酰基转移酶(AT),酰基载体蛋白(ACP),他们用于链延伸,同时部分含有脱水酶(DH),烯酰还原酶(ER),酮基还原酶(KR)(图2)。PKS合成的中间体与FkbP肽合酶催化的哌克酸缩合、成环。在PKS复合体释放后,13元环进入后修饰过程,C9位被FkbD氧化成酮基官能团,C31位被 FkbM甲基化(图2)。当 C21位 R官能团为甲基,即他克莫司插入的烯丙基丙二酰辅酶A被乙基丙二酰辅酶A替换时生成产物为子囊霉素(FK520)。当C21位R官能团双键被加氢,则产物为双氢他克莫司(FK506D)。
他克莫司生物合成基因簇已经被测序并从实验证实了各个基因所具有的功能,其中,fkbA、fkbB和fkbC负责延伸单元的连接和缩化,形成内酯环;fkbL负责哌可酸的生物合成;fkbP负责哌可酸与内酯环连接;tcsA、tcsB、tcsC和 tcsD负责烯丙基丙二酰辅酶A的生物合成;fkbD负责他克莫司C9的羟基化、氧化,产生 β-羰基酰胺,fkbM负责 C31的羟基甲基化;fkbG、fkbH、fkb I、fkbJ和 fkbK负责甲氧基丙二酰辅酶A的合成;合成起始单元DHCHC是从由分支酸经过fkbO转化而来[18](图3)。他克莫司的生物合成过程是一个相当复杂的过程,要求一个高效的调控机制来保证初级代谢的前体供应,以及在PKS上的结合与催化和PKS的后修饰过程。除参与合成的必需基因外,在基因簇的两端还发现几个ORF。通过基因序列相似性分析,发现 tcs2、tcs7、fkbN编码的蛋白分别与AsnC、LysR、LAL家族转录调控子序列高度一致,推测可能起调控作用。Mo等[19]通过基因过表达、敲除与回补实验,发现 tcs2对他克莫司的合成不起作用,敲除或者过表达后都没有影响产量;tcs7起负调控作用,敲除后他克莫司和副产物子囊霉素产量提高了1.9和1.7倍;fkbN起正调控作用,调控因子对他克莫司的合成是必需的,敲除后菌株失去合成能力。
4 他克莫司菌株代谢工程
4.1 他克莫司前体代谢工程改造及竞争途径敲除
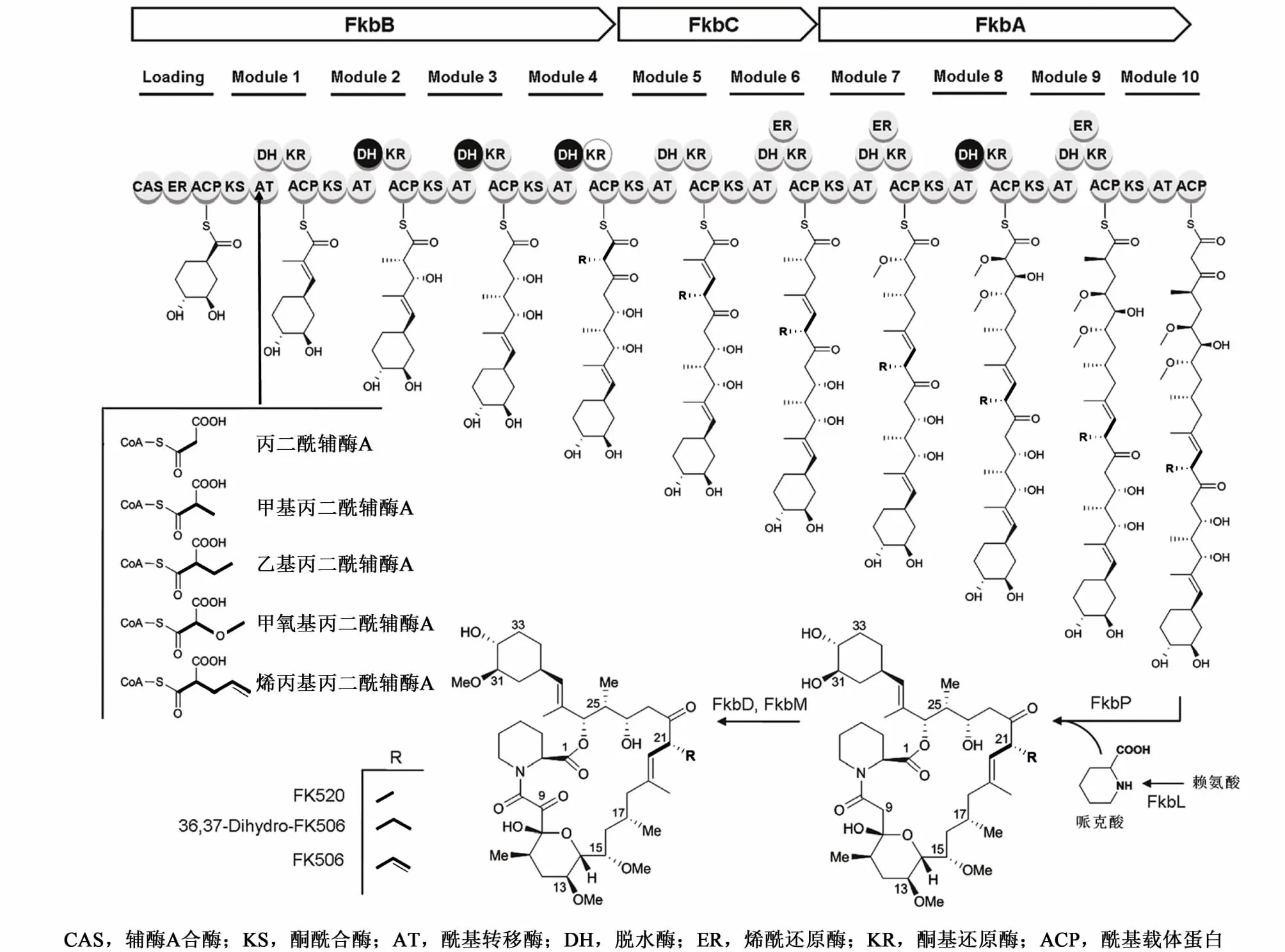
图2 他克莫司PKS和生物合成结构类似物过程[16]Fig.2 Schem atic rep resen tation of the PKS and biosynthesis of tacrolim us and its derivatives[16]
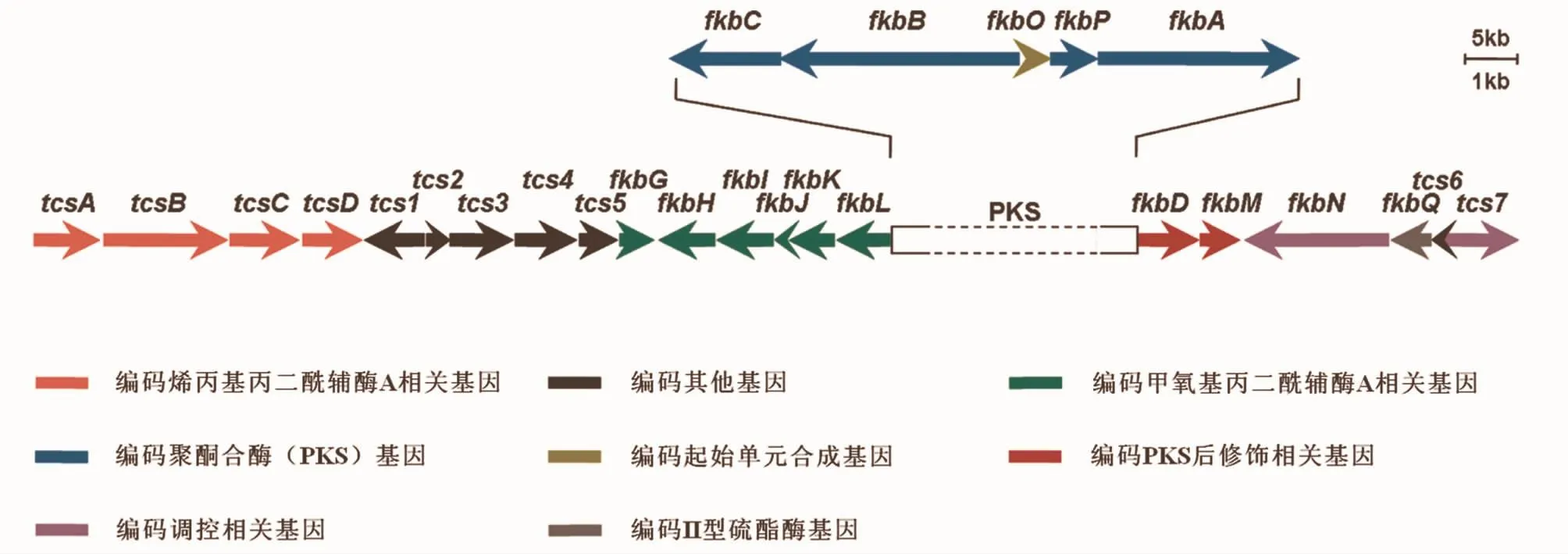
图3 他克莫司生物合成基因簇[16]Fig.3 O rganization of tacrolim us's biosynthetic gene clusters[16]
在前面的介绍中提到,他克莫司由10个辅酶A缩合而成,因此提高这些辅酶A前体的合成水平可以直接提高他克莫司的产量。其中,甲基丙二酰辅酶A合成途径有4条:由甲基丙二酰辅酶A变位酶催化的琥珀酰辅酶A异构化;通过丙酰辅酶A羧化酶对丙酰辅酶A的羧化反应实现;来自缬氨酸代谢产生的异丁酰辅酶A的多步氧化;丙二酰辅酶A/甲基丙二酰辅酶A连接酶途径。为了提高前体甲基丙二酰辅酶A的胞内水平,Mo等[20]研究发现,对原始菌株表达异源基因甲基丙二酰辅酶A连接酶和差向异构酶,丙酰辅酶 A羧化酶和丙酰辅酶 A合酶,他克莫司水平并没有提高,但是在过表达甲基丙二酰辅酶A变位酶后胞内甲基丙二酰辅酶A和他克莫司浓度分别提高3.0和1.5倍。Chen等[15]对他克莫司合成的2个稀有前体烯丙基丙二酰辅酶A和甲氧基丙二酰辅酶A合成途径分别过表达,发现他克莫司从46.9 mg/L分别提高到95.7和61.3 mg/L,分别提高了100%和30%。在同一株菌株过表达两个途径后产量提高到105.9 mg/L,提高了接近125%。
4.2 系统生物学指导下的他克莫司目标基因改造
由于他克莫司前体较多,通过多条途径合成,主要涉及到糖代谢、氨基酸代谢和脂肪代谢,受到细胞内还原力、能量供应的制约,而且涉及到胞内调控基因的时序性表达,而单纯的基因工程操作存在不确定性高、且通常只考虑单一的代谢途径,包含整个细胞内所有的基因-蛋白-反应关系也只是从化学计量角度分析,不能体现细胞基因所有调控功能以及反映出的真实动态胞内代谢特性和生物性状,对于实现微生物生理代谢功能的理性全局性调控水平很有限,很难找到目标基因以及更深层次的目标酶/酶系研究,因此开展他克莫司产生菌基因组尺度动态代谢调控网络分析进而改造目的基因、目标酶/酶系显得尤为重要。
随着基因组测序为代表的大规模数据产出,传统的生物学研究方式正在发生改变,在基因组测序和注释海量数据的基础上,基因组尺度稳态代谢网络重构迅速发展起来[21]。基因组尺度稳态代谢网络已经成为研究微生物代谢系统不可缺少的工具[22-23],在设计代谢工程经典途径、代谢物合成、代谢通量分析、不同物种代谢途径之间的进化分析、挖掘组学数据信息以及选择酶工程靶标物方面都具有重要的应用[24]。 本课题组[25]对目标产物他克莫司采用了基于基因组尺度拟稳态的代谢网络构建,并通过稳态代谢通量分析,OptKnock敲除模拟准确预测出能提高菌株他克莫司产量的目标基因,确定对他克莫司生物合成重要的关键酶;通过分子改造实验验证了模型预测,构建代谢工程菌株产量由150 mg/L提高到450 mg/L。
5 结语
目前,对他克莫司的生物合成研究正在朝着多尺度、系统化、合成生物学的方向发展。对模式微生物(如天蓝色链霉菌)的代谢网络、基因调控的深入研究,为研究筑波链霉菌提高他克莫司产量提供了借鉴意义;随着合成生物学的蓬勃发展,动态分析他克莫司的合成及调控途径,使菌株合成基因能适时表达成为可能。
1)对他克莫司生产菌的研究应采用系统生物学的技术手段,以整个细胞网络作为优化目标,利用转录组、蛋白组以及代谢组分析,在基因组规模上做动态分析菌体合成能力将对遗传调控信号和环境扰动的响应,将有利于揭示菌体的遗传机理,也将深入理解他克莫司生物合成的调控机制,如:转录调控、翻译调控、反馈抑制和代谢流的分布,实现在菌体细胞内调控元件之间的优化磨合对接,极大地提升模型预测的能动性和精确度,筛选出关键限速节点,为已有的他克莫司产生菌进一步进行代谢工程改造提供指导。
2)对他克莫司关键基因的合成生物学研究为开发具有更优性质的合成基因指明了方向。合成生物学倡导将不同的代谢途径组成“模块”,各“模块”之间按照统一的“接口”进行连接并表达相应的新途径。他克莫司合成机制的阐明及基因组序列的公布,为合成高效前体途径关键酶提供了新的有效突破口,从而理性重构合成途径,使菌株最高效地合成目的产物。随着合成生物学的蓬勃发展,采用全新酶的模拟优化对接进行全新设计、改造及优化,在不久的将来,可以根据目的不同构建全新高效的关键酶。
[1]Abdul H M,Sama M A,Furman J L,et al.Cognitive decline in alzheimer's disease is associated with selective changes in calcineurin/NFAT signaling[J].The Journal of Neuroscience,2009,29(41):12 957-12 969
[2]王海娜.FK506生物合成基因簇中甲氧基丙二酰ACP的异源表达研究[D].辽宁:大连理工大学,2012 Wang Haina.Heterologous expression ofmethoxy malonyl-ACP biosynthetic genes involved in the biosynthesis of FK506[D].Liaoning:Dalian University of Technology,2012(in Chinese)
[3]冀伟,季曙明.他克莫司和环孢素 A的疗效及其安全性比较[J].肾脏病与透析肾移植杂志,2005,14(3):285-289 JiWei,Ji Shuming.The efficiency and safety compari-sons of tacrolimus and cyclosporine A[J].Chinese Journal of Nephrology Dialysis&Transp lantion,2005,14(3):285-289(in Chinese)
[4]De Paulis A,Stellato C,Cirillo R,et al.Anti-Inflammatory effect of FK-506 on human skin mast cells[J].Journal of investigative dermatology,1992,99(6):723-728
[5]Paresh G,Vikas K,Parveen K,et al.Production of tacrolimus(FK-506)using new streptomyces species:WO,2005038009A2[P].2005-04-28
[6]Parveen K,Hitesh K M,Raj K M,et al.Fermentation processes for the preparation of tacrolimus:WO,2007039816[P].2007-04-12
[7]Yoon Y J,Choi C Y.Nutrient effects on FK-506,a new immunosuppressant,production by Streptomyces sp.in a defined medium[J].Journal of Fermentation and Bioengineering,1997,83(6):599-603
[8]Kim H S,Park Y I.Lipase activity and tacrolimus production in Streptomyces clavuligerus CKD 1119 mutant strains[J].Journal of Microbiology and Biotechnology,2007,17(10):1 638-1 644
[9]Singh B P,Behera B K.Regulation of tacrolimus production by altering primary source of carbons and amino acids[J].Letters in Applied Microbiology,2009,49(2):254-259
[10]Jung S,Moon S,Lee K,et al.Strain development of Streptomyces sp.for tacrolimus production using sequential adaptation[J].Journal of Industrial Microbiology and Biotechnology,2009,36(12):1 467-1 471
[11]李玲,陈林,杨文革,等.一株他克莫司产生菌的筛选及鉴定[J].食品与生物技术学报,2010,29(3):416-420 Li Ling,Chen Lin,Yang Wenge,et al.Isolation and identification of a Tacrol imus producing strain[J].Journal of Food Science and Biotechnology,2010,29(3):416-420(in Chinese)
[12]王秀琴,王晓蕾,蒋沁.复合诱变法筛选 FK506高产菌株[J].河北化工,2010,33(3):30-31 Wang Xiuqin,Wang Xiaolei.Screening of high FK 506-producing strain by combined mutation [J].Hebei Chem ical Engineering and Industry,2010,33(3):30-31(in Chinese)
[13]郑军荣,乐占线,魏元刚,等.他克莫司高产菌株的理性化选育[J].中国抗生素杂志,2011,36(10):745-750 Zheng Junrong,Le Zhanxian,Wei Yuangang,et al.Rational screening for high production tacrolimus-producing strain[J].Chinese Journal of Antibiotics,2011,36(10):745-750(in Chinese)
[14]刘忠.他克莫司发酵条件的研究[J].齐鲁药事,2008,27(10):687-689 Liu Zhong.Studies on fermentation condition of Tacrolimus[J].Qilu Pharmaceutical Affairs,2008,27(10):687-689(in Chinese)
[15]Chen D,Zhang Q,Zhang Q,et al.Improvement of FK506 production in Streptomyces tsukubaensis by genetic enhancement of the supply of unusual polyketide extender units via utilization of two distinct site-specific recombination systems[J].Applied and Environmental M icrobiology,2012,78(15):5 093-5 103
[16]Mo S,Kim D H,Lee JH,et al.Biosynthesis of the allylmalonyl-CoA extender unit for the FK506 polyketide synthase proceeds through a dedicated polyketide synthase and facilitates the mutasynthesis of analogues[J].Journal of the American Chemical Society,2011,133(4):976-985
[17]Gatto JG,Mcloughlin SM,Kelleher N L,et al.Elucidating the substrate specificity and condensation domain activity of FkbP,the FK520 pipecolate-incorporating enzyme[J].Biochemistry,2005,44(16):5 993-6 002
[18]Andexer JN,Kenderw SG,Nur-E-Alam M,et al.Biosynthesis of the immunosuppressants FK506,FK520,and rapamycin involves a previously undescribed fam ily of enzymes acting on chorismate[J].Proceedings of the National Academy of Sciences of the United States of A-merica,2011,108(12):1 776-4 781
[19]Mo S,Yoo Y J,Ban Y H,et al.Roles of fkbN in positive regulation and tcs7 in negative regulation of FK506 biosynthesis in Streptomyces sp.strain KCTC 11604BP[J].Applied and Environmental M icrobiology,2012,78(7):2 249-2 255
[20]Mo S,Ban Y H,Park JW,et al.Enhanced FK506 production in Streptomyces clavuligerus CKD1119 by engineering the supply of methylmalonyl-CoA precursor[J].Journal of Industrial M icrobiology and Biotechnology,2009,36(12):1 473-1 482
[21]Notebaart R A,Van Enckevort F H,Francke C,et al.Accelerating the reconstruction of genome-scale metabolic networks[J].BMC Bioinformatics,2006,7:296-296
[22]Feist A M,Palsson BØ.The growing scope of applications of genome-scale metabolic reconstructions using Escherichia coli[J].Nature Biotechnology,2008,26(6):659-667
[23]Pál C,Papp B,Lercher M J,et al.Chance and necessity in the evolution of minimalmetabolic networks[J].Nature,2006,440(7 084):667-670
[24]Soh K C,Hatzimanikatis V.Dreams ofmetabolism[J].Trends in Biotechnology,2010,28(10):501-508

