烯酰吗啉在人参和土壤中的残留动态及膳食风险评估
王 燕,王春伟,,高 洁,*,崔丽丽
(1.吉林农业大学农学院,吉林 长春 130118;2.中国农业科学院特产研究所,吉林 长春 130112)
烯酰吗啉即4-[3-(4-氯苯基)-3-(3,4-二甲氧基苯基)丙烯酰]吗啉,是一种肉桂酸衍生物,为专一杀卵菌纲真菌杀菌剂,其作用机制是破坏病菌细胞壁膜的形成,引起孢子囊壁的分解使病菌死亡,可用于防治多种作物霜霉属和疫霉属病菌引起的病害[1-2]。人参疫病是由卵菌门疫霉属恶疫霉菌(Phytophthora cactorum)侵染所致[3],该病在人参产区分布广泛,是人参生育期内最严重的病害之一,可发生多次再侵染,严重时发病率可达70%以上,造成参苗大面积受害死亡[4]。目前烯酰吗啉已广泛用于人参疫病的防治,且与甲霜灵、苯霜灵等苯基酰胺类杀菌剂无交互抗性[5]。
近年来,欧盟、美国、日本等国家和地区相继制定了越来越严格的食品安全法规和农药残留限量标准,农药残留问题已成为我国包括人参在内的众多农产品出口受阻的主要原因。烯酰吗啉残留量的检测方法主要有气相色谱法[2,6-8]、液相色谱法[9]、气相色谱-质谱法[10-13]、液相色谱-质谱法[14-17]等,而采用高效液相色谱-质谱法测定人参中烯酰吗啉的残留动态及最终残留量,并对其可能产生的膳食安全风险进行评估,国内外未见报道。
人参基质成分复杂,包括多种皂甙、有机酸、多糖等,若采用传统色谱分析手段,其样品净化困难,在检测过程中易产生假阳性。高效液相色谱-质谱(high performance liquid chromatography coupled with tandem mass spectrometry,HPLC-MS-MS)是以质谱仪为检测手段,集高效液相色谱高分离能力与质谱高灵敏度和高选择性于一体的分离分析方法,具有灵敏度高、广谱性强、抗干扰好等优点,可利用色谱保留时间和质谱特征离子对及其相对丰度比等多重因素进行准确定性,与传统的色谱分析方法相比,定量测定结果更加准确、阳性结果确证更加可靠。本实验根据人参样品基质的特性,对提取、净化等前处理步骤进行了优化,建立了人参根、茎、叶和土壤中烯酰吗啉的高效液相色谱-质谱检测方法,研究烯酰吗啉在人参根、茎、叶及土壤中的消解动态及最终残留量,并对其可能产生的膳食安全风险进行评估,为烯酰吗啉在人参上的安全合理使用提供依据。
1 材料与方法
1.1 材料与试剂
供试农药:质量分数80%的烯酰吗啉水分散粒剂陕西标正作物科学有限公司;供试作物:4 年生人参,品种为大马牙,试验地点:吉林省抚松县兴参镇榆树村人参种植基地和集安市榆林镇大地参业人参种植基地。
甲苯、丙酮、乙腈(优级纯) 美国Tedia公司;甲酸(色谱纯) 天津科密欧化学试剂有限公司;烯酰吗啉标准物质(纯度为99.0%) 国家标准物质信息中心;ProElut人参农药残留(ginseng pesticides residue,GPR,粒径1.5 g/12 mL)固相萃取柱 北京Dikma公司。
1.2 仪器与设备
API 4000三重四极杆液质联用仪 美国AB公司;1200高效液相色谱仪 美国Agilent公司;Kromasil Eternity-5-C18色谱柱 瑞典Akzo Nobel公司;R-210旋转蒸发仪 瑞士Büchi公司;X-22R离心机(10 000 r/min)美国Beckman Coulter有限公司;Vortex.Genie 2涡旋混匀器 德国IKA公司;LC51-GM200刀式混合碾磨仪(10 000 r/min) 德国Retsch公司;Milli-QA10超纯水器 美国Millipore公司。
1.3 方法
1.3.1 田间试验设计
消解动态试验共设高剂量和不施药空白对照2个处理,3次重复,小区面积为15 m2。施药时期为人参展叶后期,2012年7月31日。施药剂量为800 g a.i./hm2。施药后0(施药后2 h之内)、1、3、7、14、21、28 d和35 d分别采集人参根、茎、叶及土壤样品,每小区按对角线取5 点,土壤样品取土深度为0~10 cm。
最终残留实验共设低剂量、高剂量和不施药空白对照3个处理,施药剂量分别为800 g a.i./hm2和533.33 g a.i./hm2,设3次重复,小区面积为15 m2,在施药后28、35 d和60 d采集人参根、茎、叶和土壤样品,每小区按对角线取5 点,土壤样品取土深度为0~15 cm。
采样方法:每小区按对角线取5 点,土壤样品取土深度为0~10 cm,四分法留样。同期采集空白样品,标签标记后于-20℃条件下保存待测[18]。
1.3.2 样品前处理
样品的制备:称取鲜人参根、茎、叶样品各100 g,依次用混合碾磨仪将样品粉碎后,于-20℃保存备用。取土壤样品不少于200 g,过0.25 mm孔径筛,混匀,于-20℃保存备用。
提取:分别准确称取5 g人参根、茎、叶及土壤样品置于50 mL离心管中,加入20 mL丙酮后用涡旋混匀器混合1 min,8 000 r/min离心5 min,取上清液,再向离心管中加入20 mL丙酮,重复提取一次,合并上清液于35℃条件下旋转蒸发至近干,加入乙腈-甲苯(3∶1,V/V)5 mL溶解,待净化。
净化:10 mL乙腈-甲苯(3∶1,V/V)预淋洗GPR固相萃取柱,流出液弃去。将5 mL样品提取溶解液倾入GPR固相萃取柱中,用20 mL乙腈-甲苯(3∶1,V/V)进行洗脱。收集全部洗脱液于鸡心瓶中,于35℃水浴中旋转浓缩至近干。用乙腈溶解,并定容至1 mL,经0.22 μm滤膜过滤后供LC-MS-MS测定。
1.3.3 仪器条件
色谱柱:Kromasil Eternity-5-C18柱(2.1 mm×150 mm,0.5 µm);流动相:V(乙腈)∶V(水)∶V(甲酸)=90.00∶9.99∶0.01;流速250 µL/min;柱温度40℃;进样量10 μL。
电离方式为电喷雾电离(electron spray ionization,ESI)源;电喷雾电压5 500 V;雾化气压力0.483 MPa;气帘气压力0.138 MPa;辅助加热气压力0.379 MPa;离子源温度725℃;扫描方式为正离子扫描;检测方式为多反应监测。
1.3.4 标准曲线制作
准确称取烯酰吗啉标准品,置于100.0 mL容量瓶中,用丙酮配制成质量浓度100 μg/mL的标准储备液,用人参空白基质液稀释、定容,配制成质量浓度为0.001、0.005、0.01、0.05、0.10 µg/mL的标准溶液,以质量浓度为横坐标(x),峰面积为纵坐标(y),建立标准曲线,得线性回归方程和相关系数。
1.3.5 烯酰吗啉在人参中的膳食风险评估
依照所建立的方法对人参样品中烯酰吗啉的残留量进行检测,其膳食风险评估结果分别由公式(1)和(2)[19]计算得出:

杨大进等[20]经调查得出我国60 kg体质量成人的中药材保健食品每日摄入量约为0.000 57 kg,烯酰吗啉每日允许摄入量(acceptable daily intake,ADI)值为0.20 mg/kg bw[21],理论残留量以2地实验高剂量下人参根中最终残留量的平均值计,以人均体质量60 kg计,计算烯酰吗啉在人参上的估计暴露量和风险商值。
当风险商值大于1时,表示存在不可接受的风险,数值越大,风险越大;风险商值小于1时,表示风险为可以接受,数值越小,风险越小[19]。
2 结果与分析
2.1 提取条件的选择
本研究采用极性较强的有机溶剂提取,以丙酮、乙腈、甲醇作为提取溶剂进行选择实验。其中,甲醇做提取剂时,乳化现象严重,8 000 r/min 离心10 min仍不能消除乳化现象,因此重点考察了丙酮和乙腈的提取效果。研究发现,2种提取溶剂中,丙酮提取效率为92.0%,乙腈为81.5%,丙酮对烯酰吗啉的提取效率明显高于乙腈,故用丙酮提取。
2.2 净化条件的选择
采用目前残留检测中应用最广泛的固相萃取(solid phase extraction,SPE)法。SPE法所需样品量少,避免了乳化现象,且回收率高、重复性好。实验过程中选择GPR固相萃取柱,乙二胺-N-丙基硅烷(primary secondary amine,PSA)固相萃取柱,活性碳固相萃取柱,弗罗里硅土柱和十八烷基硅烷键合相(C18)固相萃取柱进行净化。结果表明,烯酰吗啉采用GPR固相萃取柱净化效果最好(表1)。

表1 不同SPE柱中的烯酰吗啉回收率Table1 Effects of different solid phase extraction cartridges on the recovery of dimethomorph
2.3 洗脱溶剂体积的选择
洗脱溶剂体积直接影响目标分析物能否被洗脱下来。图1为乙腈-甲苯(3∶1,V/V)洗脱的洗脱曲线图,从洗脱曲线可知:烯酰吗啉在GPR固相萃取柱上在0~18 mL时流出。因此,本方法确定收集20 mL洗脱液则可最大程度地除去基质干扰物的同时保证农药组分的回收率符合农药残留检测的要求。

图1 乙腈-甲苯洗脱曲线图Fig.1 Cumulative recovery of dimethomorph eluted by acetonitrile/methylbenzene
2.4 色谱条件的优化
同一样品在不同填料的色谱柱上分离效果不同,通过对安捷伦公司、迪马公司、沃特斯等公司生产的不同型号的C18色谱柱进行对比,最终选择瑞典AKZO NOBEL公司生产的Kromasil Eternity-5-C18色谱柱。Kromasil是一种高纯度球形硅胶填料,含碳量高,表面极性小,分离效能高,能有效降低金属螯合物在硅胶基质上的络合效应,具有重复性好,适用性广,使用寿命长的特点。另外,流动相的组成不仅会影响到目标化合物的保留时间和峰形,还会影响到离子化效率,从而影响灵敏度。选择流动相为乙腈-水或甲醇-水进行比较,实验发现,以乙腈和水为流动相各信号响应强度优于甲醇,所以选用乙腈和水来做为流动相。甲酸的加入利于目标物的质子化,因而可以提高灵敏度,但过量甲酸的加入则会反过来抑制目标物的质子化,进而降低灵敏度。实验优化了甲酸的加入量,结果表明,流动相为V(乙腈)∶V(水)∶V(甲酸)=90.00∶9.99∶0.01时效果最好,色谱峰对称尖锐,峰形良好。
2.5 质谱条件的优化
采用流动注射泵连续进样方式进行质谱条件的优化,在ESI正离子模式下进行全扫描,确定母离子后,优化去簇电压,再进行子离子扫描,同时优化碰撞气能量,根据欧盟2002/657/EC指令对残留确认方法的要求,对于高效液相色谱-质谱,至少需要一个母离子和两个子离子才能定性确证。选择离子丰度较强、干扰较小的两个子离子,进行多反应监测(multiple reaction monitoring,MRM),并对质谱参数进行优化(表2)。

表2 质谱优化参数Table2 Optimized MS parameters
2.6 样品基质效应的消除
电喷雾离子源易受样品基质影响,样品基质对离子化可能存在抑制作用。为消除样品基质效应,本研究分别以人参根、茎、叶及土壤的空白样品提取液配制不同质量浓度的标准溶液,用来定量测定人参根、茎、叶和土壤中烯酰吗啉残留量,以保证标准溶液和样品溶液具有同样的离子化条件,从而消除样品基质效应。
2.7 线性范围及最低检出限
烯酰吗啉在0.001~0.10 µg/mL质量浓度范围内,以质量浓度为横坐标(x),峰面积为纵坐标(y),得到线性方程为y=3.05×103x+1.05×104,R2=0.999 9。在所设定的仪器条件下,以3倍信噪比(RSN=3)计算检出限,烯酰吗啉的最低检出限为0.001 mg/kg。
2.8 添加回收率测定

表3 烯酰吗啉的添加回收率(n=10)Table3 Recoveries of dimethomorph (n= 10)
在0.01~0.20 mg/kg添加范围内,烯酰吗啉在人参根、茎、叶及土壤中的添加回收率分别82.4%~95.5%、82.0%~95.1%、88.1%~91.3%、87.1%~93.4%,相对标准偏差分别为5.01%~7.66%、5.05%~6.18%、5.85%~7.67%、5.39%~6.26%,结果见表3,符合残留实验要求。烯酰吗啉标准品MRM色谱图(0.01 mg/kg),人参空白样品MRM色谱图和人参添加样品MRM色谱图(0.01 mg/kg)分别见图2~4。

图2 烯酰吗啉标准品MRM色谱图(0.01 mg/kg)Fig.2 MRM chromatogram of dimethomorph standard (0.01 mg/kg)

图3 人参空白样品MRM色谱图Fig.3 MRM chromatogram of ginseng blank samples

图4 人参添加样品MRM色谱图(0.01 mg/kg)Fig.4 MRM chromatogram of spiked ginseng sample (0.01 mg/kg)
2.9 残留动态实验
由表4可知,通过在集安市和抚松县两地进行的残留动态实验,质量分数80%的烯酰吗啉水分散粒剂在人参根、茎、叶和土壤中的降解动态符合一级反应动力学方程Ct=C0e-Kt。式中:Ct为施药后间隔时间t时农药质量分数;C0为施药后的原始沉积量;K为降解速率常数;t为施药后的时间。由此可求出降解半衰期t1/2=ln2·K-1。烯酰吗啉的原始沉积量从大到小依次为叶>茎>土壤>根,在人参的根、茎、叶及土壤中的半衰期均在9.13~16.35 d之间,半衰期较短,属于易降解农药(t1/2<30 d)。
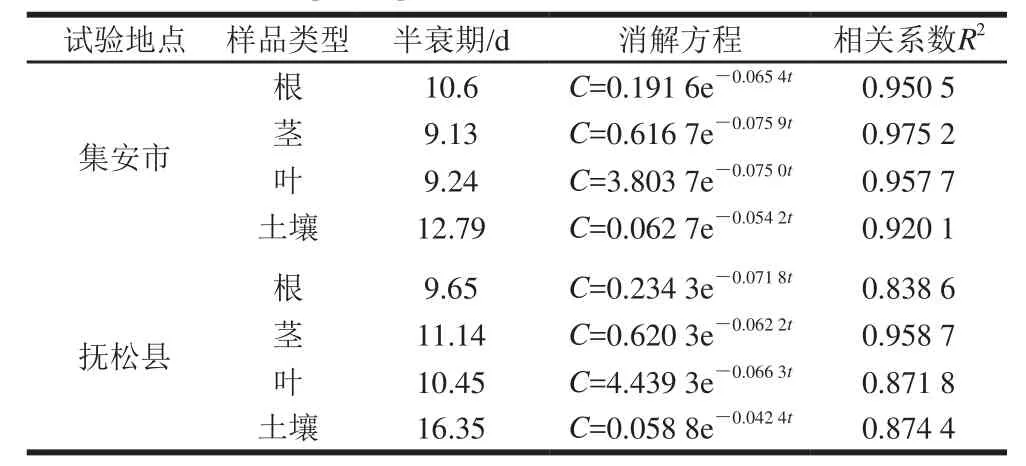
表4 烯酰吗啉在人参根、茎、叶和土壤中消解动力学参数Table4 Kinetic degradation parameters of dimethomorph in ginseng root, stem, leaf and soil
2.10 最终残留实验

表5 烯酰吗啉在人参根、茎、叶及土壤中的最终残留Table5 Final residues of dimethomorph in ginseng root, stem, leaf and soil mg/kg
由表5可知,通过在集安市和抚松县两地进行的最终残留实验,施药后28、35、60 d烯酰吗啉在人参根、茎、叶和土壤中的残留量分别为未检出~0.024 5、0.023 3~0.138 7、0.121 5~0.618 2 mg/kg和0.008 4~0.073 8 mg/kg。
2.11 烯酰吗啉在人参中的膳食风险评估
质量分数80%的烯酰吗啉水分散粒剂在人参中估计暴露量为7.13×10-8mg/kg,风险商值为3.56×10-7(远小于1),在施药剂量为533.33~800 g a.i./hm2,在一个生长季节施用1次,膳食风险较低,对消费者安全。
3 结 论
本研究建立了人参根、茎、叶及土壤中烯酰吗啉的高效液相色谱-质谱检测方法。该方法操作简便、快捷,具有较好的精密度、灵敏度、准确度,完全满足农药残留检测要求。残留动态实验结果表明:烯酰吗啉在人参根、茎、叶和土壤中的降解半衰期为9.13~16.35 d,属于易降解农药(t1/2<30 d)。
我国尚未制定烯酰吗啉在人参中的最大残留限量标准,欧盟规定烯酰吗啉在人参上的最大残留限量值为0.05 mg/kg[22],韩国规定烯酰吗啉在鲜人参和干人参中的最大残留限量值分别为3.00 mg/kg和15.00 mg/kg[23],我国规定烯酰吗啉在蔬菜和水果中的最大残留限量值为0.05~5.00 mg/kg[20]。参照以上残留限量规定及残留实验数据,建议质量分数80%的烯酰吗啉水分散粒剂在人参上的最大残留限量值可暂定为0.05 mg/kg,安全间隔期为28 d。质量分数80%的烯酰吗啉水分散粒剂在人参生长期施药1次,施药量为800 g a.i./hm2时,风险商值为3.56×10-7(远小于1),膳食风险较低,人参在收获后入药及食用是安全的。
[1]刘君丽, 陈亮, 孟玲.疫霉病害的发生与化学防治研究进展[J].农药,2003, 42(4): 13-16.
[2]王岩, 姚威风, 梁爽, 等.甘蓝和土壤中吡唑醚菌酯·烯酰吗啉残留分析[J].农药, 2011, 50(1): 46-47; 57.
[3]赵曰丰, 吴连举, 杨依军, 等.人参疫菌病原菌的研究[J].植物病理学报, 1993, 23(10): 260.
[4]李玉.植物病理学[M].长春: 吉林科学技术出版社, 1992: 115.
[5]崔淑华, 王开运, 钱家亮, 等.烯酰吗啉在大葱中的残留消解动态[J].农药, 2010, 49(1): 47-52.
[6]徐伟松, 李畅方, 何强, 等.烯酰吗啉在黄瓜和土壤中的残留量及消解动态研究[J].农药科学与管理, 2008, 29(3): 15-18.
[7]范东升.烯酰吗啉在葡萄上的残留及消解动态[J].农药, 2009, 48(9):35-38.
[8]LIANG Hongwu, LI Li, LI Wei, et al.Dissipation and residue of dimethomorph in pepper and soil under field conditions[J].Ecotoxicology and Environmental Safety, 2011, 74(5): 1331-1335.
[9]李二虎, 胡敏, 吴兵兵, 等.高效液相色谱法测定黄瓜中烯酰吗啉和腈菌唑农药残留[J].现代农药, 2007, 6(4): 38-40.
[10]宋国春, 于建垒, 李瑞娟, 等.烯酰吗啉在黄瓜中的残留消解动态[J].中国蔬菜, 2006(11): 23-24.
[11]HENGEL M J, SHIBAMOTO T.Gas chromatographic-mass spectrometric method for the analysis of dimethomorph fungicide in dried hops[J].Journal of Agricultural and Food Chemistry, 2000,48(12): 5824-5828.
[12]ČUŠ F, ČESNIK H B, BOLTA Š V, et al.Pesticide residues in grapes and during vinification process[J].Food Control, 2010, 21(11): 1512-1518.
[13]DALVIE M A, SOSAN M B, AFRICA A, et al.Environmental monitoring of pesticide residues from farms at a neighbouring primary and pre-school in the western cape in south Africa[J].Science of the Total Environment, 2014, 466/467: 1078-1084.
[14]LIU Congyun, WAN Kai, HUANG Jianxiang, et al.Behavior of mixed formulation of metalaxyl and dimethomorph in grape and soil under field conditions[J].Ecotoxicology and Environmental Safety, 2012,84(1): 112-116.
[15]ARIENZO M, CATALDO D, FERRARA L, et al.Pesticide residues in fresh-cut vegetables from integrated pest management by ultra performance liquid chromatography coupled to tandem mass spectrometry[J].Food Control, 2013, 31(1): 108-115.
[16]MAYER-HELM B, HOFBAUER L, MULLER J.Method development for the determination of selected pesticides on tobacco by high-performance liquid chromatography-electrospray ionisationtandem mass spectrometry[J].Talanta, 2008, 15(5): 1184-1190.
[17]HASHI M, KITAGAWA Y, AKUTSU K, et al.Determination of seventeen pesticide residues in agricultural products by LC/MS[J].Journal of the Food Hygienic Society of Japan, 2002, 43(6): 389-393.
[18]刘光学.NY/T 788—2004 农药残留试验准则[S].北京: 中国农业出版社, 2004.
[19]中国农业科学院农业质量标准与检测技术研究所.农产品质量安全风险评估: 原理、方法和应用[M].北京:人民卫生出版社, 2008:232-233.
[20]杨大进, 王竹天, 宋书锋, 等.中药材类保健食品中添加剂限量标准研制[J].中国公共卫生, 2008, 24(3): 358-359.
[21]卫生部, 农业部.GB 2763—2012 食品安全国家标准食品中农药最大残留限量[S].北京: 中国标准出版社, 2012.
[22]European Commission.Pesticide EU-MRLs regulation (EC) No.396/2005[EB/OL].Brussels: European Commission, 2005.http://ec.europa.eu/food/plant/ pesticides/ max_residue_levels/eu_rules_en.htm.
[23]Ministry of Food and Drug Safety.MRLs for pesticides in foods:history of establishment of pesticide MRLs in Korea[EB/OL].Seoul:Ministry of Food and Drug Safety, 2012.http://www.kfda.go.kr/cgibin/t4.cgi/ eng/english_12.taf.

