乌龙茶多糖的聚酰胺柱层析法纯化工艺
张 芸,倪德江,余 志,谢笔钧*
(1.华中农业大学食品科技学院,湖北 武汉 430070;2.湖北经济学院旅游与酒店管理学院,湖北 武汉 430205;3.华中农业大学园艺林学学院,园艺植物生物学教育部重点实验室,湖北 武汉 430070)
茶多糖(tea polysaccharides,TPS)是茶叶中的主要活性成分之一,具有降血糖、降血脂及增强免疫等多种活性,对其提取纯化、活性和结构进行了广泛的研究[1-7]。TPS通常采用水提醇沉法[8]提取粗品,在此过程中,部分有色物质和蛋白质会随多糖一并沉淀下来,使得到的TPS粗品呈褐色并含有一定量的蛋白质,从而影响TPS的纯度,干扰TPS的定量[9]、结构鉴定与活性研究,因此需要对其进行脱色脱蛋白处理。TPS多采用H2O2氧化脱色[10-11],但这样容易使多糖氧化分解,从而破坏多糖的结构,并可能破坏多糖的活性,且存在安全性问题;脱蛋白常采用Sevag法[12-13],但是效率不高,操作繁琐,且需要使用大量的有机溶剂[14-15],这不仅污染环境,而且有机溶剂的残留也会带来安全性问题。TPS的脱色脱蛋白方法目前有少量研究,但多集中在绿茶多糖[15-18],而乌龙茶因在加工过程中需进行半发酵,部分多酚氧化成为有色的多酚氧化物,使得乌龙茶多糖(oolong tea polysaccharides,OTPS)颜色更深,脱色难度更大,其脱色脱蛋白方法的对比研究还鲜有报道。聚酰胺是由酰胺聚合而成的一类高分子化合物,对酚类等富含酚羟基的化合物具有较强的吸附性[19-20],也能吸附蛋白质,因此对TPS具有同时脱色和脱蛋白的效果[18]。为此,本研究着重研究了OTPS聚酰胺柱层析的洗脱条件,建立了OTPS聚酰胺脱色脱蛋白的工艺,并与Sevag-H2O2联用法对比,比较其脱色、脱蛋白效果及纯化后产品的抗氧化活性,聚酰胺柱层析法是一种目前理想的OTPS脱色脱蛋白的方法,可为OTPS的纯化技术提供参考依据。
1 材料与方法
1.1 材料与试剂
茶树品种为大叶乌龙,夏季按一芽三四叶的标准采于湖北省农业科学院果树茶叶研究所。
聚酰胺(粒径:50~160 μm;容重0.25 g/mL) 瑞士Fluka公司;SOD试剂盒 南京建成生物工程研究所;其他化学试剂均为国产分析纯。
1.2 仪器与设备
MODEL-3型旋转蒸发器 上海亚荣科学仪器厂;LD5-10型离心机 北京医用离心机厂;ALPHAL-2冻干机 德国Matin Christ公司;D100B恒流泵、BSZ-160分部收集器 上海青浦沪西仪器厂;HD-21-1型核酸蛋白质检测器 上海嘉鹏科技有限公司;LM-17型记录仪永清示波器厂;722型分光光度计 上海实验科学仪器有限公司。
1.3 方法
1.3.1 乌龙茶制作工艺及OTPS制备
鲜叶原料→晒青→摊放→摇青→静置→二次摇青→静置→三次摇青→静置→杀青→揉捻→干燥
乌龙茶经过水提醇沉、冻干后得OTPS。OTPS中中性糖含量为26.72%、糖醛酸含量为18.98%、蛋白质含量为7.34%、茶多酚含量为4.23%。
1.3.2 OTPS聚酰胺柱层析洗脱条件的研究
称取一定质量的OTPS,用去离子水配成质量浓度10 mg/mL的溶液,离心去除不溶物后作为OTPS原液备用。
选用Ф 20 mm×150 mm的层析柱,填入20 mL处理好的聚酰胺,3倍柱体积去离子水平衡后,上样,吸附平衡,去离子水洗脱,收集含糖管。以脱色率、脱蛋白率和总糖保留率为评价指标,从上样量、上样体积、吸附平衡时间以及洗脱速率4个方面确定聚酰胺柱层析的洗脱条件。
1.3.2.1 最佳上样量的确定
取5份OTPS原液,通过稀释使多糖溶液的上样量分别为20、40、60、80、100 mg,上样体积为10 mL,吸附平衡30 min,3 mL/min速率洗脱。
1.3.2.2 最佳上样体积的确定
取3份OTPS原液,上样量为80 mg,通过稀释使多糖的上样体积分别为8、10、12 mL,吸附平衡30 min,3 mL/min速率洗脱。
1.3.2.3 最佳吸附平衡时间的确定
取5份OTPS原液,上样量为80 mg,上样体积为10 mL,分别吸附平衡5、10、20、30、60 min,3 mL/min速率洗脱。
1.3.2.4 最佳洗脱速率的确定
取5份OTPS原液,上样量为80 mg,上样体积为10 mL,吸附平衡30 min,分别以1.5、3、4.5、6、9 mL/min的速率洗脱。

式中:下标1为上样液,2为收集液;V为溶液体积;M为总糖质量,采用苯酚-硫酸法[21]测定。
1.3.3 OTPS不同脱色脱蛋白方法的比较
称取一定量的OTPS,用去离子水配成质量浓度10 mg/mL的溶液,离心去除不溶物后作为OTPS原液,记作Y。取一定量OTPS原液分别采用聚酰胺柱层析法、Sevag法、H2O2法及Sevag-H2O2联用法处理,所得产品分别记作P、S、H及SH。测定各个产品的色度和中性糖、糖醛酸、蛋白质、茶多酚含量,计算脱色率、脱蛋白率和总糖(中性糖和糖醛酸总和)保留率。将原液和各方法处理后的产品冷冻干燥后,计算得率,并测定抗氧化活性。
1)聚酰胺柱层析法:取处理好的聚酰胺200 mL,装入Ф 36 mm×300 mm的层析柱中,3倍柱体积去离子水平衡后,加入10 mg/mL OTPS原液80 mL,吸附平衡20 min,以3 mL/min的流速用去离子水洗脱,收集含糖管。2)Sevag法:80 mL OTPS原液中加入1/5 体积的氯仿和1/25 体积的正丁醇,剧烈振摇20 min,离心,弃去蛋白质和氯仿层,重复处理8次,透析(自来水48 h,蒸馏水24 h)[22]。3)H2O2法:80 mL OTPS原液或Sevag法脱蛋白后的多糖溶液用氨水调pH 8.0左右,50℃条件下加入体积分数30%的H2O280 mL,保温2 h,用HCl溶液调至中性,透析(自来水48 h,蒸馏水24 h)[22]。
色度:以450 nm波长处吸光度表示[18];中性糖含量:硫酸-蒽酮比色法[23];糖醛酸含量:硫酸-咔唑法[24];蛋白质含量:考马斯亮蓝G-250法[23];茶多酚含量:酒石酸亚铁比色法[23];对羟自由基的清除率:将TPS溶液配成5 mg/mL质量浓度,采用D-脱氧核糖-Fe体系法评价[22];对超氧阴离子自由基的清除率:将TPS溶液配成1 mg/mL质量浓度,采用黄嘌呤氧化酶法评价[25]。
1.3.4 数据处理
2 结果与分析
2.1 OTPS聚酰胺柱层析洗脱条件的研究
2.1.1 上样量的影响

图1 上样量对OTPS脱色率、脱蛋白率和总糖保留率的影响Fig.1 Effect of OTPS concentration on the decoloration rate,deproteinization rate and polysaccharide retention rate
由图1可知,当上样体积为10 mL,吸附平衡30 min,3 mL/min速率洗脱时,随着上样量的增加,脱色率和脱蛋白率下降,总糖保留率增加。综合考虑脱色率、脱蛋白率、总糖保留率,以及聚酰胺柱层析的处理量,相对20 mL聚酰胺,选择80 mg OTPS的上样量,即4 mg OTPS/mL聚酰胺。
2.1.2 上样体积的影响
当OTPS上样量一定时,上样体积过小,会导致溶液浓度过高,溶解度低且黏度大,流动性差;上样体积过大,则会导致直接泄漏。因此当聚酰胺用量为20 mL,上样量为80 mg时,仅比较了8、10、12 mL 3个上样体积时OTPS的脱色率、脱蛋白率和总糖保留率。由图2可知,随着上样体积的增加,脱色率和脱蛋白率下降,总糖保留率增加,但总糖保留率的增加幅度相比脱色率和脱蛋白率的降低幅度要小。同时,上样体积越小,含糖管相对更集中,拖尾少。因此,选择8 mL的上样体积,即2/5倍的聚酰胺柱体积。

图2 上样体积对OTPS脱色率、脱蛋白率和总糖保留率的影响Fig.2 Effect of OTPS volume on the decoloration rate, deproteinization rate and polysaccharide retention rate
2.1.3 吸附平衡时间的影响
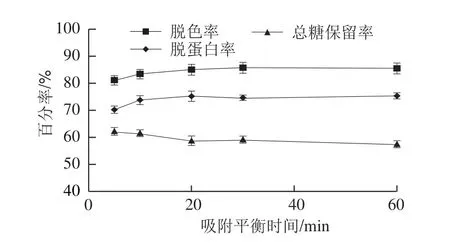
图3 吸附平衡时间对OTPS脱色率、脱蛋白率和总糖保留率的影响Fig.3 Effect of adsorption equilibrium time on the decoloration rate,deproteinization rate and polysaccharide retention rate
由图3可知,吸附平衡20 min以内时,随着时间的延长,脱色率和脱蛋白率上升,总糖保留率下降;但超过20 min后,脱色率、脱蛋白率和总糖保留率的变化都不大。因此,选择上样后吸附平衡20 min。
2.1.4 洗脱速率的影响

图4 洗脱速率对OTPS脱色率、脱蛋白率和总糖保留率的影响Fig.4 Effect of elution velocity on the decoloration rate,deproteinization rate and polysaccharide retention rate
由图4可知,随着洗脱速率的增加,脱色率和脱蛋白率下降,总糖保留率增加。综合考虑脱色率、脱蛋白率和总糖保留率的大小和变化幅度,以及洗脱效率,选择以3 mL/min的速率洗脱。
2.2 OTPS不同脱色脱蛋白方法的比较

表1 OTPS不同脱色脱蛋白方法的效果Table1 Comparison of decoloration and deproteinization methods for OTPS%
由表1可以看出,聚酰胺柱层析法的脱色率显著高于H2O2脱色法,脱蛋白率和Sevag法没有显著性差异。与传统的Sevag-H2O2联用法相比,聚酰胺柱层析法的脱色率和脱蛋白率都要略低一些,这是因为H2O2在脱色的同时可以脱除一定量的蛋白质,Sevag法在脱蛋白的同时也有一定的脱色效果。聚酰胺柱层析法的总糖保留率和产品得率要显著高于Sevag-H2O2联用法,这可能是由于部分蛋白质与茶多糖缀合在一起,采用Sevag法脱蛋白会脱去这部分糖蛋白缀合物,而多糖脱蛋白的目的并非要彻底的除去蛋白,而是脱除游离蛋白质。另外,聚酰胺柱层析法和Sevag-H2O2联用法均能将OTPS中的茶多酚含量由4.12%降到1%以下,也能同时起到除去OTPS粗品中其他杂质的作用。从环境保护和安全的角度考虑,无论是传统的Sevag-H2O2联用法,还是单独的Sevag法和H2O2法,都会带来不同程度的环境污染和安全性问题,而聚酰胺柱层析法则是符合绿色提取工艺,同时也保证了安全性。

表2 脱色脱蛋白前后OTPS对羟自由基和超氧阴离子自由基的清除率Table2 Scavenging capacity of crude and purified OTPS on hydroxyl radical and superoxide anion radical%
由表2可以看出,聚酰胺柱层析法和Sevag-H2O2联用法脱色脱蛋白后产品对羟自由基的清除率显著低于未脱色脱蛋白之前的OTPS,但降低幅度不大,且这两种方法所得产品之间无显著性差异;聚酰胺柱层析法脱色脱蛋白后产品对超氧阴离子自由基的清除率显著高于未脱色脱蛋白之前的OTPS,而Sevag法、H2O2法及Sevag-H2O2联用法脱色脱蛋白后产品对超氧阴离子自由基的清除率均显著低于未脱色脱蛋白之前的OTPS,这说明Sevag法和H2O2法均会破坏茶多糖的抗氧化活性。
3 结 论
选择合适的脱色脱蛋白方法对多糖的研究至关重要。本研究对OTPS聚酰胺柱层析条件进行了优化,确定了聚酰胺层析的最佳条件为:4 mg OTPS/mL聚酰胺,2/5倍柱体积去离子水溶解上样,吸附平衡20 min,3 mL/min速率洗脱。
在此基础上,将聚酰胺柱层析法和传统的Sevag-H2O2联用法对OTPS脱色脱蛋白,综合对比脱色率、脱蛋白率、总糖保留率、产品得率和抗氧化效果,表明聚酰胺柱层析法脱色率、脱蛋白率虽略低于Sevag-H2O2联用法,但总糖保留率和产品得率高,尤其是能很好地保留并提高OTPS的抗氧化活性,是一种较好的OTPS脱色脱蛋白方法,而且也是符合绿色化学提取要求的。
[1]NIE Shaoping, XIE Mingyong.A review on the isolation and structure of tea polysaccharides and their bioactivities[J].Food Hydrocolloids,2011, 25(2): 144-149.
[2]余志, 石玉涛.茶多糖研究的新进展[J].广东茶业, 2009(6): 25-29.
[3]崔宏春, 江和源, 张建勇, 等.茶多糖的结构研究进展[J].安徽农业科学, 2009, 37(1): 200-203.
[4]GUO Li, LIANG Qin, DU Xianfeng.Effects of molecular characteristics of tea polysaccharide in green tea on glass transitions of potato amylose, amylopectin and their mixtures[J].Food Hydrocolloids, 2011, 25(3): 486-494.
[5]CHEN Xiaoqiang, WANG Yuefei, WU Yalin, et al.Green tea polysaccharide-conjugates protect human umbilical vein endothelial cells against impairments triggered by high glucose[J].International Journal of Biological Macromolecules, 2011, 49(1): 50-54.
[6]YANG Jianjun, CHEN Bin, GU Yan.Pharmacological evaluation of tea polysaccharides with antioxidant activity in gastric cancer mice[J].Carbohydrate Polymers, 2012, 90(2): 943-947.
[7]CAI Weirong, XIE Liangliang, CHEN Yong, et al.Purification,characterization and anticoagulant activity of the polysaccharides from green tea[J].Carbohydrate Polymers, 2013, 92(2): 1086-1090.
[8]倪德江, 谢笔钧.茶多糖提取条件的研究[J].农业工程学报, 2003,19(2): 176-179.
[9]崔宏春, 江和源, 张建勇, 等.影响茶多糖含量测定的干扰因素分析[J].安徽农业科学, 2009(18): 8305-8307.
[10]倪德江, 陈玉琼, 谢笔钧, 等.乌龙茶多糖OTPS 2-1的光谱特性,形貌特征及热特性研究[J].高等学校化学学报, 2004, 25(12):2263-2268.
[11]YANG Liqun, FU Shanshan, ZHU Xiane, et al.Hyperbranched acidic polysaccharide from green tea[J].Biomacromolecules, 2010, 11(12):3395-3405.
[12]邵立平.茶多糖的纯化工艺研究[J].广州化工, 2010, 38(4): 118-119.
[13]陈发河, 吴光斌, 田标, 等.中低档乌龙茶中茶多糖提取工艺优化[J].农业工程学报, 2007, 22(12): 245-247.
[14]郭思维, 刘胜姿, 李威, 等.人工冬虫夏草多糖脱色脱蛋白工艺研究[J].食品科技, 2013, 38(5): 207-211.
[15]王传名, 董祺, 管从胜.日照绿茶粗多糖脱蛋白研究[J].食品工业科技, 2010, 31(8): 274-276.
[16]陈义勇, 窦祥龙, 黄友如, 等.常熟“沙家浜”绿茶多糖的纯化[J].食品与发酵工业, 2011, 37(11): 121-124.
[17]王元凤, 金征宇.茶多糖脱色的研究[J].食品与发酵工业, 2005,30(12): 60-65.
[18]陈海霞.高活性茶多糖的一级结构表征、空间构象及生物活性的研究[D].武汉: 华中农业大学, 2002: 24-25.
[19]颜栋美, 李仁菊.膜分离和聚酰胺吸附对金花茶多酚的纯化[J].食品与机械, 2010(1): 42-43.
[20]包琦瑛.聚酰胺树脂在分离提取领域中的应用[J].浙江中医药大学学报, 2009, 33(4): 611-612.
[21]张惟杰.复合多糖生化研究技术[M].上海: 上海科学技术出版社,1987: 6-7.
[22]倪德江.乌龙茶多糖的形成特征、结构、降血糖作用及其机理[D].武汉: 华中农业大学, 2003: 32; 57.
[23]钟萝.茶叶品质理化分析[M].上海: 上海科学技术出版社, 1989:258-261.
[24]BITTER T, MUIR H M.A modified uronic acid carbazole reaction[J].Analytical biochemistry, 1962, 4(4): 330-334.
[25]石玉涛.茶多糖抗氧化和降血糖作用研究[D].武汉: 华中农业大学,2010: 16.

