大孔树脂法纯化锦灯笼宿萼总黄酮的工艺
王晓林,薛健飞,陈 帅,王慧竹,钟方丽
(吉林化工学院化学与制药工程学院,吉林 吉林 132022)
锦灯笼(Physalis alkekengi L.var.franchetii (Mast.)Makino)又名酸浆、红姑娘、灯笼草,属茄科植物酸浆的干燥宿萼或带果实的宿萼。锦灯笼全草及果实均可入药,具有清热解毒、利咽、化痰、利尿作用,用于咽痛音哑、痰热咳嗽、小便不利,其果实营养较丰富,果实果红素可作食品着色剂。锦灯笼含有酸浆苦素类化合物、甾醇类、生物碱、氨基酸、黄酮类化合物和丰富的矿物元素及维生素[1-3]。已有学者对锦灯笼的化学成分进行了相关研究,结果表明酸浆苦素类化合物、黄酮类化合物是其主要的功效成分[4-6]。黄酮类化合物是一类重要的天然有机化合物,具有抗癌、抗心脑血管疾病、抗炎镇痛、抑菌抗病毒、抗氧化和清除自由基等生理活性[7-10],广泛用于医药和食品领域。大孔吸附树脂是一种多孔性、高比表面积高分子材料,对天然植物提取液中有机物质具有选择性吸附作用,在天然产物活性成分的分离纯化有广泛应用[11-12]。本实验对D-101型大孔吸附树脂纯化锦灯笼宿萼总黄酮的工艺条件进行优化,以期研究结果能为锦灯笼宿萼的应用提供参考依据。
1 材料与方法
1.1 材料与试剂
锦灯笼宿萼 安徽省亳州市华申药业有限公司;芦丁对照品 中国食品药品检定研究院;水为重蒸馏水;大孔吸附树脂(LSA-21、LSA-10、AB-8、LX-36、D-101、LSA-33) 西安蓝晓科技有限公司;硝酸铝、氢氧化钠、亚硝酸钠、无水乙醇等均为国产分析纯试剂。
1.2 仪器与设备
752 N型紫外-可见分光光度计、JY2002型电子天平上海精密科学仪器有限公司;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;SHZ-D型循环水真空泵 河南省巩义市英峪仪器一厂;CS101-AB型电热鼓风干燥箱 中国重庆实验设备厂。
1.3 方法
1.3.1 标准曲线的绘制
精密称取芦丁对照品(120℃干燥至质量恒定)10.0 mg,置于50 mL容量瓶中,加入50%乙醇,制成芦丁对照品溶液[13](0.20 mg/mL)。精密吸取上述芦丁对照品溶液2.0、4.0、6.0、8.0、10.0、12.0 mL分别置于50 mL容量瓶中,绘制标准曲线[14-15],回归方程为A=12C-0.001 83,R=0.999 9,结果表明芦丁在0.008~0.048 mg/mL范围内呈良好的线性关系。
1.3.2 样品含量测定
取样品液、吸附后液和解吸液适量,分别置于25 mL容量瓶中,按1.3.1节方法,以不加供试品的平行样为空白,于510 nm[16-17]波长处测定吸光度,计算树脂对锦灯笼宿萼总黄酮的吸附率、解吸率及浸膏总黄酮含量。计算公式如下[18-19]:
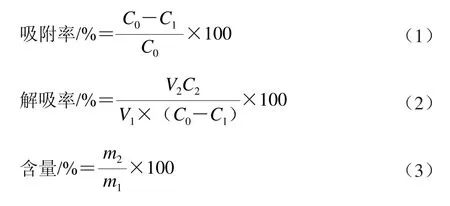
式中:C0为起始样品液中总黄酮质量浓度/(mg/mL);C1为吸附后溶液中总黄酮质量浓度/(mg/mL);C2为解吸液中总黄酮质量浓度/(mg/mL);V1为样品液体积/mL;V2为解吸液体积/mL;m1为解吸液干燥后固体的称样量/mg;m2为解吸液中总黄酮的测定量/mg。
1.3.3 大孔吸附树脂的预处理
称取大孔吸附树脂LX-36、LSA-33、LSA-10、D-101、AB-8、LSA-21各50 g加入玻璃柱内,按照文献[20]进行预处理,树脂处理完成后,置于密闭容器中,备用。
1.3.4 锦灯笼宿萼总黄酮样品液的制备
称取干燥的锦灯笼宿萼粉末适量,于圆底烧瓶中加入8倍量80%的乙醇溶液,热回流提取2次,每次3.0 h,过滤,合并滤液,减压浓缩至相对密度为1.18~1.25(60℃),蒸馏水定容至容量瓶中,待用[21]。
1.3.5 大孔吸附树脂纯化锦灯笼宿萼总黄酮工艺条件的确定
根据前期6种树脂对锦灯笼宿萼总黄酮纯化的筛选试验数据,选用D-101型树脂进行实验。称取2 g处理好的D-101型大孔吸附树脂数份,分别置于数个干燥的100 mL具塞三角瓶中[22-24],各加入20 mL已知质量浓度的锦灯笼宿萼总黄酮样品液,进行吸附-解吸实验,通过单因素试验考察不同吸附时间(1、2、3、4、5、6、7 h)、样品液不同pH值(4、5、6、7、8、9、10)对吸附率的影响,考察解吸液乙醇体积分数(10%、30%、50%、70%、90%)、解吸液用量(30、40、50、60、70、80 mL)、解吸时间(1、3、5、7、9、24 h)、样品液不同pH值(4、5、6、7、8、9、10)对解吸率的影响[25],在单因素试验基础上,对上述影响锦灯笼宿萼总黄酮纯化的因素进行五因素四水平正交试验,正交试验因素水平如表1所示。
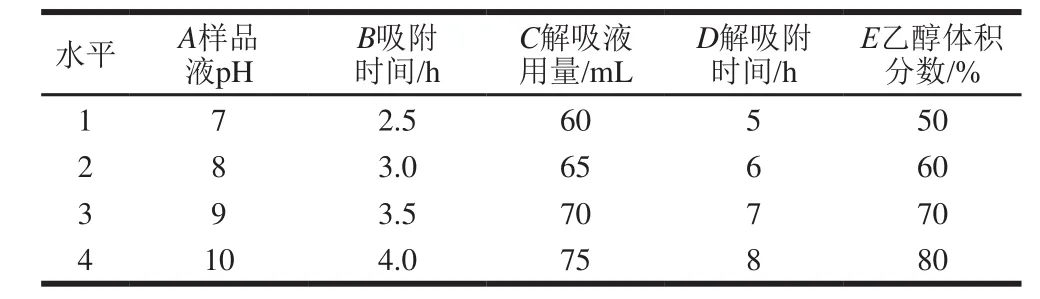
表1 正交试验因素与水平Table1 Coded levels for independent variables used in orthogonal array design
1.3.6 工艺验证实验
称取D-101型大孔吸附树脂6 g,共3份,分别置于3个干燥的250 mL三角瓶中,同时分别吸取60 mL锦灯笼宿萼总黄酮样品液(总黄酮质量浓度为1.171 8 mg/mL),用5% NaOH溶液调pH值为10,然后加到250 mL三角瓶内,振荡吸附3 h,过滤,照1.3.1节的方法测定吸光度,计算吸附率。然后向过滤后带有树脂的3个三角瓶中各加入210 mL 80%的乙醇溶液,振荡解吸7 h,按1.3.2节的方法测定溶液中总黄酮的含量,计算解吸率。再取50 mL总黄酮质量浓度为1.171 8 mg/mL的锦灯笼总黄酮样品液、上述解吸液200 mL倒入称量后的蒸发皿中水浴蒸干,然后放入到电热鼓风干燥箱中干燥至质量恒定,计算锦灯笼宿萼干浸膏质量及浸膏中总黄酮的含量。
2 结果与分析
2.1 单因素试验
2.1.1 吸附时间对吸附率的影响
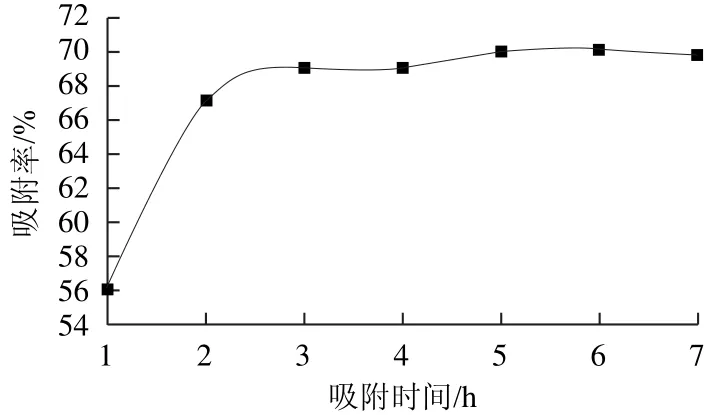
图1 吸附时间对吸附率的影响Fig.1 Effect of adsorption time on adsorption rate
如图1所示:随着吸附时间的延长,吸附率逐渐升高,当吸附时间达3 h,吸附率已达到了较高值,再延长吸附时间,吸附率基本不再提高,为了进一步考察吸附时间对吸附率的影响,选择吸附时间为2.5、3.0、3.5、4.0 h进行正交试验。
2.1.2 解吸液乙醇体积分数对解吸率的影响
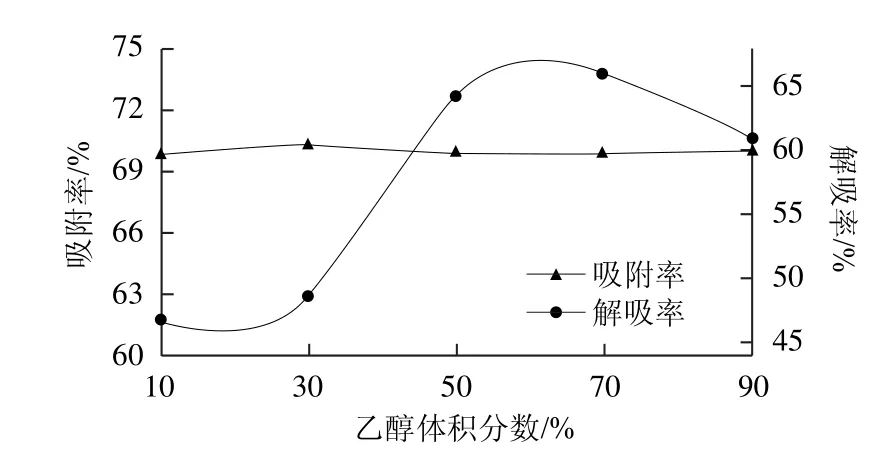
图2 解吸液乙醇体积分数对纯化效果的影响Fig.2 Effect of ethanol concentration on purification efficiency
如图2所示:随着乙醇体积分数的增加,解吸率逐渐上升,当乙醇体积分数为70%时,解吸率达到最高值,为了进一步考察解吸液乙醇体积分数对解吸率的影响,选择解吸液乙醇体积分数为50%、60%、70%、80%进行正交试验。
2.1.3 解吸液乙醇用量对解吸率的影响
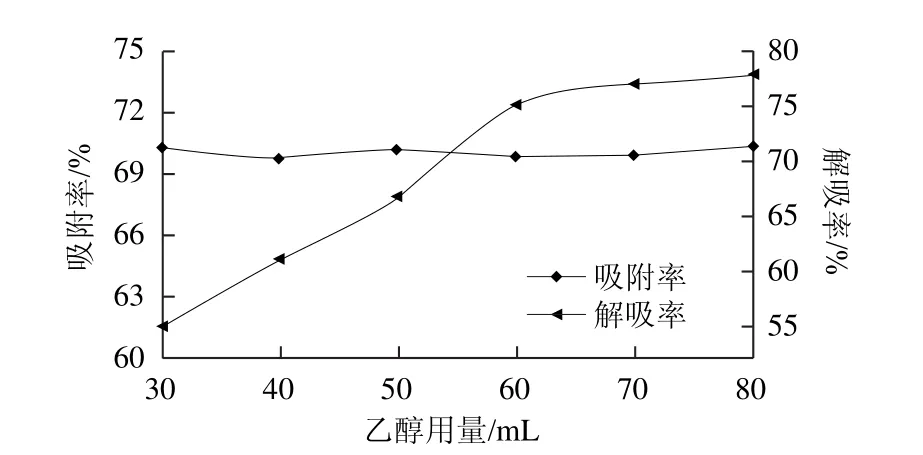
图3 解吸液乙醇用量对纯化效果的影响Fig.3 Effect of ethanol amount on purification efficiency
如图3所示:随着解吸液乙醇用量的增大,解吸率逐渐增大,当解吸液用量达到70 mL时,解吸率已达到较高值,再增加解吸液用量,解吸率增加较小,为了进一步考察解吸液用量对解吸率的影响,选择解吸液用量为60、65、70、75 mL进行正交试验。
2.1.4 解吸时间对解吸率的影响
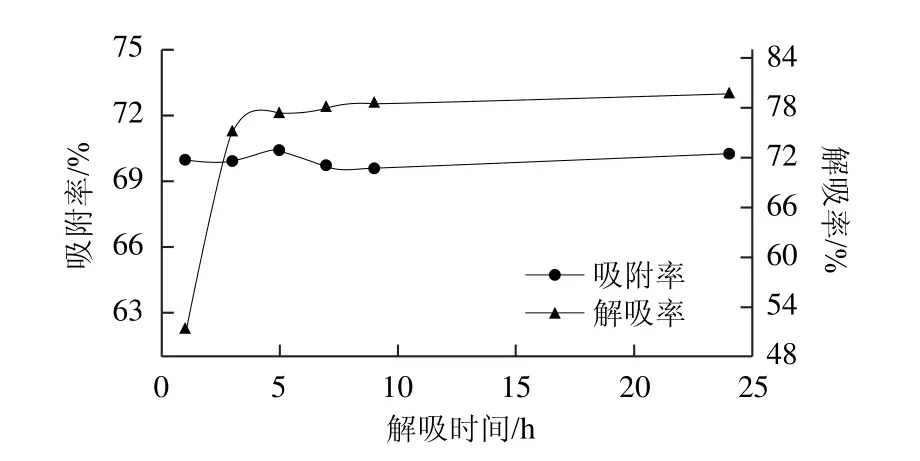
图4 解吸时间对纯化效果的影响Fig.4 Effect of desorption time on purification efficiency
如图4所示:随着解吸时间的延长,解吸率逐渐升高,但当解吸时间达到7 h时解吸率已达到较高水平,再延长解吸时间,解吸率增加幅度较小,为了进一步考察解吸时间对解吸率的影响,选择解吸时间为5、6、7、8 h进行正交试验。
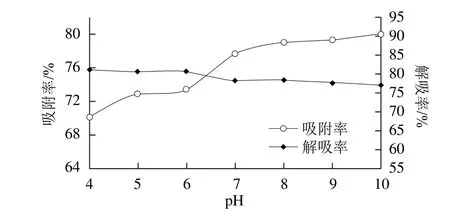
图5 样品液pH值对纯化效果的影响Fig.5 Effect of sample pH on purification efficiency
2.1.5 样品液pH值的影响
如图5所示:吸附率随pH值的升高而增大,解吸率略有下降,当样品液pH值为7时,吸附率达到了77.58%,之后吸附率随pH值的增大而缓慢提高,为了进一步考察样品液pH值的影响,选择样品液pH值为7、8、9、10进行正交试验。
2.2 正交试验
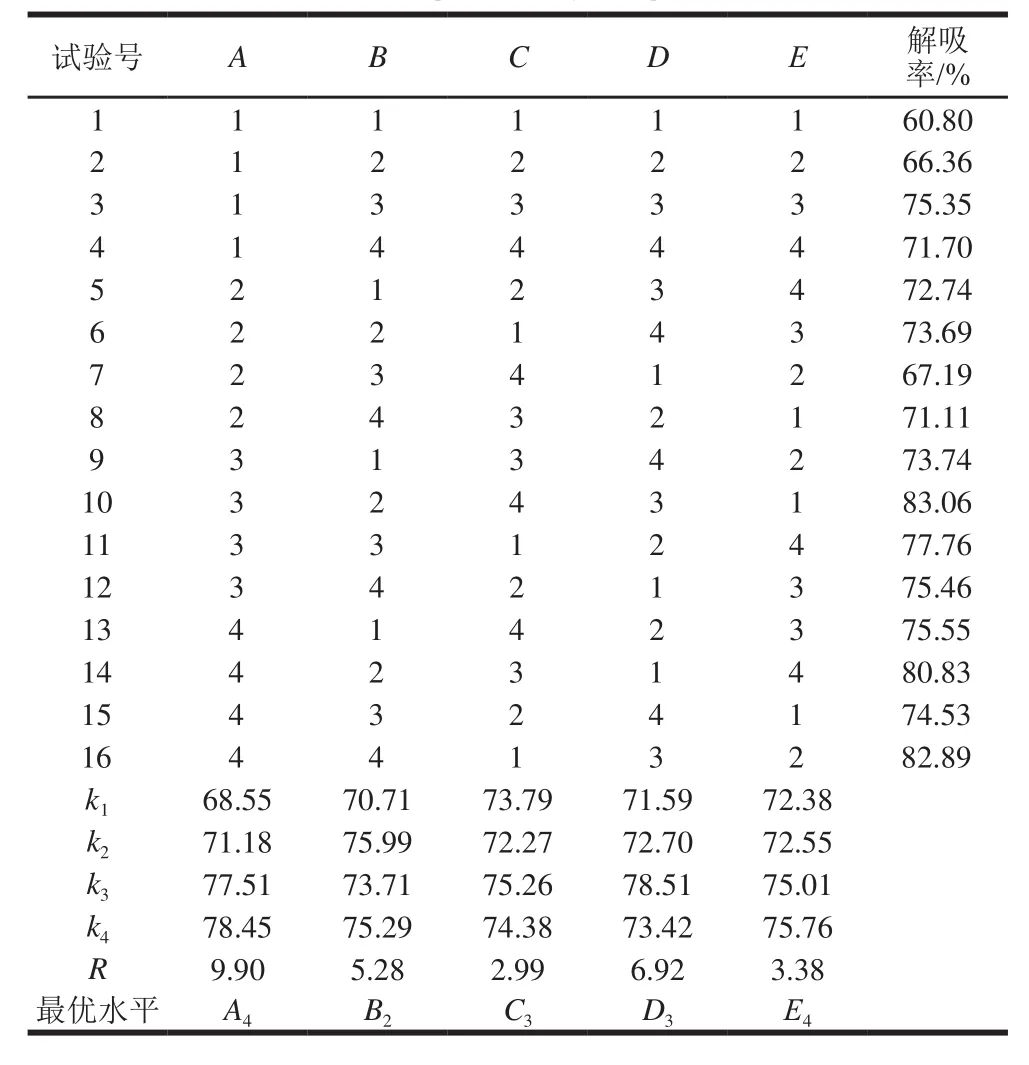
表2 正交试验设计及结果Table2 Orthogonal array design and results
根据单因素试验结果,对影响锦灯笼宿萼总黄酮在D-101型大孔吸附树脂上吸附与解吸的主要因素样品液pH值、吸附时间、解吸液体积、解吸时间、乙醇体积分数按五因素四水平进行正交试验,因素水平表见表1。称取16份预处理好的D-101型大孔吸附树脂,每份2 g, 分别置于16个干燥的100 mL具塞三角瓶中,各加入20 mL 1.181 3 mg/mL的锦灯笼宿萼总黄酮样品液,用5% HCl溶液和5% NaOH溶液调pH值,然后进行静态吸附和解吸实验,收集吸附后药液和解吸液,按1.3.2节方法测定吸光度,计算吸附率和解吸率,结果见表2。
由表2可知,D-101型大孔吸附树脂纯化锦灯笼宿萼总黄酮的最佳工艺条件为样品液pH 10、吸附时间3 h、解吸液乙醇体积分数80%、解吸液体积70 mL(体积为树脂质量的35倍)、解吸时间7 h。
2.3 工艺验证实验
为了检验正交试验结果的可靠性,按优化的工艺条件进行3次验证实验,结果见表3。
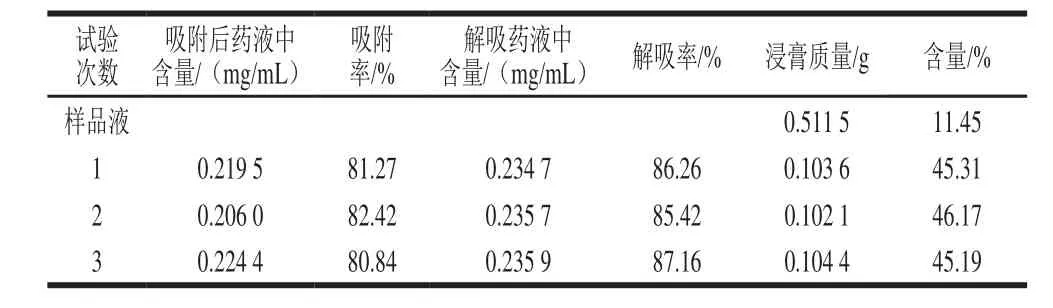
表3 工艺验证实验结果Table3 Validation of the optimized purification conditions
由表3可知,3次验证实验的吸附率和解吸率分别为81.27%、82.42%、80.84%和86.26%、85.42%、87.16%,平均吸附率和解吸率分别为81.51%和86.28%,干浸膏中总黄酮含量由11.45%提高到45.56%。
3 结 论
对纯化锦灯笼宿萼总黄酮的6种不同型号大孔吸附树脂进行了筛选,并通过单因素和正交试验研究了D-101型大孔吸附树脂纯化锦灯笼宿萼总黄酮的工艺条件。结果表明,在锦灯笼宿萼提取液pH值为10、吸附时间3 h、解吸液乙醇体积分数80%、解吸液体积70 mL(体积为树脂质量的35倍)、解吸时间7 h条件下,D-101型大孔吸附树脂纯化锦灯笼宿萼总黄酮的吸附率和解吸率分别为81.51%和86.28%,纯化后的干浸膏总黄酮含量由11.45%提高到45.56%。
[1]王明东, 杨松松.锦灯笼化学成分及药理作用综述[J].辽宁中医学院学报, 2005, 7(4): 341-342.
[2]王玮.锦灯笼的营养保健功能及药用价值[J].中国食物与营养,2008(3): 55-56.
[3]马艳丽.酸浆的化学成分分析及其利用价值的研究[J].长春大学学报, 2002, 12(3): 70-71.
[4]邱莉, 姜志虎, 刘红霞, 等.酸浆宿萼的黄酮苷类化学成分[J].沈阳药科大学学报, 2007, 24(12): 744-747.
[5]LI Jing, LI Juan, LI Dekun.Study on chemical components of Physalis alkekengi var.franchetic (Mast.) Makino[J].Chin Tradit Herb Drugs,2002, 33(8): 692-693.
[6]LI Juan, LI Jing, LI Dekun.Study on chemical components of Physalis alkekengi var.franchetic (Mast.) Makino[J].Chin Tradit Herb Drugs,2002, 33(9): 788-789.
[7]张彦文.查尔酮类化合物的药理作用和构效关系[J].国外医学: 药学分册, 1996, 23(8): 218-223.
[8]古勇, 李安明.类黄酮生物活性的研究进展[J].应用与环境生物学报, 2006, 12(2): 283-286.
[9]陈蕉, 黎云祥, 陈光登, 等.大孔吸附树脂分离纯化峨嵋岩白菜叶总黄酮[J].食品科学, 2010, 31(6): 74-78.
[10]王晓林.高效液相色谱法测定刺玫果槲皮素的含量[J].食品工业科技, 2011, 32(4): 370-372.
[11]高伟城, 蓝晓庆, 潘馨, 等.大孔吸附树脂在分离纯化总黄酮化合物中的应用[J].海峡药学, 2009, 21(7): 26-27.
[12]邢俊波, 吴禾, 刘云, 等.大孔树脂分离黄芪总皂苷工艺研究[J].中成药, 2008, 30(4): 519-521.
[13]王晓林, 陈旭, 刘慧芳.玫瑰花总黄酮的超声提取工艺[J].食品研究与开发, 2011, 32(12): 64-67.
[14]阿布力克木•阿布力孜, 阿布力米提•阿布都卡德尔, 迪丽努尔•塔力甫.新疆野生苍耳叶中总黄酮的超声波提取工艺研究[J].食品科学,2009, 30(16): 131-134.
[15]李维莉, 马银海, 张亚平, 等.菱角壳总黄酮超声辅助提取工艺研究[J].食品科学, 2009, 30(14): 140-142.
[16]叶春, 张婧.大孔树脂对野菊花总黄酮吸附分离特性的影响[J].食品科学, 2010, 31(12): 127-130.
[17]栾云峰, 王菲, 刘长江, 等.软枣猕猴桃总黄酮含量测定的方法研究[J].食品科学, 2011, 32(4): 155-158.
[18]陈顺, 关延彬.大孔树脂吸附骨碎补总黄酮特性的研究[J].中国中药杂志, 2007, 32(8): 750-753.
[19]李雪梅, 陈辉, 李书国, 等.马尾松花粉中总黄酮类物质提取条件的研究[J].食品工业科技, 2011, 32(9): 264-266.
[20]白夺龙, 杨开华.大孔吸附树脂分离纯化技术及应用[J].海峡药学,2007, 19(9): 96-99.
[21]李俶, 倪永年, 李莉.大孔吸附树脂分离纯化槲寄生中黄酮的研究[J].食品科学, 2008, 29(2): 68-71.
[22]焦岩, 王振宇.大孔树脂纯化大果沙棘果渣总黄酮的工艺研究[J].食品科学, 2010, 31(16): 16-20.
[23]易海燕, 何桂霞, 欧阳文, 等.大孔吸附树脂分离纯化藤茶总黄酮的研究[J].中草药, 2011, 42(1): 74-77.
[24]庄志军, 钟方丽, 杨英杰, 等.刺玫果中总黄酮的提取与分析[J].中成药, 2007, 29(9): 1394-1395.
[25]唐巧玉, 周毅峰, 阎婷.HPD300大孔树脂纯化金橘皮黄酮类化合物的工艺研究[J].食品科学, 2008, 29(8): 355-358.

