大叶藻总黄酮的大孔树脂纯化工艺
孙京沙,张朝辉*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
大叶藻(Zostera marina L.)是单子叶植物,隶属于眼子菜大叶藻属 ,地方名为海马蔺、海带草、海苫房草[1],分布于我国河北、辽宁和山东等沿海地区,朝鲜、日本、俄罗斯等地也有分布。大叶藻属于多年生草本植物,作为海草床的一部分,对生态环境的稳定性有重要作用,同时也具有一定的经济和生态价值。目前,国内学者对大叶藻的研究相对较少,主要集中在形态、生态作用、抗盐机理等方面[2-4]。国外学者对大叶藻的研究较多,在生理[5-6]、生态繁殖[7]、海草床恢复[8-10]等方面都比较深入。
黄酮类化合物泛指两个具有酚羟基的苯环(A-环与B-环)通过中央三碳原子相互连结而成的一系列化合物[11]。黄酮类化合物又称生物类黄酮,广泛地存在于植物的叶、花、果实等各个部位,是一类植物次生代谢产物[12],具有抗氧化[13]、降血糖[14]、降血脂[15]等多种生物功效。大叶藻中总黄酮化合物,在国内外已有研究,黄媛媛[16]、Jin等[17]对大叶藻中总黄酮的结构及其抗氧化活性作了相关的研究,黄媛媛主要对鉴定了大叶藻乙酸乙酯相中的每个黄酮化合物个体结构,而本实验是对大叶藻总黄酮进行纯化。
大孔吸附树脂的原理是选择性吸附中药及其复方的有效成分,从而达到提取精制的目的。与传统吸附剂相比,它具有选择性好、吸附容量大、解吸容易、机械强度高、耐污染、可以多次反复使用、再生比较容易等优点。目前已被广泛应用于多种植物黄酮类化合物的分离提纯中[18-19]。
目前大叶藻不被充分利用,完全未发挥其在营养学方面的价值,在一些沿海区域只是利用大叶藻来建造海草房,用海草来构建房屋的房顶。黄酮化合物已引起了国内外专家人士的广泛关注,研究方法也已日趋成熟,但是对于黄酮化合物的开发一般只限于陆生的高等植物,海洋中的植物还没有充分开发利用,本实验主要就海洋中的高等植物——大叶藻,利用大孔吸附树脂纯化其中的黄酮化合物,为大叶藻黄酮类化合物的进一步开发应用提供依据。
1 材料与方法
1.1 材料与试剂
大叶藻采于山东青岛栈桥附近海,将采回的大叶藻用自来水冲掉泥沙,清水浸泡5 h除去草面的盐。捞出后除去表面附着物,风干表面水分,后放入55℃烘箱烘干。将烘干的大叶藻用捣碎机研磨成粉末,过40 目筛,保存于阴暗干燥处备用。
芦丁标准品 南京替斯艾么中药研究所;亚硝酸钠、硝酸铝、盐酸、氢氧化钠、无水乙醇等均为国产分析纯;D101-1、D101、DM130、DM301、AB-8大孔吸附树脂 安徽三星树脂科技有限公司。
1.2 仪器与设备
SHA-B恒温振荡器 江苏常州国华电器有限公司;722s可见光分光光度计、pH计 上海精密科学仪器有限公司;AL204电子天平 梅特勒-托利多(上海)有限责任公司;DHG-903电热恒温鼓风干燥箱 上海精宏实验设备有限公司;旋转蒸发仪 德国Heidolph公司;恒流泵 保定兰格恒流泵有限公司;真空冷冻干燥机 北京思达兴业仪器有限公司;BSZ-100自动部分收集器 上海青浦泸西仪器制造厂。
1.3 方法
1.3.1 大叶藻总黄酮的提取
称取大叶藻粉末,按料液比1∶30(g/mL)的比例加入蒸馏水,80℃浸提3次,每次1 h,离心合并上清液,再用旋转蒸发仪浓缩至适当的质量浓度(1.25 mg/mL),冷藏备用。
1.3.2 大叶藻总黄酮含量的测定
1.3.2.1 标准曲线的绘制
以芦丁作为标准品,按照文献[20]配制一定梯度的标准溶液,用紫外-可见分光光度计在510 nm波长处测定吸光度,以吸光度A为纵坐标,芦丁质量浓度C/(mg/mL)为横坐标,绘制标准曲线。其回归方程和相关系数为:A=13.392 9C-0.006 7,R2=0.999 9。
1.3.2.2 上样液总黄酮质量浓度的测定
取适量上样液代替标准溶液,用紫外-可见分光光度计在510 nm波长处测定吸光度,带入回归方程计算总黄酮质量浓度。
1.3.2.3 样品纯度的测定
精确称取一定量冻干后的样品粉末,用蒸馏水溶解并定容至25 mL,取适量溶液按照上述操作测定吸光度,计算黄酮质量浓度,并按照式(1)计算冻干样品中总黄酮的纯度。

式中:c为液体中黄酮质量浓度/(mg/mL);V为液体体积/mL;m为称取的冻干样品的质量/mg。
1.3.3 大孔吸附树脂预处理
按照文献[21]进行预大孔吸附树脂预处理,备用。
1.3.4 大孔吸附树脂的筛选
1.3.4.1 静态吸附和解吸
称取1.0 g经过预处理的各树脂,置于100 mL的锥形瓶中,加入大叶藻总黄酮上样液30 mL,密封,恒温(25℃)振荡24 h,取上清液,测定样品中总黄酮的平衡时质量浓度,并按式(2)(3)计算各种树脂对大叶藻总黄酮的吸附量和吸附率。将上述充分吸附后的树脂过滤,置于锥形瓶中,再加入体积分数70%的乙醇30 mL,密封后,恒温(25℃)振荡,解吸24 h,过滤,测定洗脱液中总黄酮的质量浓度,并按式(4)(5)计算各种树脂的静态解吸率和总黄酮的回收率。

式中:C0为上样液起始质量浓度/(mg/mL);C1为上样液平衡质量浓度/(mg/mL);C2为洗脱液质量浓度/(mg/mL);V1为吸附液体积/mL;V2为洗脱液体积/mL;M为树脂质量/g。
1.3.4.2 静态吸附和解吸动力学
取预处理好的大孔树脂1.0 g于100 mL锥形瓶中,准确加入大叶藻总黄酮上样液30 mL,密封,恒温 (25℃)振荡24 h,以大孔树脂与上样液接触为0时刻,每隔一定时间取样,测定样液剩余总黄酮的质量浓度。以树脂对黄酮吸附量对时间作图,绘制大孔树脂静态动力学吸附曲线。
吸附24 h后,将树脂过滤,放入锥形瓶中,加入乙醇,摇匀,密封,恒温(25℃)振荡24 h,每隔一定时间取解吸液,测定解吸液的总黄酮质量浓度,以洗脱液总黄酮质量浓度对时间作图,绘制大孔树脂静态动力学解吸曲线。
1.3.4.3 混合树脂的吸附与解吸
根据文献[22],将上述方法选出的最优的两种树脂按照不同的比例混合,准确称取1.0 g放入锥形瓶中,量取质量浓度相同大叶藻总黄酮溶液进行吸附和解吸,计算不同比例混合树脂的吸附率和解吸率,比较其吸附和解吸效果。
1.3.5 不同条件下大孔吸附树脂对大叶藻总黄酮纯化工艺的影响
用筛选出的最佳混合比例的大孔吸附树脂进行大叶藻总黄酮纯化工艺的研究。通过静态实验,分别考察上样液pH值、上样液质量浓度对树脂吸附性能的影响,洗脱剂体积分数对树脂解吸性能的影响;通过动态实验,分别考察上样量、上样流速对树脂吸附性能的影响,洗脱体积、洗脱流速对解吸性能的影响。
1.3.6 工艺验证
按照上述所确定的最佳纯化大叶藻总黄酮的吸附和解吸条件,进行实验。将洗脱液旋蒸浓缩后,冷冻干燥。测定并计算冻干样品中总黄酮的纯度。
2 结果与分析
2.1 大叶藻总黄酮含量测定
未经纯化的大叶藻总黄酮冻干后,经测定,纯度为(12.66±0.42)%。
2.2 大孔吸附树脂的筛选
2.2.1 静态吸附和解吸实验
依据静态实验中,大孔吸附树脂的吸附率和解吸率来选择树脂型号,吸附树脂是利用吸附的可逆性分离植物有效成分。由于树脂极性不同,解吸的难易程度也不同,故解吸率也是筛选大孔树脂的又一关键因素[23]。

表1 5种不同树脂对大叶藻总黄酮的吸附和解吸效果Table1 Results of adsorption and desorption for flavonoids from Zostera marina L.by five macroporous resins
由表1可知,在树脂用量相同的情况下,各树脂对大叶藻总黄酮的吸附和解吸效果不一。其中,D101-1型树脂对大叶藻总黄酮的吸附率最高,达(58.08±0.49)%,而解吸率最高的是AB-8型树脂,达(92.39±1.27)%,总黄酮回收率由高到低树脂依次是D101-1、AB-8。因此,本实验预将采用D101-1树脂和AB-8树脂按一定比例混合作为大叶藻总黄酮的纯化树脂,希望可以选择出分离纯化大叶藻总黄酮效果最好的混合树脂比例。
2.2.2 静态吸附和解吸动力学实验
仅用树脂的平衡吸附量、吸附率和解吸率来评价其吸附和解吸性能是不全面的,合适的树脂不仅具有较大的吸附量,良好的解吸率,同时应该具有较快的吸附速率和解吸速率,所以又研究其静态吸附动力学和解吸动力学特性。由图1和图2可知,D101-1和AB-8两种大孔树脂对大叶藻总黄酮的吸附和解吸都可视为快速平衡型。从图1可知,在起始阶段,吸附量增加较快,在7 h时基本接近平衡。7 h时,D101-1和AB-8的吸附量分别为19.17 mg/g和15.85 mg/g。从图2可知,在解吸过程中,4 h以后,洗脱液中的总黄酮质量浓度增加趋势很缓慢,说明4 h时,解吸基本接近平衡。

图1 D101-1和AB-8两种大孔树脂静态动力学吸附曲线Fig.1 Static adsorption curves of D101-1 and AB-8 macroporous resins

图2 D101-1和AB-8两种大孔树脂静态动力学解吸曲线Fig.2 Static desorption curves of D101-1 and AB-8
综合以上分析可知,两种吸附树脂吸附和解吸动力学曲线的走向趋势基本一致。在吸附实验,7 h时基本达到平衡状态;解吸实验中,在4 h时基本达到平衡状态。所以,在下述的静态实验中,将选择7 h作为吸附时间,4 h作为解吸时间。
2.3 混合树脂的吸附与解吸

表2 不同混合比例树脂的吸附与解吸对比Table2 Comparison of adsorption and desorption capacities of D101-1:AB-8 mixtures in different proportions
从表2可以看出,吸附率较高的D101-1与AB-8大孔树脂质量比为2∶3、1∶1;而解吸率较高的D101-1与AB-8大孔树脂质量比为3∶2、2∶3。对效果较好的树脂选用总黄酮回收率进行考察,综合考虑,确定D101-1和AB-8质量比2∶3混合作为大叶藻总黄酮的树脂材料。
2.4 不同条件对大孔吸附树脂纯化大叶藻总黄酮工艺的影响
2.4.1 上样液pH值对吸附率影响

图3 上样液pH值对吸附率的影响Fig.3 Effect of sample pH on adsorption rate
由图3可知,在酸性环境下,大孔树脂吸附率高于中性环境,当溶液pH值为3时,大孔树脂对大叶藻总黄酮有最佳吸附率,0.5 g的大孔树脂的吸附率是(36.23±2.09)%。这是因为黄酮为多羟基酚类,呈弱酸性,故在酸性或弱酸性条件下易被吸附,而酸性过强时黄酮分子易形成佯盐,偏碱性时黄酮分子羟基去离子化,黄酮化合物形成离子型结构,故都不易被吸附[24]。因此,选样品溶液pH值为3作为最佳实验条件。
2.4.2 上样液质量浓度对吸附率的影响
树脂吸附目标产物时,存在着一个吸附平衡,该平衡和料液质量浓度有很大的关系。尤其是当树脂的吸附平衡是受液膜扩散控制时,料液质量浓度对树脂吸附平衡影响更大[25]。黄建明等[26]研究表明如果上样液浓度过低提纯时间增加,效率降低;上样液质量浓度过高则泄漏早,处理量小,树脂的再生周期短。

图4 上样液质量浓度对树脂吸附性能的影响Fig.4 Effect of sample concentration on adsorption properties
由图4可知,随着溶液的质量浓度增加,大孔树脂的吸附率逐渐降低,吸附量先增长后趋于平缓。当大叶藻总黄酮溶液的质量浓度为1.25 mg/mL时,黄酮吸附量的增加率最大,吸附量也基本达到饱和,所以从节约黄酮溶液和树脂的角度考虑,选择最适上样质量浓度为1.25 mg/mL。
2.4.3 洗脱剂对解吸率的影响
大孔树脂常用的洗脱剂是低级醇、酮或其水溶液,如甲醇、乙醇、丙醇和丙酮。考虑到实际生产安全性等方面要求,本实验使用乙醇作为洗脱剂[27]。由于乙醇毒性低,易于回收,选择不同体积分数的乙醇溶液作为洗脱溶剂。

图5 乙醇体积分数对解吸率的影响Fig.5 Effect of ethanol concentration on desorption rate
充分吸附后的树脂,用不同体积分数(40%、50%、60%、70%、80%)的乙醇溶液进行洗脱,结果如图5所示,随着洗脱剂浓度体积分数的增加,解吸率也在不断的升高,当洗脱剂的体积分数接近70%时,对大叶藻总黄酮的解吸率较高,解吸率可达到92.61%;当体积分数大于70%时,解吸率逐渐降低。本实验采用乙醇体积分数70%。
2.4.4 最佳上样量的确定
取大叶藻总黄酮的上样液若干,以2 BV/h的流速通过层析柱,每0.5 BV为一个收集段,测定每段收集液中总黄酮的质量浓度,绘制泄露曲线,结果见图6。

图6 总黄酮的泄露曲线Fig.6 Leakage curve of flavonoids
如图6所示,当上样量为6 BV时,总黄酮的泄漏率开始明显的增加,上样量越大,流出液中大叶藻总黄酮质量浓度越大,浪费原料;反之,上样量太小,树脂处理量较小,工作效率低。综合考虑,应选择上样量为6 BV。
2.4.5 最佳上样流速的确定
分别以1.0、2.0、3.0、4.0、5.0 BV/h的流速,上样6 BV,质量浓度为1.25 mg/mL的上样液进行动态吸附,用4 BV蒸馏水洗柱,并将吸附过程的流出液和水洗液收集在一起作为吸附残液,记录残液体积,测定残液总黄酮吸光度,计算吸附总量,结果见图7。
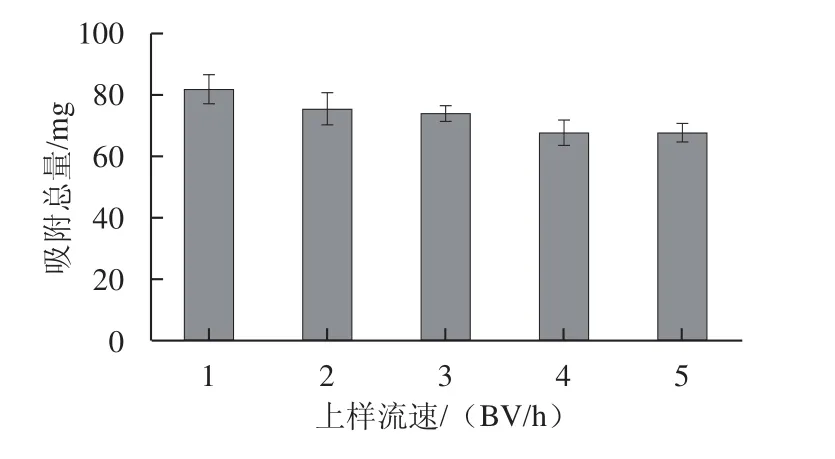
图7 上样流速对树脂吸附性能的影响Fig.7 Effect of sample laoding flow rate on adsorption quantity
由图7可知,随着吸附流速增加,树脂吸附量逐渐下降。流速过快,会提前泄漏;流速低,有利于总黄酮的充分吸附,但会影响生产效率,使生产周期延长,成本增加。流速在1~3 BV/h时,吸附总量均大于70 mg。综合考虑下,选择上样流速为3 BV/h即可。
2.4.6 最佳洗脱体积的确定
按确定的最佳吸附条件上柱,用体积分数70%的乙醇,以2 BV/h的流速洗脱,每0.5 BV为一个收集段收集洗脱液,检测每段收集液中总黄酮的质量浓度,绘制洗脱曲线,结果见图8。

图8 洗脱曲线Fig.8 Dynamic desorption curve
由图8可知,当洗脱体积到达3.5 BV后,洗脱液质量浓度接近0且基本不再变化,说明3.5 BV基本洗脱完全,但为了保证树脂吸附的总黄酮彻底洗脱下来,在后续的实验中将用5 BV作为最佳的洗脱体积。
2.4.7 最佳洗脱流速的确定
按确定的最佳吸附条件上柱,用体积分数70%的乙醇,以2 BV/h的流速洗脱,用70%的乙醇溶液分别按1.0、2.0、3.0、4.0、5.0 BV/h的速率进行洗脱,洗脱液用量为5 BV。测定洗脱液总黄酮的质量浓度,计算解吸率,结果见图9。

图9 洗脱流速对树脂解吸性能的影响Fig.9 Effect of elution flow rate on desorption rate
由图9可知,由于洗脱体积都是用的5 BV,所以洗脱流速对解吸率的影响不大,流速在小于等于3 BV/h时,解吸率都在90%之上,故为了保证洗脱时间不至过长,选用3 BV/h作为最佳洗脱流速。
2.5 工艺验证实验
经过上述试验,确定的大叶藻总黄酮纯化的最佳工艺条件为D101-1和AB-8大孔吸附树脂质量比2∶3、上样量6 BV、上样流速3 BV/h、上样液pH 3、上样液质量浓度1.25 mg/mL、洗脱液体积分数70%乙醇、洗脱体积5 BV、洗脱流速3 BV/h,在以上条件下进行实验。实验结果表明,经过纯化后,样液中的总黄酮回收率可达到(59.47±0.68)%,冻干样品纯度由原来的(12.66±0.42)%上升至(51.25±1.26)%。经验证实验确定该条件可行,可作为工业生产的参考工艺。
3 结 论
通过对5种不同型号的大孔吸附树脂和混合树脂的静态吸附和解吸实验,研究了大叶藻总黄酮的纯化工艺条件,实验表明:D101-1和AB-8大孔吸附树脂以2∶3比例混合、上样量6 BV、上样流速3 BV/h、上样液pH 3、上样液质量浓度1.25 mg/mL、洗脱液乙醇体积分数70%、洗脱体积5 BV、洗脱流速3 BV/h,冻干后总黄酮的纯度由原来的(12.66±0.42)%上升至(51.25±1.26)%,提高接近4倍,本研究结果为大叶藻总黄酮的纯化提供新方法,具有较好的应用价值。
[1]张壮伟, 潘金华, 江鑫, 等.大叶藻的特征、特性和利用[J].经济植物, 2010(7): 33-34.
[2]杨宗岱, 吴宝玲.中国海草场的分布、生产力及其结构与功能的初步探讨[J].生态学报, 1981, 1(1): 84-87.
[3]原永党, 宋宗诚, 郭长禄, 等.大叶藻的形态特征与显微结构[J].海洋湖泽通报, 2010(3): 73-78.
[4]达维斯.海洋植物学[M].厦门: 厦门大学出版社, 1989: 305-322.
[5]A MARSHALL P, ROBERT D S, RANDALL S.Glutamine synthetase activity and free amino acid pools of eelgrass (Zostera marina L.)roots[J].Journal of Experimental Marine Biology and Ecology, 1987,106(3): 211-228.
[6]GEORGE P K, RANDALL S A.Impact of daily photosynthetic period on protein synthesis and carbohydrate stores in Zostera marina L.(eelgrass) roots: implications for survival in light-limited environments[J].Journal of Experimental Marine Biology and Ecology, 1995, 185(2): 191-202.
[7]TINA M G, DORTE K-J, MICHAEL B R, et al.Means of rapid eelgrass (Zostera marina L.) recolonisation in former dieback areas[J].Aquatic Botany, 2005, 82(2): 143-156.
[8]PALING E I, VAN K M, WHEELER K D, et al.Improving mechanical seagrass transplantation[J].Ecological Engineering, 2001, 18(1): 107-113.
[9]MEEHAN A J, WEST R J.Experimental transplanting of Posidonia australis seagrass in Port Hacking, Australia, to assess the feasibility of restoration[J].Marine Pollution Bulletin, 2002, 44(1): 25-31.
[10]PHILLIPS R C, PETER M C.Seagrass research methods[M].Paris: United National Educational Scientific and Culture Organization, 1990: 51-54.
[11]张培成.黄酮化学[M].北京: 化学工业出版社, 2009: 3.
[12]郑建仙.功能性食品学[M].北京: 中国轻工业出版社, 2003: 76.
[13]杨国恩, 宝丽, 张晓琦, 等.黄花蒿中的黄酮化合物及其抗氧化活性研究[J].中药材, 2009, 32(11): 1683-1685.
[14]江正菊, 宁林玲, 胡霞敏, 等.桑叶总黄酮对高脂诱导大鼠高血脂及高血糖的影响[J].中药材, 2011, 34(1): 108-111.
[15]钟鸣, 高丹, 胡昆, 等.富硒蛹虫草对小鼠降血脂和抗氧化作用的影响[J].时珍国医国药, 2009, 20(12): 3142-3144.
[16]黄媛媛.大叶藻中黄酮类化合物的研究[D].青岛: 中国海洋大学,2011: 48-59.
[17]JIN H K, YOUNG H C, SUNG M P.Antioxidants and inhibitor of matrix metalloproteinase-1 expression from leaves of Zostera marina L.[J].Archives of Pharmacal Research, 2004, 27(2): 177-183.
[18]雍晓静, 刘钢, 张境.应用大孔树脂分离纯化枸杞叶总黄酮的研究[J].宁夏大学学报: 自然科学版, 2005, 26(2): 148-150.
[19]蔡丹昭, 刘华钢, 陈洪涛.大孔吸附树脂分离纯化番石榴叶总黄酮的研究[J].生命科学研究, 2008, 12(1): 57-60.
[20]国家药典委员会.中国药典[M].北京: 中国医药科技出版社, 2010:120-121.
[21]刘安军, 刘慧慧, 郭丹霄, 等.大孔吸附树脂分离纯化枸杞叶总黄酮的研究[J].现代食品科技, 2012, 28(3): 292-296.
[22]黄金龙, 殷之武, 何新华, 等.银杏叶总黄酮纯化工艺研究[J].中草药, 2012, 43(5): 922-925.
[23]陈兴芬, 单承莺, 姜洪芳, 等.侧柏叶总黄酮的纯化工艺研究[J].江苏农业科学, 2011, 39(3): 400-401.
[24]朱燕超.荷叶黄酮苷与苷元的制备及其降血糖初步研究[D].无锡:江南大学, 2008: 26.
[25]杨乐, 王洪新, 秦晓娟.大孔树脂纯化笋壳中的黄酮物质[J].食品与生物技术学报, 2011, 30(2): 218-223.
[26]黄建明, 郭济贤, 陈万生, 等.大孔树脂对草乌生物碱的吸附性能及提纯工艺[J].复旦学报: 医学版, 2003, 30(3): 267-269.
[27]朱洪梅, 韩永斌, 顾振新, 等.大孔树脂对紫甘薯色素的吸附与解N吸特性研究[J].农业工程学报, 2006, 22(5): 153-156.

