影响分光光度法测定钝顶螺旋藻干粉叶绿素含量的因素分析
罗光宏,许耀照*,何 琳
(1.甘肃省微藻工程技术研究中心,甘肃 张掖 734000;2.河西学院河西生态与绿洲农业研究院,甘肃 张掖 734000;3.张掖市科学技术局,甘肃 张掖 734000)
螺旋藻又名蓝藻,是地球上最古老的物种之一,由于螺旋藻富含各种营养物质和生物活性物质,已成为一种新型“食药同源”的优质菌体蛋白[1-2]。螺旋藻是成功开发并实现产业化生产的微藻。目前工业化生产的螺旋藻只有钝顶螺旋藻(Spirulina platnsis)和极大螺旋藻(Spirulina maxima)[3-4]。螺旋藻具有提高机体免疫力,防癌、抗辐射、抗衰老以及放射防护等能力[5-7],被联合国粮农组织和联合国教科文组织推荐为“21世纪人类蛋白质的来源”和“人类明天最理想的保健食品”[8-9]。
螺旋藻为浮游性原始藻类植物,其叶绿素含量丰富,因此具有改善血红素水平,提高血液循环系统的功能[10]。螺旋藻叶绿素a含量大约占有机物干质量的1%~2%,可作为估计藻类的生物量和生产力的指标的重要指标[11]。测定浮游植物叶绿素a的方法可以分为高效液相色谱法、荧光光度计法和分光光度计法等[12]。其中,可见分光光度法是测定浮游植物叶绿素最常用的方法[13-14]。国内外在该领域采用的叶绿素a测定方法是国家环保总局《水和废水监测分析方法》和联合国教科文推荐的分光光度法,其具有灵敏度高、仪器设备简单、操作简便、应用广泛等优点。彭文彬等[15]利用两种分光光度法测定浮游植物叶绿素a含量,表明三色法和单色法分光光度法具有相同的精密度,但是单色法更具有较好的稳定性和理论的符合性;戴荣继等[16]通过分光光度计法测定了藻类叶绿素含量,发现不同藻类具有很大差异。段刚等[17]通过丙酮-分光光度法测定了滇池藻类叶绿素含量,间接测定了滇池藻类生长情况。董育红等[18]通过分光光度法测定螺旋藻粉β-胡萝卜素含量,发现其胡萝卜素的含量是胡萝卜的10倍以上。根据所用的色素萃取液不同,可分为丙酮法、甲醇法和乙醇法以及丙酮-乙醇混合液提取法等。国内常用的丙酮-分光光度法测定叶绿素含量,而国际上较通用的是热乙醇-分光光度法。前人研究发现,提取液种类、提取方式以及提取时间等是影响叶绿素含量测定稳定性的重要因素[19-23]。
目前关于螺旋藻叶绿素含量的测定多集中于从藻液中获得的藻体,而关于钝顶螺旋藻干粉叶绿素含量测定的报道较少,本研究拟对影响分光光度法测定钝顶螺旋藻干粉叶绿素含量的因素进行探讨,旨在为快速、高效检测螺旋藻类干粉叶绿素含量和螺旋藻干粉的研究开发提供实验依据。
1 材料与方法
1.1 材料与试剂
钝顶螺旋藻(Spirulina platensis),绿色干片,由甘肃省微藻工程技术研究中心提供。
95%乙醇、99.5%丙酮均为分析纯。
1.2 仪器与设备
UV-1200可见光分光光度计 郑州南北仪器设备有限公司;BSA224S电子天平 赛多利斯科学仪器(北京)有限公司;DHG-9123A电热恒温鼓风干燥箱 上海美普达仪器有限公司;RXZ-300D智能型人工气候箱宁波市科技园区新江南仪器有限公司。
1.3 方法
称取5.0 g钝顶螺旋藻绿色干片,在45℃条件下烘干1.5 h,然后置干燥器中冷却至室温,用研钵(Φ=9 cm)反复研磨钝顶螺旋藻为干粉,备用。实验于2013年8月—12月在甘肃省河西走廊特色资源利用重点实验室进行。
1.3.1 浸提剂的影响
精确称取备用的钝顶螺旋藻干粉0.030 g(精确至0.000 1 g)样品于50 mL的具塞玻璃刻度试管中,分别加入以下试剂:T1(95%乙醇-99.5%丙酮(1∶1,V/V))12 mL,T2(99.5%丙酮)10 mL,T3(95%乙醇)10 mL,T4(95%乙醇-99.5%丙酮(2∶1,V/V))12 mL,T5(95%乙醇-99.5%丙酮(1∶2,V/V))12 mL,每个处理重复3次,与室温(23±2)℃条件下避光浸提,每隔2 h搅动3~5 min,浸提24 h后沉淀1~2 min,将浸提液置于25 mL的棕色容量瓶中,用T1、T2、T3、T4和T5浸提剂溶液定容于容量瓶刻度线,并记录定容液的体积数。并测定不同波长处浸提液的吸光度。
1.3.2 浸提时间的影响
精确称取备用的钝顶螺旋藻干粉0.030 g(精确至0.000 1 g)置于50 mL的具塞玻璃刻度试管中,加入以1.3.1节选择的最优浸提剂10 mL,于室温(23±2)℃条件下避光浸提,每隔2 h搅动3~5 min,静置沉淀1~2 min,浸提时间设为2、4、6、8、10、12、14、24 h 8个处理,每个处理重复3次,测定不同波长处浸提液的吸光度。
1.3.3 浸提温度的影响
精确称取备用的钝顶螺旋藻干粉0.030 g(精确至0.000 1 g)置于50 mL的具塞玻璃刻度试管中,加入1.3.1节选择的最优浸提剂10 mL和1.3.2节选择的最优浸提时间条件下避光浸提,每隔2 h搅动3~5 min,静置沉淀1~2 min,浸提温度设为15、20、21、22、25℃ 5个处理,每个处理重复3次,在1.3.2节选择的最优浸提时间测定不同波长处浸提液的吸光度。
1.3.4 正交试验设计
在单因素试验的基础上设计正交试验[24-26],采用L9(34)正交试验设计,考察浸提剂、浸提时间、浸提温度3个因素对钝顶螺旋藻干粉叶绿素含量的影响,每个因素选择3个水平。正交试验因素与水平如表1所示。

表1 正交试验因素与水平Table1 Factors and levels used for orthogonal array design
1.3.5 叶绿素含量计算
以浸提液相对应的浸提剂溶液作为空白,用带塞的1 cm的玻璃比色皿在450、630、645、652、663、750 nm波长处测定浸提液的吸光度。再根据(1)、(2)和(3)式计算出浸提液中叶绿素、叶绿素a和类胡萝卜素质量浓度,并依据(4)、(5)和(6)计算叶绿素、叶绿素a和类胡萝卜素含量。

式中:ρ为叶绿素质量浓度/(mg/L);ρa为叶绿素a质量浓度/(mg/L);ρxc为类胡萝卜素质量浓度/(mg/L);A450nm、A630nm、A645nm、A663nm、A652nm、A750nm分别为450、630、645、663、652、750 nm波长处的吸光度;V为色素提取浸提混合液的体积;N为测定叶绿素稀释倍数;m为样品的质量/g。
1.4 数据分析
采用Microsoft Excel 2003软件对数据进行分析和作图;用DPS 7.05软件对数据进行方差分析;利用Duncan式多重比较对差异显著性进行分析,P<0.05表示差异显著。
2 结果与分析
2.1 浸提剂对钝顶螺旋藻干粉叶绿素含量的影响

图1 浸提剂对钝顶螺旋藻叶绿素、叶绿素a和类胡萝卜素含量的影响Fig.1 Effect of extraction solvent on the determination of total chlorophyll, chlorophyll a and carotenoids in Spirulina platensis
由图1可以看出,不同的浸提剂对钝顶螺旋藻干粉叶绿素含量有明显的影响。T1浸提剂处理的叶绿素、叶绿素a和类胡萝卜素含量最高,依次为11.20、8.03 mg/g和2.03 mg/g,与T2、T3、T4和T5浸提剂处理的叶绿素、叶绿素a和类胡萝卜素含量达到显著差异(P<0.05);T2浸提剂处理的叶绿素a含量和类胡萝卜素含量最小,依次为5.87 mg/g和1.25 mg/g;T3浸提剂处理的叶绿素含量最小,为7.45 mg/g;不同浸提剂处理对钝顶螺旋藻干粉叶绿素含量依次为T1>T4>T5>T2>T3。这表明单一的丙酮或乙醇不宜做钝顶螺旋藻干粉叶绿素的浸提剂,丙酮和乙醇以不同的体积比混合可以有效提高钝顶螺旋藻干粉叶绿素含量,且以95%丙酮-95%乙醇(1∶1,V/V)浸提钝顶螺旋藻干粉叶绿素是可选择的适宜浸提剂。
2.2 浸提时间对钝顶螺旋藻干粉叶绿素含量的影响
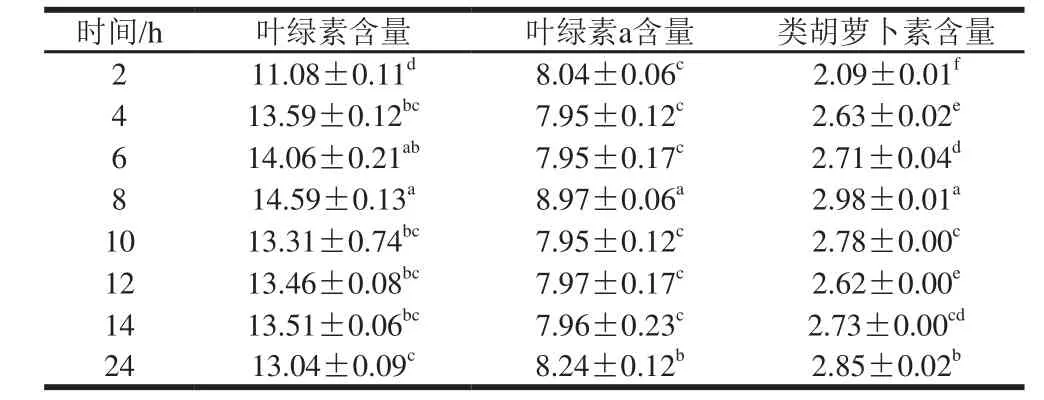
表2 浸提时间对钝顶螺旋藻叶绿素、叶绿素a和类胡萝卜素含量的影响Table2 Effect of extraction time on the determination of total chlorophyll, chlorophyll a and carotenoids in Spirulina platensis mg/g
由表2可以看出,由T1处理浸提剂浸提钝顶螺旋藻干粉叶绿素,不同浸提时间对其叶绿素含量有明显的影响。随着浸提时间延长,T1处理浸提剂浸提钝顶螺旋藻干粉叶绿素含量不断增加,当浸提时间为8 h时,浸提的钝顶螺旋藻干粉叶绿素含量达到最大值为14.59 mg/g,当浸提时间超过8 h后,浸提的叶绿素含量略有下降,但无明显的降低。浸提8 h与其他浸提时间处理间达到显著差异(P<0.05)。当浸提时间为8 h时,钝顶螺旋藻干粉叶绿素a的含量最大为8.97 mg/g,与其他浸提时间处理间达到显著差异(P<0.05),浸提时间为2、4、6、10、12 h和14 h处理的叶绿素a的含量无显著差异。当浸提时间为8 h 时,钝顶螺旋藻干粉类胡萝卜素的含量最大为2.98 mg/g,与其他浸提时间处理间达到显著差异(P<0.05),浸提时间2 h时,钝顶螺旋藻干粉类胡萝卜素的含量最小为2.09 mg/g,且不同的浸提时间处理间类胡萝卜素含量达到显著差异(P<0.05)。这表明浸提时间明显影响钝顶螺旋藻干粉叶绿素、叶绿素a和类胡萝卜素的含量,且8 h是测定钝顶螺旋藻干粉叶绿素含量可选择的适宜浸提时间。
2.3 浸提温度对钝顶螺旋藻干粉叶绿素含量的影响
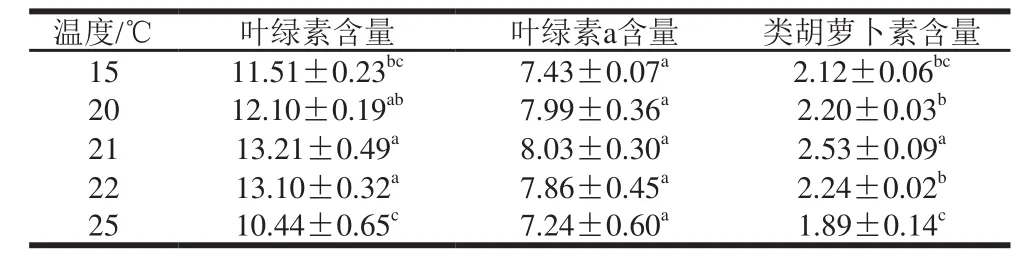
表3 浸提温度对钝顶螺旋藻叶绿素、叶绿素a和类胡萝卜素含量的影响Table3 Effect of extraction temperature on the determination of total chlorophyll, chlorophyll a and carotenoids in Spirulina platensis mg/g
T1浸提剂处理,浸提8 h后测定钝顶螺旋藻干粉叶绿素含量,由表3可以看出,不同浸提温度对其叶绿素含量有明显的影响。随着浸提温度升高,T1浸提剂处理浸提8 h时钝顶螺旋藻干粉叶绿素含量不断增加,当浸提温度为21℃时,钝顶螺旋藻干粉叶绿素含量达到最大值为13.21 mg/g,当浸提温度低于20℃和超过22℃时,叶绿素含量显著下降(P<0.05),浸提温度为20、21℃和22℃与15℃和25℃温度处理间达到显著差异(P<0.05),浸提20、21℃和22℃间无明显差异,但浸提温度为21℃时,测定其叶绿素含量最大。浸提温度对钝顶螺旋藻干粉叶绿素a含量无显著差异。浸提温度为21℃时对钝顶螺旋藻干粉类胡萝卜素含量与其他浸提温度达到显著差异(P<0.05)。这表明浸提温度明显影响钝顶螺旋藻干粉叶绿素含量的测定,21℃是测定钝顶螺旋藻干粉叶绿素含量可选择的适宜浸提温度。
2.4 正交试验分析

表4 正交试验设计与结果Table4 Results and analysis of orthogonal array design

表5 方差分析表Table5 Analysis of variance for the experimental results of orthogonal array design
由表4可以看出,各因素影响钝顶螺旋藻干粉叶绿素含量的主次顺序为浸提剂>浸提时间>浸提温度,最优因素水平组合为A1B2C2,即在浸提剂95%乙醇-99.5%丙酮(1∶1,V/V)、浸提时间8 h、浸提温度21℃时,浸提钝顶螺旋藻干粉叶绿素含量最高,为13.21 mg/g。由表5可知,浸提剂对钝顶螺旋藻干粉叶绿素含量影响达到显著水平(P<0.05)。
3 结 论
本实验对影响分光光度法测定钝顶螺旋藻干粉叶绿素含量的因素进行了探讨,以确定快速测定叶绿素含量的操作参数。其测定叶绿素含量的最佳参数为浸提剂95%乙醇-99.5%丙酮(1∶1,V/V)、浸提时间8 h和浸提温度21℃,此条件下测定钝顶螺旋藻干粉的叶绿素含量最高,其中浸提剂成分对钝顶螺旋藻干粉的叶绿素含量有明显影响。该方法简便易行,浸提效果良好,可用于分光光度法测定藻类干粉的叶绿素含量。
[1]李神州, 李岳, 陶明方.浅谈螺旋藻的开发价值及应用[J].科技资讯,2008(14): 201-204.
[2]郭芬芬, 宗文, 曲悦闻, 等.螺旋藻的开发及应用前景[J].科技信息,2008(6): 16.
[3]李全顺, 贾庆舒.螺旋藻的生物特性及其应用价值[J].沈阳教育学院学报, 2006, 8(2): 122-125.
[4]陈金娥.螺旋藻的开发与应用[J].食品研究与开发, 2007, 28(9):155-157.
[5]鲁军, 任迪峰, 王建中, 等.钝顶螺旋藻的体内抗氧化和护肝作用[J].食品与生物技术学报, 2009, 28(6): 777-780.
[6]HAYASHI K, HAYASHI T, MORITA N, et al.An extract from Spirulina platensisis a selective inhibitor of herpes simplex virus type 1 penetration into HeLa cells[J].Phytotherapy Research, 1993, 7(1): 76-80.
[7]陈新美, 王晓华.螺旋藻藻蓝蛋白的稳定性及抗癌活性研究[J].氨基酸和生物资源, 2006, 28(1): 59-62.
[8]徐建红, 辛晓芸, 王爱业.螺旋藻的研究现状及进展[J].山西师大学报: 自然科学版, 2003, 17(3): 57-63.
[9]刘杨, 王雪青, 庞广昌, 等.钝顶螺旋藻藻蓝蛋白的富集分离及其稳定性研究[J].食品科学, 2008, 29(7): 39-42.
[10]苗晓洁, 董文宾, 代春吉, 等.螺旋藻的研究现状与应用[J].食品研究与开发, 2006, 27(1): 116-118.
[11]戴荣继, 黄春, 佟斌, 等.藻类叶绿素及其降解产物的测定方法[J].中央民族大学学报: 自然科学版, 2004, 13(1): 75-80.
[12]WETZEL R G, LIKENS G E.Limnological analyses[M].3rd ed.New York: Springer, 2000.
[13]张爱军, 沈继红, 王能飞, 等.海蓬子叶绿素成分的分析测定[J].中国食品添加剂, 2006(2): 159-161.
[14]杨振德.分光光度法测定叶绿素含量的探讨[J].广西农业大学学报,1996, 15(2): 145-150.
[15]彭文彬, 刘红瑛, 陈敬员.两种分光光度法测定浮游植物叶绿素a的比对试验[J].黄石高等专科学校学报, 2002(3): 34-36.
[16]戴荣继, 黄春, 佟斌, 等.藻类叶绿素及其降解产物的测定方法[J].中央民族大学学报: 自然科学版, 2004, 13(1): 75-80.
[17]段刚, 刘晓海, 高云涛, 等.分光光度法测定滇池藻类生长的研究[J].化学与生物工程, 2006, 23(4): 55-57.
[18]董育红, 封涛, 张振兰, 等.螺旋藻的营养成分分析[J].食品研究与开发, 2003, 24(3): 70-71.
[19]杨振德.分光光度法测定叶绿素含量的探讨[J].广西农业大学学报,1996, 15(2): 145-150.
[20]司大英, 魏蓓, 杨馗.测定生产力中/叶绿素a的方法探讨[J].环境工程, 2000, 18(3): 52-53.
[21]STRICKLAND J D H, PARSONS T R.A practical handbook of seawater analyses[J].Bull Fish Res Board Can, 1968, 167: 154-166.
[22]张所信, 江龙法, 李树安, 等.从钝顶螺旋藻提取色素的初步探讨[J].精细化工, 1991, 8(3): 45-46.
[23]潘欣, 李建宏, 浩云涛, 等.DMF提取微藻叶绿素a方法的改进[J].生物技术, 2001, 11(1): 39-41.
[24]彭海滨.正交试验设计与数据分析方法[J].计量与测试技术,2009(12): 39-42.
[25]王万中, 峁诗松.试验的设计与分析[M].上海: 华东师范大学出版社, 1997.
[26]周晓光, 李为民, 陈刚, 等.一种近正交试验设计方法[J].空军工程大学学报: 自然科学版, 2010, 11(3): 84-88.

